环境因子对茅台镇不同轮次酿造环境细菌群落结构多样性的影响
2022-05-09胡小霞黄永光
王 琳,胡小霞,黄永光*
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
作为中国传统白酒的典型代表之一,酱香型白酒产量虽然只占中国白酒的3%左右,但利润却占了中国白酒行业的40%以上[1-2]。酱香型白酒发酵主要分为3个典型固态发酵阶段,即大曲制备、堆积发酵和入池发酵[3-4],其中大曲制备和堆积发酵会网罗酿造环境中的微生物菌群,说明酿造环境中必然存在与发酵相关的微生物[5]。王欢等[6]在酱香型白酒机械化酿造7个轮次堆积发酵酒醅中检测出14个门、456个属,Kroppenstedtia、Acinetobacter、Caulobacter、Bacillus和Lactobacillus等12个为优势细菌属。吴徐建[7]利用传统可培养方法研究了酱香型白酒2~7轮次环境、大曲及酒醅中的酵母和细菌多样性,结果表明,Zygosaccharomyces bailii、Saccharomyces cerevisiae、Bacillus licheniformis和Bacillus amyloliquefaciens是堆积发酵过程中最主要的酵母与细菌种属,其还验证了堆积酒醅中的细菌主要来源于大曲,而酵母主要来自于堆积发酵的地面。Wang Xuanshan等[8]运用高通量测序技术与Source Tracker方法相结合,研究了酿造环境微生物对白酒发酵过程的贡献,结果表明环境微生物是发酵微生物的重要来源,而且环境微生物可以驱动白酒发酵生态系统的稳定性。Pang Xiaona等[9]研究了环境微生物菌群对清香型白酒酿造微生物的影响,发现酒醅中的Lactobacillus acetotolerans主要来源于空气。庞晓娜[10]对比分析了不同时期酿造环境与大曲微生物的多样性,结果表明大曲和空气中的细菌菌群结构比较相似;并应用Source Tracker对不同时期发酵过程的细菌来源进行分析,发现车间和地缸表面为清香型白酒发酵提供了重要的微生物来源。上述文献均表明参与酿造过程的微生物与酿造环境微生物关联非常密切,而且酿造环境中微生物之间存在相互作用,这些微生物在长期自然驯化过程中借助复杂的微生物相互作用实现了功能定向进化[11]。
微生物的生长、繁殖、衰亡与其生存的环境密切相关,受环境因子的影响较大[10,12-13]。研究表明茅台地区赤水河水体[14]和茅台镇空气[15]夏季样品中的微生物多样性相对其他3个季节更加丰富,说明该地区夏季的气候条件更适合微生物生长繁殖。王鹏等[16]利用冗余分析和蒙特卡洛置换检验研究环境因子对中国白酒发酵过程中核心微生物群的影响,结果表明水分含量、温度等环境因素对核心微生物菌群影响较大。杜海[17]通过考察白酒酿造特定环境因子,如水分、温度和pH值等环境因子对产土味素菌株的影响,发现产土味素的链霉菌在含水量50%的酿造基质、温度30 ℃、中性偏碱性的环境中可大量繁殖。陈雪等[18]分析了凤香型白酒发酵酒醅微生物多样性与环境因子的相关性,发现温度与细菌多样性呈极显著负相关。由此可见,环境因子直接影响了酿造环境微生物的生长繁殖,对白酒酿造过程中的微生物菌群存在直接或间接作用,从而导致白酒风味的差异。因此,研究环境因子与环境微生物的相关性对于了解环境因子对白酒产区的形成、功能影响具有重要意义。
为揭示茅台镇1~7轮次酿造环境中的细菌菌群结构多样性及环境因子对其影响,本研究以茅台镇酿造环境中细菌群落为研究对象,通过高通量测序技术与数理统计结合研究酿造环境样本中细菌菌群结构组成、分布和环境因子的关联性,旨在解析环境因子与酿造环境优势细菌群落的相关性,为茅台镇酱香型白酒酿造环境微生态结构、资源价值评价、产业发展等研究提供数据基础理论及科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品采自贵州省仁怀市茅台镇酱香型白酒酿造区域的17个代表性酿酒企业(分布于7个主要酿酒区域,简称7个主酿区)周边的酿造环境[19]。环境样品采集涵盖采样酿造企业周边200 m内范围的生产车间晾堂、产房墙角地面土尘、灰尘,车间窗户玻璃、窗台、墙体表面的灰尘、粉尘等。取样时间为2018年1ü9月,茅台镇酱香型白酒酿造1~7轮次的堆积发酵期,每轮次对酿造环境进行3~5 d采样。每个采样企业的样品采集均固定在同一采样点。从17个酿造企业酿造环境中共采集119个环境样品,按照区域划分将从每个酒厂采集的样品采用等量混合为该区域的综合样,7个轮次共计49个环境区域的最终混合样品,每轮次采集样品取完后及时转移至-80 ℃冰箱密封保存。
1.1.2 试剂
E.Z.N.A.Soil DNA Kit 美国Omega BioTek公司;rTaqDNA聚合酶试剂盒 北京全式金生物技术有限公司;DNA Marker 宝日医生物技术(北京)有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、引物合成 上海生物工程股份有限公司;异丙醇(分析纯) 天津市富宇精细化工有限公司;TEA缓冲液、Gengreen染料 上海赛百盛有限公司。
1.2 仪器与设备
台式高速冷冻离心机 德国Sigma公司;G154DW高压蒸汽灭菌锅 厦门致徽仪器有限公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪美国ABI公司;DYY-8C电泳仪 北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品总DNA提取
参考文献[19]报道的方法,主要步骤为:1)取每个混匀的最终样品各20 g于100 mL离心管中,加入35 mL灭菌后的0.1 mol/L PBS悬浮和3~5 颗玻璃珠,充分振荡7 min,400 r/min离心5 min,吸取上清液;2)沉淀用PBS洗涤,漩涡振荡4 min,400 r/min离心5 min,收集上清液;3)重复上一步操作共收集40~50 mL上清液,配平后于12 000 r/min离心5 min,弃上清液,收集细胞沉淀。预处理后每个样品的总DNA提取步骤参考E.Z.N.A.Soil DNA Kit的操作说明书。
1.3.2 PCR扩增
细菌PCR扩增引物:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGG GTWTCTAAT-3’)。扩增程序:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系(20 μL):4 μL 5hFastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA 模板。
1.3.3 Illumina MiSeq测序
利用Illumina公司的MiSeq PE 300平台,分别对细菌V3-V4高变区序列进行测序分析(上海美吉生物医药科技有限公司)。
1.3.4 环境因子
贵州省气象局检测提供每轮次采样期及其前后3 d的环境因子值,包括环境温度、空气湿度、降雨量、光照时长和大气压。
1.4 数据及图像处理
采用Microsoft Office Excel 2016进行数据计算和分析。基于Illumina MiSeq测序平台,利用IBM SPSS Statistics 26.0进行Student’st-检验和Spearman相关性分析;Origin 2017和TB-tools绘制箱线图、丰度图和Heatmap图等。
2 结果与分析
2.1 α多样性分析
通过α多样性分析可以得到群落中物种的丰富度、覆盖度和多样性等信息,常用的度量标准有Shannon指数、Chao指数、ACE指数和覆盖率。运用统计学Student’st-检验方法分析不同轮次酿造环境样本之间的指数值是否具有显著差异。本研究茅台镇不同轮次酿造环境样本的菌群多样性指数显著性分析(可操作分类单元(operational taxonomic units,OTU)水平)见图1。
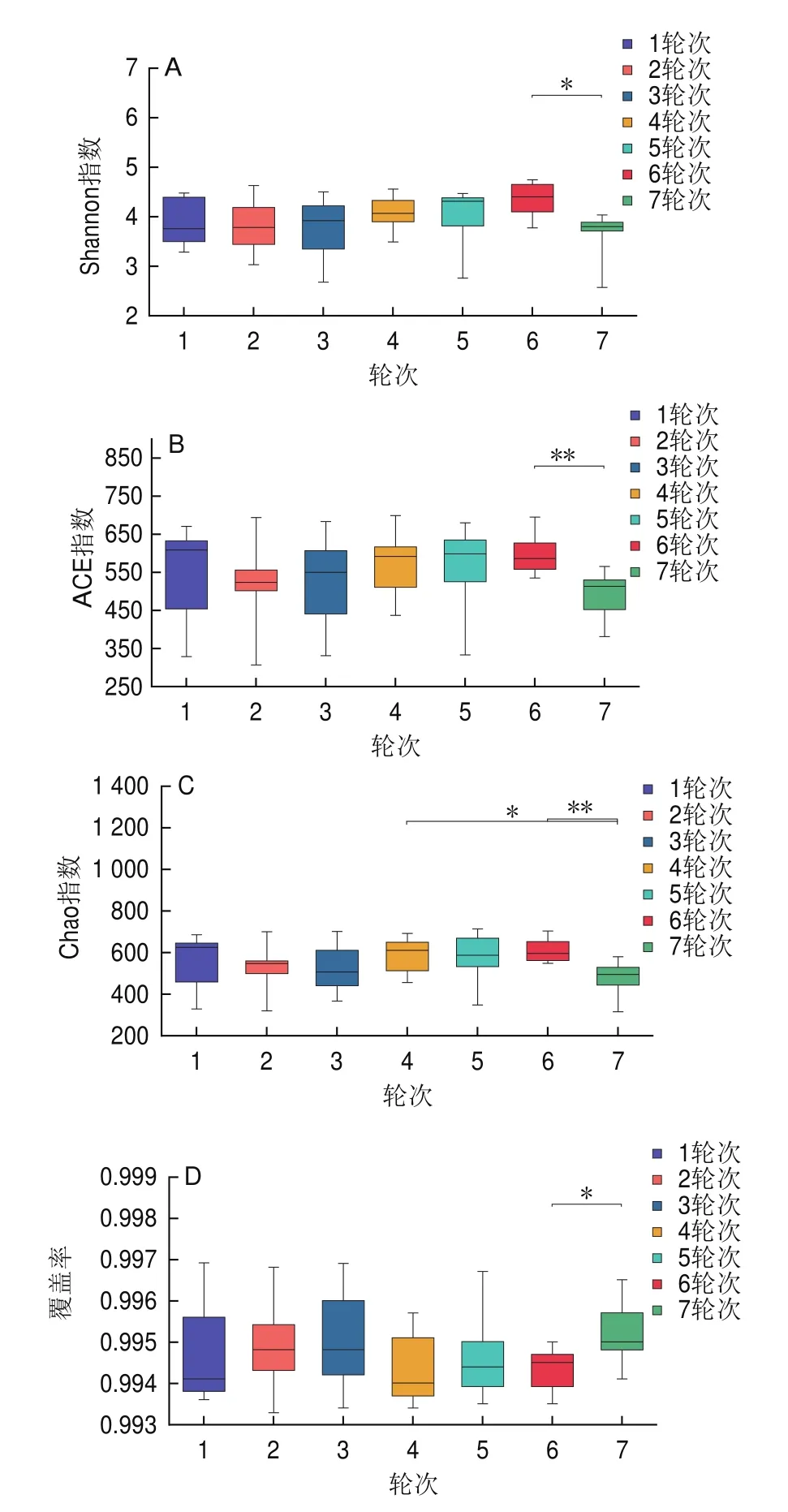
图1 各环境样品细菌菌群多样性指数及其显著性分析(OTU 水平)Fig.1 Diversity index and significance analysis of bacterial communities in environmental samples (OTU Level)
从图1可看出,7个轮次的酿造环境样品之间的差异显著性较小。从图1A、B可知各个轮次的Shannon指数和ACE指数相差不大,Shannon指数和ACE指数表明,1、4、5、6轮次酿造环境的细菌多样性和丰富度明显高于其他轮次,该结果表明这4个轮次期间(1月、5月、6月和7月)的环境气候条件适宜于细菌生长[19]。Chao指数主要衡量样本的物种丰富度信息,其值越大群落丰度越高(图1C)。经t-检验发现,7轮次与6轮次差异极显著(P<0.01,n=49),与4轮次有差异(P<0.05,n=49)。覆盖率主要用于衡量测序深度(图1D),各轮次酿造环境的覆盖率均大于0.99,说明该信息足以揭示酿造环境样品中大多数样本的细菌菌群。基于Shannon指数、ACE指数和覆盖率经t-检验,6轮次与7轮次有差异(P<0.05,n=49)。
通过α多样性分析结合t-检验进一步分析茅台镇酱香型白酒不同轮次酿造环境中的物种丰富度和差异显著性。结果表明,茅台镇7个轮次酿造环境的细菌多样性丰富度高,且只有7轮次与4轮次和6轮次环境细菌群落结构多样性和物种多样性存在差异,其他轮次酿造环境中的细菌菌群结构具有明显的相对稳定性特征。
2.2 α多样性与环境因子的关系
为揭示茅台镇酿造环境中的微生物多样性与环境因子间的相关性,利用SPSS Statistics 26.0进行Spearman相关性分析[20]。从图2可看出,Shannon指数、ACE指数、Chao指数和覆盖率与降雨量相关性较弱,但与其余4个环境因子相关性强,其中Shannon指数与环境温度和光照时长相关性显著;ACE指数和Chao指数与环境温度和湿度显著相关;覆盖率与环境温度、湿度和大气压存在显著相关性。同样,从轮次角度分析发现,4个指数在6轮次酿造环境样本中均与5个环境因子具有较弱的相关性,而其他轮次与1种或多种环境因子存在显著相关。例如,在1轮次中Shannon指数与光照时长呈显著负相关,在7轮次中Chao指数与温度和湿度呈显著正相关,而在2轮次中ACE指数与湿度显著负相关,Chao指数和覆盖率与温度、湿度和大气压具有显著正相关。综上结果表明,不同轮次的环境因子对细菌菌群多样性存在一定调控,细菌α多样性在一定程度上与气候条件因子相关,而且各轮次的相关程度存在差异,对细菌菌群的显著影响主要在2轮次和3轮次。
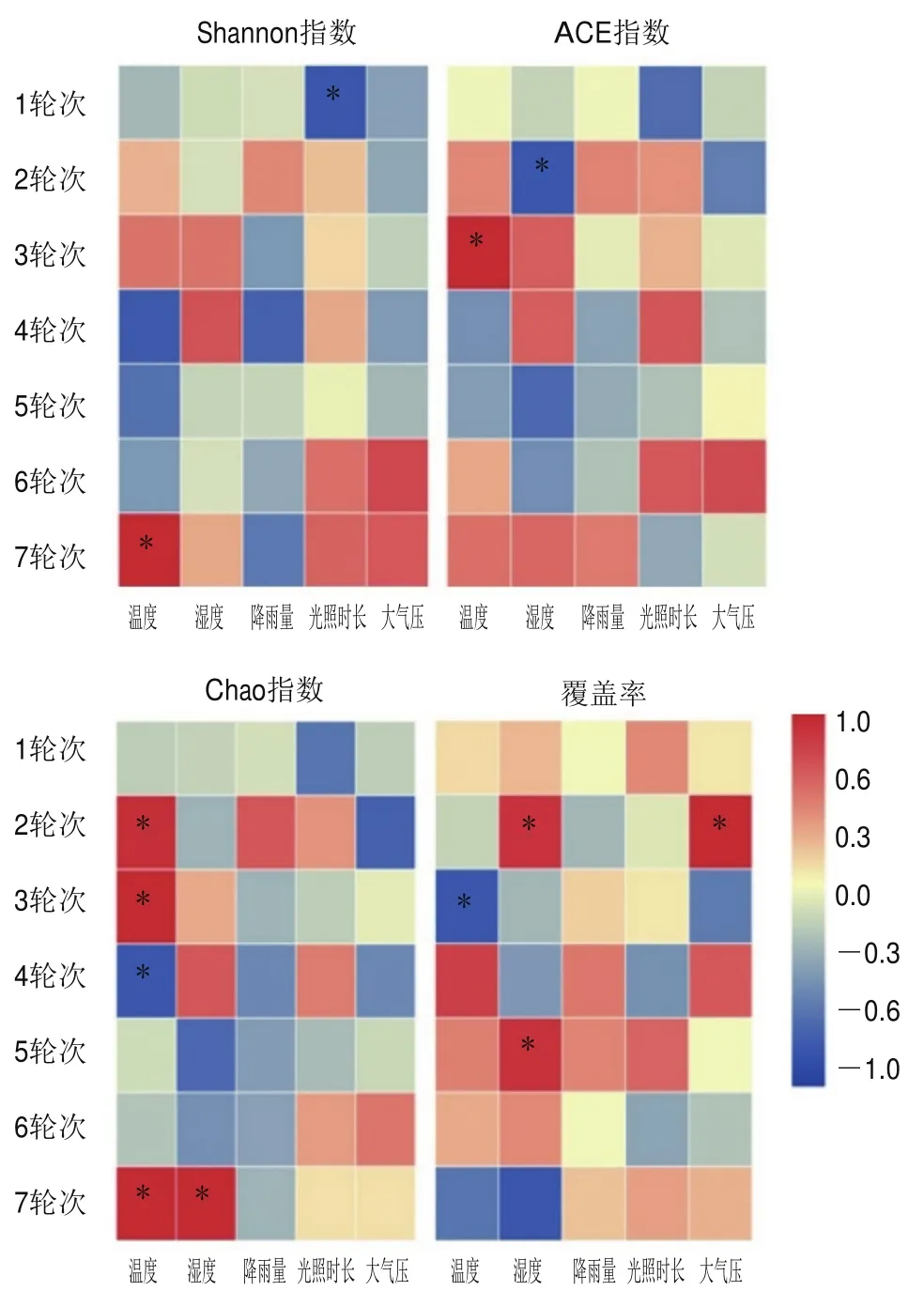
图2 细菌α多样性指数与环境因子的Spearman等级相关系数的热图Fig.2 Heatmaps of Spearman’s rank correlation coefficients of bacterial α-diversity metrics with environmental factors
2.3 细菌物种与菌群结构分析
如图3A所示,从茅台镇酱香型白酒1~7轮次酿造环境依次检出27、28、29、30、28、31个和26个细菌纲,共检出33个纲类。从微生物的含量丰度高低看,其中Gammaproteobacteria(平均相对丰度为36.09%)在所有样本中的含量最为丰富,且在7轮次样本中占比最高,达到了59.15%,在3轮次中占比最低(19.78%)。第2丰富的优势菌纲为Bacilli(25.40%),其在1~6轮次酿造环境样本中相对丰度较稳定,为20.70%~32.10%,但在7轮次的相对丰度仅7.33%。第3优势细菌纲为Sphingobacteriia(15.79%),第4优势菌纲为Alphaproteobacteria(7.05%),第5优势菌纲为Actinobacteria(6.92%)。其他优势细菌纲分别为Flavobacteriia(5.35%)、Betaproteobacteria(2.08%)、Bacteroidia(0.42%)、norank_p_Saccharibacteria(0.28%)、Cytophagia(0.19%)和Clostridia(0.11%)。除了前述11个优势纲外,其余22个相对丰度<0.10%的纲出现在“others”中,包括Deinococci(0.08%)、Cyanobacteria(0.03%)、Chlamydiae(0.03%)、Verrucomicrobiae(0.03%)、Deltaproteobacteria(0.02%)等。结果表明,茅台镇酱香型白酒酿造环境不同轮次间的优势细菌菌纲基本一致,其中Gammaproteobacteria、Bacilli、Sphingobacteriia、Alphaproteobacteria、Betaproteobacteria、Flavobacteriia和Actinobacteria为酿造环境中的优势细菌纲。进一步说明茅台镇酿造环境中的微生物具有一定的共性和稳定性,这为茅台镇酿造产区的形成奠定了微生物生态基础优势及其特征微生态结构。Du Hai等[21]研究也发现制曲环境样品中的5个纲(Bacilli、Gammaproteobacteria、Alphaproteobacteria、Actinobacteria和Sphingobacteriia)为优势细菌纲,与本研究结果一致。其中,Bacilli和Gammaproteobacteria也是高温大曲[22]和酒醅[23]中的优势细菌纲。Zuo Qiancheng等[22]比较了酱香型高温大曲传统制曲和机械化制曲中的细菌菌纲,发现Alphaproteobacteria、Betaproteobacteria、Actinobacteria和Cyanobacteria的相对丰度在机械化高温大曲发酵过程中显著高于传统制曲。
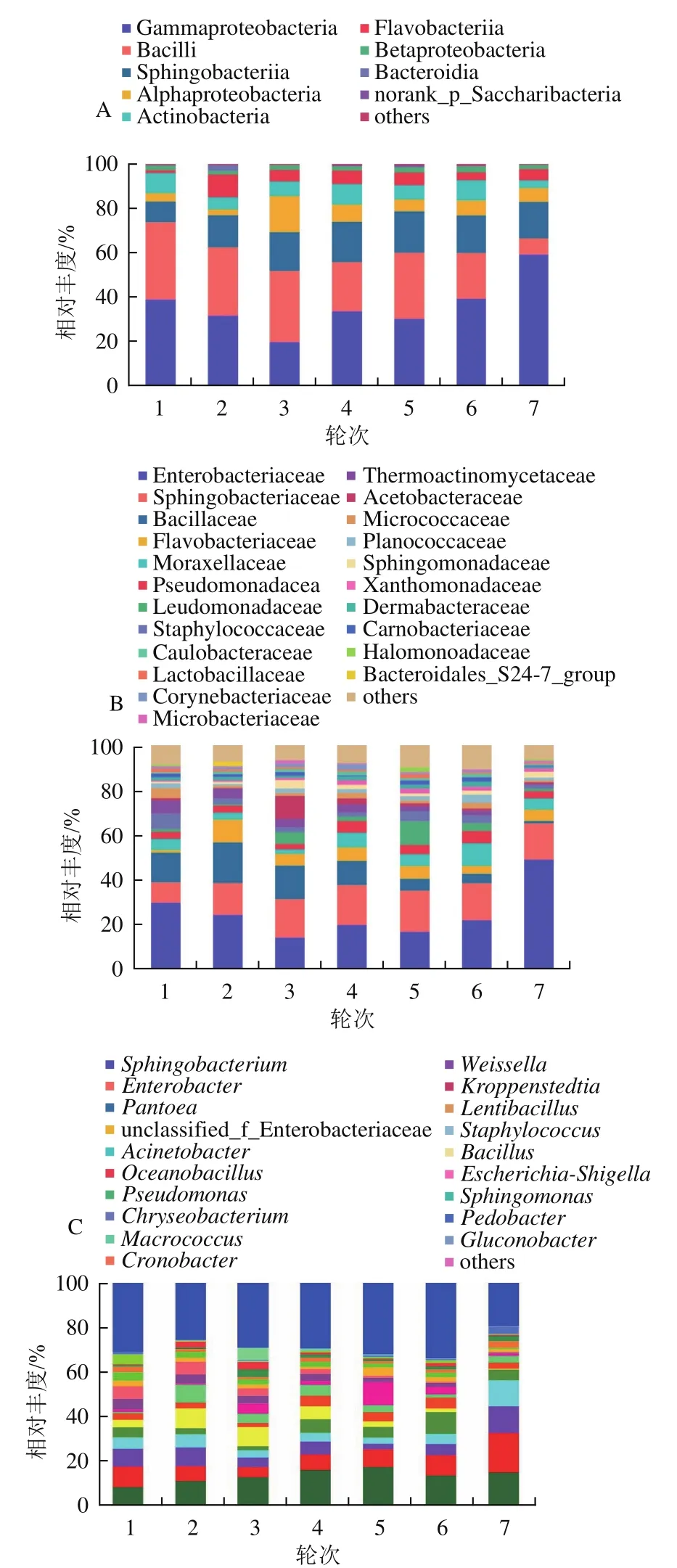
图3 环境样品在纲水平(A)、科水平(B)和属水平(C)上的细菌菌群结构Fig.3 Bacterial community structure of environmental samples at class level (A), family level (B) and genus level (C)
如图3B所示,在科水平上,不同轮次酿造环境中的细菌群落在数量及结构分布上多样性特征较明显,从1~7轮次分别检测出120、119、117、127、132、144个和119个科,共检出153个科。第1优势细菌科为Enterobacteriaceae(平均相对丰度为24.86%),其在7轮次酿造环境样本中含量最高(48.70%),3轮次含量最低(13.95%),Sphingobacteriaceae为第2优势科,其在7个轮次的相对丰度较稳定,平均相对丰度为15.68%。第3优势科为Bacillaceae(平均相对丰度为9.59%),在2轮次最高,达到了18.03%,随着生产轮次的进行,其相对含量逐渐降低到1.03%。其他优势细菌科主要包括Flavobacteriaceae(5.35%)、Moraxellaceae(5.18%)、Pseudomonadaceae(3.86%)、Leuconostocaceae(3.41%)、Staphylococcaceae(3.29%)、Thermoactinomycetaceae(3.29%)、Acetobacteraceae(2.44%)、Planococcaceae(1.06%)、Lactobacillaceae(0.59%)和Enterococcaceae(0.27%)等,占各轮次酿造环境样品细菌总科和的87.79%~93.09%。从图3B还可知,2轮次酿造环境中的特有优势细菌科(仅在1个轮次中的相对含量≥1%)包括Bacillales(1.19%)和Bacteroidales_S24-7_group(1.85%),Microbacteriaceae(1.56%)为3轮次特有优势科,Halomonadaceae(2.02%)为5轮次特有优势科,Brucellaceae(1.04%)是7轮次特有优势科,而1、4轮次和6轮次无特有优势科。本研究还发现,Flavobacteriaceae、Planococcaceae、Bacteroidales_S24-7_group、Microbacteriaceae和Brucellaceae是目前尚未在白酒酿造环境中被认为是优势菌的微生物科类。Wang Li等[24]基于高通量测序技术对酱香型白酒发酵过程中的3个重要阶段(制曲、堆积发酵和窖池发酵)的细菌菌群结构多样性进行了研究,发现Bacillaceae、Lactobacillaceae、Leuconostocaceae和Enterococcaceae的相对含量大于15.84%,还在茅台镇酱香型白酒酿造过程中检出了Planococcaceae,而且在其他类型的白酒酿造过程中鲜少被报道过。推测此细菌极有可能来源于茅台镇酿造环境。由此可见,酿造环境中的微生物可能通过大曲制曲、堆积发酵迁徙进入到酿造过程,为白酒酿造提供微生物来源。前述部分优势微生物也被证实为酿造过程的功能微生物,如Bacillaceae可以代谢C4化合物、吡嗪、挥发性酸、芳香族和酚类化合物,以增加酱香型白酒的特色香气浓度[25]。Leuconostocaceae、Lactobacillaceae和Enterococcaceae为主要的乳酸菌科类,其功能可将乳糖转化为乳酸,也是代谢酱香型白酒的主要风味成分乙酸乙酯的重要微生物[24,26]。同样,Li Xianran等[27]从清香型白酒发酵酒醅中检出了15个细菌科,结果显示,Lactobacillaceae、Bacillaceae和Staphylococcaceae为酒醅样本中的优势菌科。Tian Ning等[28]基于宏基因组学发现Lactobacillaceae、Enterobacteriaceae、Leuconostocaceae、Bacillaceae、Pseudomonadaceae和Acetobacteraceae等为十里香白酒大曲中的主要细菌科。李可[29]在浓香型白酒发酵黄水中发现Planococcaceae为可培养细菌菌群的优势菌科。
如图3C所示,在酿造环境样本中属水平上共检出396个属[19],平均相对丰度≥1.00%有22个,主要包括Sphingobacterium、Enterobacter、Pantoea、unclassified_f_Enterobacteriaceae、Acinetobacter、Oceanobacillus和Pseudomonas等。属水平的结果表明,茅台镇酱香白酒各酿造轮次期间酿造环境中的细菌群落在属水平上其种类非常丰富,为该酿造产区酱香白酒酿造提供给了丰富的微生物生态资源,进一步为酱香白酒复杂风味结构形成奠定了基础。
上述结果表明,在纲、科和属水平上,不同轮次酿造环境样本中的细菌菌群种类非常丰富,而且优势菌纲、优势菌科和优势菌属在结构组成上具有高度的一致性。说明茅台镇酱香白酒酿造环境中的主要细菌菌群结构具有较高的相对稳定性,也表征了茅台镇在酿造酱酒活动过程中长期驯化环境微生物所形成固有的特征性菌群结构,为酿酒微生态结构的优化、稳定性奠定了基础。
2.4 优势细菌菌群与环境因子的关系
基于酱香型白酒酿造过程中的酿造微生物一部分来自于酿造环境中的优势微生物,而且微生物也存在复杂的分类结构,因此有必要筛选出纲、科和属水平下的优势细菌(平均相对丰度≥1.00%),研究其与环境因子之间的相关性(图4)。从茅台镇1~7轮次酿造环境样本中检测出的细菌在纲、科和属水平上筛选出了48种优势细菌类别,其中7种优势细菌纲、19种优势细菌科和22种优势细菌属。统计分析表明,环境温度与16种优势细菌相关性显著(10种呈正相关,6种负相关),主要是Alphaproteobacteria纲及其亚类群和Bacilli纲及其亚类群。Alphaproteobacteria纲及其亚类群与温度呈显著正相关,包括Alphaproteobacteria(ρ=0.350)、Acetobacteraceae(ρ=0.488)、Sphingomonadaceae(ρ=0.283)、Caulobacteraceae(ρ=0.290)和Brevundimonas(ρ=0.284)。Bacilli纲中的Bacillaceae(ρ=-0.489)、Lentibacillus(ρ=-0.598)、Bacillus(ρ=-0.387)、Oceanobacillus(ρ=-0.419)、Thermoactinomycetaceae(ρ=0.284)和Kroppenstedtia(ρ=-0.347)与温度显著负相关,而Planococcaceae(ρ=0.291)、Leuconostocaceae(ρ=0.384)、Weissella(ρ=0.394)与温度显著正相关。环境湿度与7种优势细菌相关性显著(5种呈正相关,2种呈负相关),其中Gammaproteobacteria(ρ=0.342)、Enterobacteriaceae(ρ=0.376)、Escherichia-Shigella(ρ=0.366)、Enterobacter(ρ=0.367)和Pantoea(ρ=0.347)与湿度呈显著正相关,Rhodospirillales(ρ=-0.363)、Acetobacteraceae(ρ=-0.298)呈负相关。Acetobacteraceae(ρ=-0.298)和Actinobacteria(ρ=-0.359)与湿度显著负相关。降雨量与10种优势细菌相关性显著(2种呈正相关,8种呈负相关),显著负相关的菌主要是Bacilli纲的大多数亚类群,例如Bacillaceae(ρ=-0.393)、Lentibacillus(ρ=-0.450)、Thermoactinomycetaceae(ρ=-0.451)和Lactobacillaceae(ρ=-0.325)等。Cronobacter(ρ=0.312)、Alphaproteobacteria(ρ=0.278)与降雨量呈显著正相关。光照时长与20种优势细菌相关性显著(15种呈正相关,5种呈负相关),其中显著负相关的菌有Enterobacteriaceae(ρ=-0.401)、Escherichia-Shigella(ρ=-0.381)、Enterobacter(ρ=-0.333)、Pantoea(ρ=-0.349)和Lentibacillus(ρ=-0.341);显著正相关的菌主要是Bacilli纲及其亚类群和Actinobacteria纲及其亚类群,在Bacilli纲及其亚类群中主要是Planococcaceae(ρ=0.383)、Leuconostocaceae(ρ=0.390)、Weissella(ρ=0.425)、Carnobacteriaceae(ρ=0.367)等;Actinobacteria纲及其亚类群全部都与光照时长呈显著正相关,包括Actinobacteria(ρ=0.418)、Micrococcaceae(ρ=0.323)、Kocuria(ρ=0.403)、Dermabacteraceae(ρ=0.453)、Brachybacterium(ρ=0.453)。大气压与5种优势细菌相关性显著(2种呈正相关,3种呈负相关),与大气压显著负相关的菌群有Cronobacter(ρ=-0.314)、Pseudomonadaceae(ρ=-0.352)、Pseudomonas(ρ=0.313),与大气压呈显著正相关的菌群有2个,分别是Lentibacillus(ρ=0.342)、Actinobacteria(ρ=0.418)。
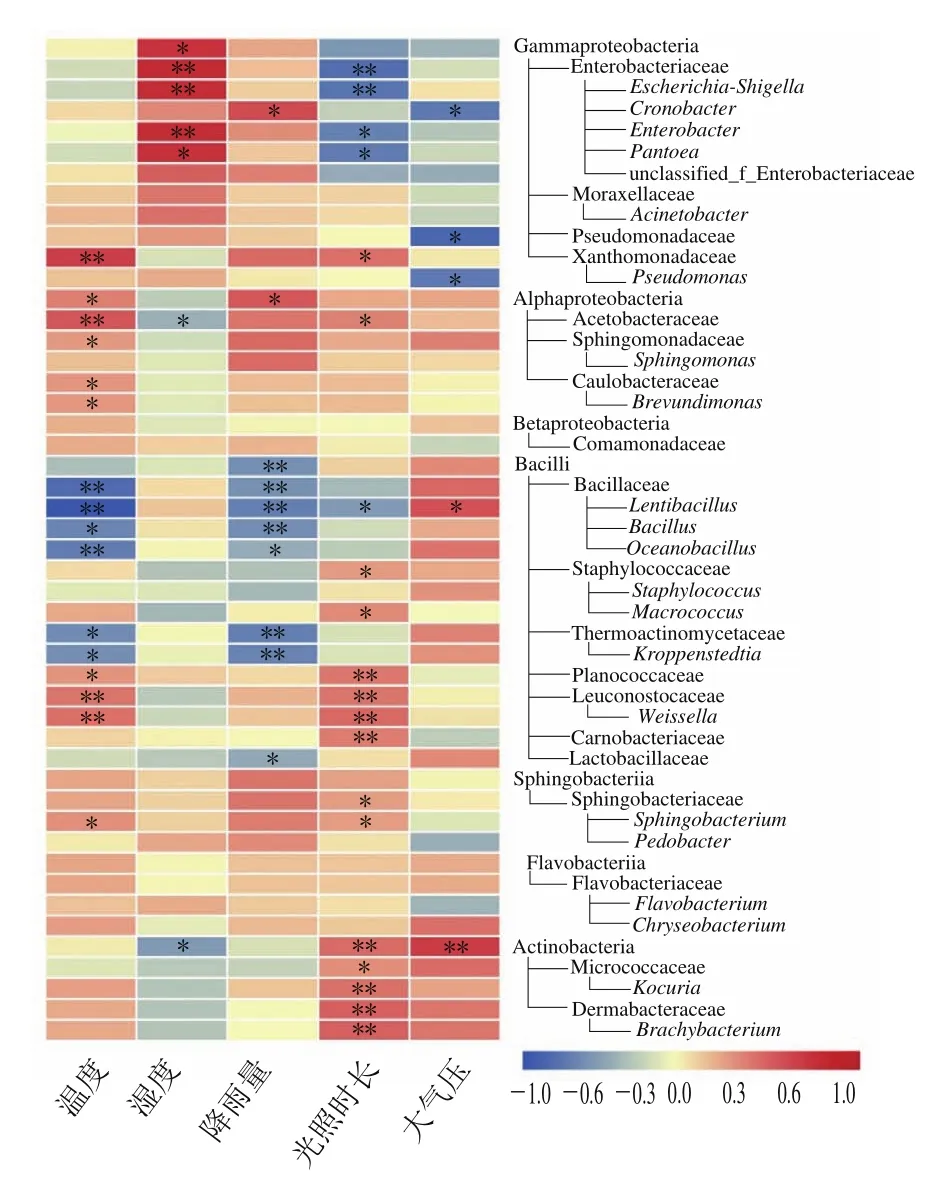
图4 纲、科、属水平优势细菌菌群的相对丰度(平均相对丰度≥1.00%)与环境因子之间的Spearman等级相关系数的热图Fig.4 Heatmap of Spearman’s rank correlation coefficients between relative abundances of dominant bacterial classes, families and genera(average relative abundance ≥1.00%) and environmental factors
Bacillus和Weissella是白酒发酵过程中的主要功能细菌菌群,在多种香型白酒发酵过程中均有报道[30,23]。其中作为大曲重要核心细菌属的Bacillus为关键的产酸和产香菌,可代谢4-甲基吡嗪、乙偶姻等白酒关键风味物质[19]。Weissella为高、中、低温大曲和小曲中的主要细菌之一,可代谢产生乳酸、乙酸等有机酸类,是发酵的启动剂[31]。研究发现,环境温度是影响Bacillus[32]和Acetobacter[33]性能的重要原因之一,40 ℃条件下的Bacillus菌株比20 ℃条件下具有更多的高温耐受性,代谢更多脂肪酸[32],其能加快乙醇在体内的代谢,降低白酒的醉度[34]。Wang Li等[24]发现Planococcaceae受气候条件的调控较大,其可能通过产生其他次级代谢产物而影响白酒的质量和风味。本研究还发现该菌与环境温度与光照时长正相关性显著。
上述结果表明,环境因子与茅台镇酿造环境中大约73%的优势细菌群落相关性显著,其中环境温度和光照时长对酿造环境中优势细菌菌群结构起决定性调控作用,其次是湿度和降雨量,大气压对环境微生物的影响最小。进一步证明了茅台镇特有的气候环境为参与酱香型白酒酿造的微生物菌群繁衍生息提供了适宜的条件,使酿造微生物得到了长期稳定的繁殖、生长、富集。
3 结 论
基于高通量测序技术及数理统计分析方法研究了茅台镇不同轮次酿造环境细菌菌群结构多样性及环境因子对其的影响,在纲水平上共检出33个细菌纲类,其中Gammaproteobacteria、Bacilli、Sphingobacteriia、Alphaproteobacteria、Actinobacteria、Flavobacteriia和Betaproteobacteria为优势细菌纲,在科水平上共检出153个细菌科类,优势科有19个,包括Enterobacteriaceae、Sphingobacteriaceae、Bacillaceae、Flavobacteriaceae、Thermoactinomycetaceae、Planococcaceae等。其中Flavobacteriaceae、Planococcaceae、Bacteroidales_S24-7_group、Microbacteriaceae和Brucellaceae是目前尚未在白酒酿造环境中被认为是优势菌的微生物科类。在酿造环境样本中属水平上一共检出396个属,平均相对丰度≥1.00%有22个,主要包括Sphingobacterium、Enterobacter、Pantoea、unclassified_f_Enterobacteriaceae、Acinetobacter、Oceanobacillus和Pseudomonas等。α多样性分析结合t-检验发现茅台镇酱香型白酒7个酿造轮次期酿造环境细菌多样性极其丰富,且只有7轮次与4轮次和6轮次环境细菌群落结构多样性和物种多样性存在差异。细菌α多样性与环境因子存在一定程度的相关性,2轮次和3轮次酿造环境中细菌群落与温度和湿度的相关性较显著。运用Spearman相关性分析环境因子与酿造环境中的优势细菌菌群之间的相关性,发现纲、科、属水平的48种优势细菌类群中,有35种与一种或多种环境因子具有显著相关性,其中Gammaproteobacteria纲及其亚类群和Bacilli纲及其亚类群与5个环境因子均有显著相关性,特别是温度、湿度和光照时长对这两个纲类的影响较大,其中主要包括Escherichia-Shigella、Enterobacter、Pantoea、Lentibacillus、Bacillus和Oceanobacillus等。Alphaproteobacteria纲中,Acetobacteraceae、Sphingomonadaceae、Caulobacteraceae、Brevundimonas与环境温度正相关显著。Sphingobacteriia纲及其亚类群中的Sphingobacterium与温度和降雨量的相关性较显著。Actinobacteria纲的Micrococcaceae、Kocuria、Dermabacteraceae、Brachybacterium均与光照时长呈显著正相关。Betaproteobacteria纲及其亚类群和Flavobacteriia纲的Flavobacterium和Chryseobacterium受环境因子的影响最小。
本研究对茅台镇不同轮次酿造环境样本的细菌群落结构进行了分析,对茅台镇环境中的细菌菌群结构更加了解,环境因子不仅调节细菌多样性,还直接影响了细菌菌群结构组成及其功能,特别是环境温度和光照时长。为充分认识酿造环境中的细菌菌群结构及其与环境因子之间的关系提供了基础理论和学科依据。
