血浆β-淀粉样蛋白42、β-淀粉样蛋白40、α-突触核蛋白及p-tau181蛋白水平对初诊帕金森病患者轻度认知功能障碍的诊断价值
2022-05-09刘涛闫磊王雅洁刘卫国
刘涛,闫磊,王雅洁,刘卫国
帕金森病(PD)轻度认知功能障碍(PD-MCI)是PD痴呆(PDD)的早期症状,对患者生活质量有一定影响[1]。研究[2]认为边缘叶及大脑皮质的α-突触核蛋白(α-syn)异常沉积是PDD的主要病理生理机制,同时也有相当大比例的PDD患者存在Alzheimer’s病(AD)病理变化,如β-淀粉样蛋白(Aβ)形成的神经炎性斑块及p-tau181蛋白形成的神经原纤维缠结。因此,研究PD-MCI时也将CSF和周围血液α-syn和Aβ42、Aβ40、α-syn及p-tau181蛋白水平作为生物标志物用于PD-MCI的辅助诊断和预测,但研究结果并不一致。有研究[3]发现初诊PD患者的MCI发生率已达到40%,但上述指标在该病程阶段的研究较少。目前单分子阵列技术(SiMoA)已成为国际上体液蛋白组学研究的标准方法。本研究使用SiMoA技术对南京脑科医院初诊PD-MCI患者血浆α-syn和Aβ42、Aβ40、α-syn及p-tau181进行检测,探讨其变化规律及对PD-MCI的临床应用价值。
1 对象与方法
1.1 对象 (1)PD组:选取2018年7月至2021年5月至南京脑科医院门诊就诊的早期PD患者55例[Hoehn-Yahr(H-Y)分级为1~2.5级],男性21例,女性34例;平均病程(1.9±1.1)年;平均年龄(58.1±7.8)岁。入组均符合英国脑库原发性PD诊断标准。根据蒙特利尔认知评估量表统(北京版)(BJ-MoCA)进行认知评估,分为PD伴MCI组(PD-MCI组,32例)和PD认知功能正常组(PD-NC组,23例)。(2)正常对照组(NC组):选取21名性别、年龄、教育程度相匹配的男性9人,女性12人;平均年龄(61.5±6.9)岁。所有入组者均无明显头部外伤、严重心脑血管病病史、精神疾病及其他干扰本研究的病史。PD组和NC组年龄、性别、受教育程度均匹配。本试验已经获得了南京脑科医院伦理委员会批准,所有入组者均签署知情同意书。
1.2 方法
1.2.1 问卷量表评估 应用BJ-MoCA量表进行认知评估。MCI诊断标准依据2011年贾建平教授针对中国老年群体提出的常模获得MCI的截断值:教育年限为0年者,MoCA评分≤13分;教育年限<7年者,MoCA评分<19分;教育年限>7年者,MoCA评分<24分。该常模适应中国老年人群的人口学特征且具有较高的敏感性和特异性。计算MoCA子域视空间与执行功能、命名注意、语言、抽象、延迟回忆、定向力等得分。同时采用汉密尔顿抑郁量表(HAMD)、汉密尔顿焦虑量表(HAMA)、非运动症状问卷(NMS-Q)、统一PD评定量表第三部分(UPDRSⅢ)等对患者病情进行评估。
1.2.2 血浆中蛋白组学测定 使用全自动SiMoA HD-X平台(GBIO,中国杭州),通过SiMoA方法检测Aβ42、Aβ40、α-syn 、p-tau181血浆浓度。在SiMoA测定之前,将血浆样品分成等分试样并储存在-80 ℃冰箱。所有血浆样品使用Quanterixy样品稀释剂B以1∶4的比例稀释。样品先在冰面上解冻,涡旋混匀,4 ℃下10 000 r/min离心5 min。将RGP溶液温育30 min进行解冻。将生物素化的检测抗体25% QBlock缓冲液中稀释至2 μg/ml。在SβG稀释剂中将SβG稀释至300 pM。HD-X仪器选择“2-Step Assay”进行所有样品温育,洗涤和检查步骤。仪器全自动的将捕获抗体包被的磁珠与样品和检测抗体一起温育,然后与SβG一起温育形成免疫复合物。将免疫复合物重新悬浮在RGP溶液中,然后整个反应体系会加载到SiMoA定制的光盘中。所有的检测结果用AEB值表示。通过读取标准品及检测样品的AEB值,对血浆样本中的蛋白含量进行精准定量,操作过程严格按照SiMoA检测试剂盒说明书。通过校准曲线确定未知样品的浓度。将测得的血浆中Aβ42、Aβ40、α-syn 、p-tau181水平进行对数变换,以得到正态分布的数据供进一步分析。

2 结 果
2.1 各组间基线资料的比较 见表1、表2。PD组MoCA评分明显低于NC组,HAMD、HAMA、NMS-Q评分明显高于NC组(均P<0.05)。PD-MCI组HAMD评分明显高于PD-NC组(P<0.05)。
2.2 PD-NC组、PD-MCI组及NC组血浆蛋白组学水平的比较 见表3。PD-NC组、PD-MCI组及NC组间血浆Aβ42、Aβ40、α-syn、p-tau181蛋白水平及Aβ40/p-tau181、Aβ42/p-tau181比值的差异均无统计学意义。而PD-MCI组患者血浆Aβ42/Aβ40比值明显低于PD-NC组(P<0.05)。
2.3 血浆中Aβ42/Aβ40、Aβ40/p-tau181、Aβ42/p-tau181值与各个认知域评分的Pearson相关性分析 见图1。Pearson相关性分析结果显示,在PD组患者中,血浆中Aβ42/Aβ40比值与MoCA总分无明显相关性,而与MoCA细项中的视空间与执行功能(r=0.274,P=0.043)、语言认知域评分呈正相关(r=0.322,P=0.016);Aβ40/p-tau181、与Aβ42/p-tau181比值MoCA总分及其细项均无明显相关性。
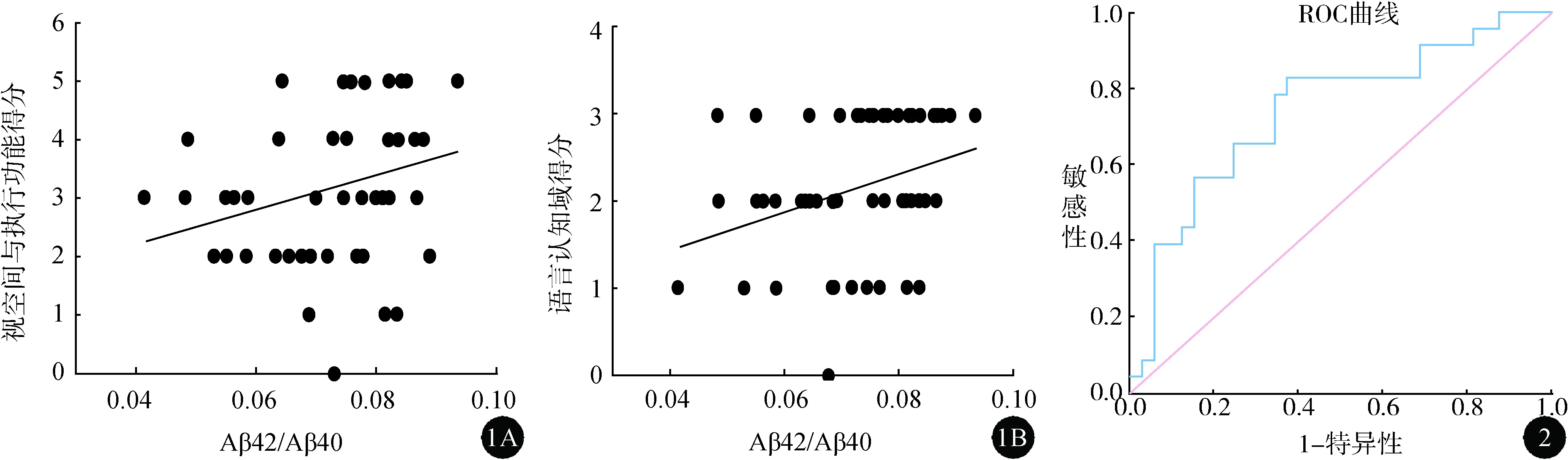
图1 血浆中Aβ42/Aβ40与PD-MCI组视空间与执行功能及语言认知域相关分析 图2 血浆中Aβ42/Aβ40值ROC曲线
2.4 血浆中Aβ42/Aβ40值对PD MCI的诊断价值分析 见图2。将三组比较有差异的Aβ42/Aβ40值纳入制作ROC曲线。血浆Aβ42/Aβ40值对PD-MCI诊断的曲线下面积(AUC)为0.738,P值为0.003。约登指数最大值为0.451,对应的Aβ42/Aβ40比值诊断截点为0.0738,该比值预测PD-MCI的敏感性为82.6%,特异性为62.5%。

表1 NC组与PD组基线资料的比较[ x±s,例(%)]组别例数年龄(岁) 性别(男)受教育年限(年)MoCA(分)HAMD(分)HAMA(分)NMS-Q(分)NC组2161.5±6.9 9(42.9)11.3±2.826.5±2.21.2±2.30.5±1.21.4±1.4PD组5558.1±7.821(38.2)10.1±3.222.8±3.48.6±5.86.0±4.37.5±3.5P值0.6790.7090.3790.0120.0000.0000.000
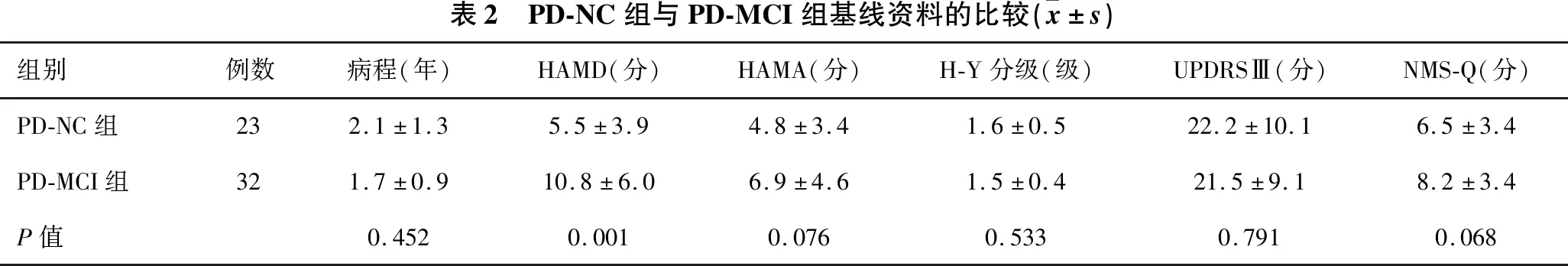
表2 PD-NC组与PD-MCI组基线资料的比较( x±s)组别例数病程(年)HAMD(分)HAMA(分)H-Y分级(级)UPDRSⅢ(分)NMS-Q(分)PD-NC组232.1±1.35.5±3.94.8±3.41.6±0.522.2±10.16.5±3.4PD-MCI组321.7±0.910.8±6.06.9±4.61.5±0.421.5±9.18.2±3.4P值0.4520.0010.0760.5330.7910.068

表3 PD-NC组、PD-MCI组及NC组血浆蛋白组学水平的比较[ x±s,例(%)]组别α-synAβ40Aβ42p-Tau181Aβ42/Aβ40Aβ40/p-tau181Aβ42/p-tau181NC组(n=21)3.641±0.3411.987±0.1080.832±0.1080.184±0.7960.071±0.01166.541±22.4134.622±1.327PD-NC组(n=23)3.561±0.4981.944±0.0850.836±0.5370.202±0.1450.079±0.00157.956±21.2724.486±1.377PD-MCI组(n=32)3.668±0.3831.978±0.0930.813±0.0960.224±0.2100.069±0.012△63.428±30.4474.330±1.920F值0.4711.3440.5370.4075.1150.6320.212P值0.3430.1880.3460.6170.0030.4410.725 注:与PD-NC组比较△P<0.05
3 讨 论
临床上确定PD-MCI多依靠量表,但评估者之间的差异和患者文化程度等多种因素会对评估结果产生影响,因此寻找能体现疾病病理过程的生物标记物已成为该领域的研究热点。CSF的成分反映了脑实质的代谢过程,源于CSF的成分研究是目前国际上神经系统疾病生物标志物研究的标准方法。但腰椎穿刺属于有创操作,轻症和大多数患者都不容易接受,这就限制了该方法的应用。而周围血液标本的研究越来越成为一种重要的替代方法。
血清中的Aβ42、Aβ40、α-syn、p-tau181蛋白浓度远低于CSF,传统ELISA存在灵敏度低、测量差异大等问题,故本研究采取SiMoA进行检测。这是一种超灵敏的技术,可检测飞克(fg/ml)水平的细胞因子,比ELISA检测灵敏度提高了1 000倍以上[4]。本研究通过该方法测定了早期初诊未服用抗PD药物患者血浆中的Aβ42、Aβ40、p-tau181、α-syn的血浆蛋白水平,观察该类指标在PD病程早期认知障碍识别中的价值。结果发现Aβ42、Aβ40、p-tau181、α-syn水平在PD与NC组及PD-NC与PD-MCI组间均没有明显差异。与既往研究[5-7]发现的p-tau181、α-syn的血浆蛋白水平在PD的中晚期相较于NC组中有更高的浓度水平结果不一致。Lin等[5]在检测血浆α-syn的蛋白水平时采用的是免疫磁还原法,该方法准确性与SiMoA检测方法类似,因此造成结果不一致的原因可能与本研究选择的患者是早期初诊PD患者,患者的病程较短、症状较轻有关。PD在不同疾病阶段的病理生理学机制是不同的。Hall等[8]提出在PD的早期阶段,毒性α-syn的隔离效应导致了功能性α-syn在细胞内聚集,因此CSF中的α-syn水平也降低,而随着病情进展隔离效应代偿功能减退,CSF中的毒性α-syn水平也逐渐增高,与此同时血液中的α-syn也逐渐增高。测定血浆中的Aβ浓度本来就存在很大挑战,而且血浆中的Aβ更容易受到血小板和其他能产生Aβ的脑外组织的影响[9]。因此血液中的Aβ42、Aβ40、p-tau181、α-syn与PD关系复杂,不仅能反映疾病本身,可能还可以反映疾病的分期。但这需要更多的纵向研究来研究分析不同疾病阶段的上述生物标志物的血浆值变化。
国外在研究AD及其他类型的痴呆时发现,血浆或CSF中的Aβ42/Aβ40、β42/p-tau181及Aβ40/p-tau181对诊断AD具有较高的准确性及敏感性,特别是血浆中的Aβ42/Aβ40比值,早期MCI患者较正常人明显偏低,且该比值偏低可使患者的痴呆风险增加70%,因该比值具有较高的敏感性及特异性,已经被纳入AD的诊断框架之中[10-12],但在PD中这种类型的研究尚较少。本研究另一个重要的研究结果发现,Aβ42/40比值在PD-NC组及PD-MCI组之间具有明显的区别,PD-MCI组较PD-NC组显著降低,可作为早期区分PD是否合并有认知功能障碍的客观依据。使用该指标来诊断PD是否合并认知功能障碍的敏感性达到了82.6%,这与国外对AD的研究[10]结果一致。而目前,国内外类似利用血浆中Aβ42/40比值来研究PD-NC及PD-MCI的很少。Alves等[13]发现,PD合并有认知功能障碍的患者CSF中的Aβ42/Aβ40水平明显低于正常对照组。这与本研究在血浆中发现的结果是一致的,但上述研究只局限于CSF研究。本研究进一步的数据分析发现Aβ42/40比值与PD受试者的MoCA认知量表细项评分也具有正相关性,如在视空间与执行功能、语言认知方面具有相关性。这可能与PD在不同疾病阶段损害的认知域不同有关。早中期PD患者认知功能障碍主要表现为皮质下痴呆,以视空间与执行功能、注意力、工作记忆下降为突出;而晚期PDD患者兼具皮质下痴呆及皮质性痴呆的特点,在注意力、执行能力、视空间能力及记忆力方面均表现出异常[1]。有一项31个月的纵向研究[14]评估PD患者认知下降的模式发现,从PD-NC进展到PD-MCI的过程中,患者的执行功能障碍和语言认知能力下降最为突出。这与本研究发现在PD组Aβ42/Aβ40比值与视空间与执行功能、语言认知具有显著正相关结果一致。因此在临床工作中可使用该比值来识别PD患者特定领域的认知损害。PD发展为痴呆的危险因素中,常见的如年龄>75岁、受教育程度低、病程超过10年等,还包括语义流畅受损及视空间能力受损,因此早期识别患者特定受损领域,重视危险因素的筛查有助于早期发现PDD,尽早给予干预治疗。
本研究存在一定的局限:SiMoA是一种较新的检测方法,其价格较昂贵,入组的健康对照及PD患者数量较少,可能存在统计误差;未来仍需要更多的研究来验证SiMoA的准确性;本研究入组患者为早期初诊PD患者,尚缺乏进一步的随访资料。
总之,本研究发现,PD-MCI患者血浆Aβ42/Aβ40比值明显低于PD-NC组,且该指标对诊断PD-MCI具有较高的敏感性,因此可用于PD认知功能障碍筛查和辅助诊断,具有一定的临床推广与应用价值。
