躯体症状障碍患者肠道菌群特征研究
2022-05-09董玲玲梁韵淋孙霞季陈凤倪开济骆艳丽
董玲玲,梁韵淋,孙霞,季陈凤,倪开济,骆艳丽
躯体症状障碍(Somatic Symptom Disorder,SSD)患者存在突出的躯体症状,胃肠道症状常见,其核心特征是围绕躯体症状的思维、情绪反应及患病行为异常。目前SSD的发病机制不明,可能与神经内分泌、免疫功能紊乱有关[1-2]。脑-肠轴是肠道与大脑交流的双向神经通路,由中枢神经系统、自主神经系统、肠神经系统和神经内分泌系统共同组成[3-4]。肠道菌群可以通过脑-肠轴作用于大脑,肠道菌群失调导致大脑功能的改变,在抑郁障碍、双相障碍、精神分裂症等精神疾病的发生发展中有重要作用[5-7]。目前尚无SSD患者肠道菌群结构的分析研究,本研究采用16S rRNA基因测序方法,通过比较SSD患者和健康对照者的粪便中肠道微生物的构成,评估SSD患者中肠道微生物变化特点,以深入研究其发病机制。
1 对象和方法
1.1 对象
通过方便采样法,选取2018年8月至12月在上海交通大学医学院附属仁济医院各临床科室门诊就诊的SSD患者25例为SSD组。所有患者均为首次发作,且未曾使用抗抑郁药治疗,年龄18~65岁。SSD的诊断由两位临床经验丰富的精神科主任医师根据美国《精神障碍诊断与统计手册》第5版(DSM-5)的诊断标准独立诊断。同时招募与患者组性别、年龄、教育程度相匹配的25名健康志愿者作为健康对照(Health Control,HC),记为对照组(HC组)。排除标准:SSD组合并精神分裂症、抑郁障碍、双相障碍等其他精神障碍/HC组有既往精神障碍病史;酒精或精神活性物质滥用史;患有慢性肝病、糖尿病、体质量指数(BMI)≥35.0 kg/m2、肠易激综合征、纤维肌痛;严格素食或荤食或严重偏食者;入组前1个月内使用过抗生素者。
本研究通过伦理委员会批准,所有受试在入组前均对研究知情,并签署知情同意书。
1.2 方法
1.2.1 一般人口学及临床资料收集 使用自制问卷收集受试一般资料,包括性别、年龄、教育程度、婚姻状况。使用15项患者健康问卷(PHQ-15)评估患者受躯体症状困扰的严重程度;多伦多述情障碍量表(TAS-20)评估患者述情障碍水平;使用17项汉密尔顿抑郁量表(HAMD)评估受试抑郁严重程度;汉密尔顿焦虑量表(HAMA)评估受试焦虑严重程度。所有量表评估均由1位临床经验丰富的精神科医师完成。
1.2.2 微生物多样性分析 肠道微生物采集:所有受试将大便解至干燥容器内,取粪便样本200~300 mg,装入大便盒中。研究者用取便器于样本中段里部取50~100 mg粪便转入无菌的2.0 ml离心管中,每个样本留取3~5管,作好标记,放入冰箱-80℃低温保存,样本采集过程在2 h内完成。待所有受试者样本收集完毕后,干冰封存,送至华大基因(武汉)进行16S rRNA高通量测序。
微生物信息分析:从样本中提取DNA,PCR预扩增检测样本是否合格。样本检测合格后进行可变区域扩增,扩增后的产物进行质检、纯化以及文库构建,构建好的文库经Qubit和qPCR定量,文库合格后,通过Illumina HiSeq进行双末端测序。下机数据去除接头污染序列、含N序列、低复杂度reads序列等低质量序列,获得高质量的clean data。通过reads之间的重叠关系将成对reads组装成一条序列,得到高可变区的Tags。根据相似度>97%,将Tags聚类成多个操作分类单元(Operational Taxonomic Units,OTU),通过与数据库对比,对OTU进行物种注释。基于OTU和物种注释结果进行样本物种复杂度分析以及组间物种差异分析。使用 QIIME软件(Version1.8.0)计算物种α多样性和β多样性。α多样性是对单个样本物种多样性的分析,包括5个指数:observedspecies指数、chao指数、Ace指数、Shannon指数和Simpson指数。指数越大,样品的物种越丰富; simpson指数越小,样品的物种越丰富。β多样性是用来比较一对样品在物种多样性方面存在的差异大小,分析各类群在样品中的含量,进而计算出不同样品间的β多样性值。本研究用weighted UniFrac衡量β多样性,它考虑了序列间的进化距离和序列的丰度,该指数越大表示样品间的差异越大。
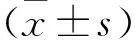
微生物多样性分析:①OTU及其丰度分析 统计每个样本的OTU个数,得出丰度信息初步说明样本的物种丰富程度。制作Venn图,重叠部分为两组共有的OTU,未重叠部分为两组各自特有的OTU。制作OTU Rank曲线,用于解释样本所含物种的丰富程度和均匀程度,曲线越宽,说明样品中物种组成越丰富;曲线越平坦,说明样品中物种组成的均匀度越高。②采用两样品比较的秩和检验分析α多样性各指数的组间差异。使用R(v3.1.1)软件中的NMF包的aheatmap作图制作β多样性矩阵热图(heatmap),通过图形将β多样性数据进行可视化,并对样品进行聚类,将具有相似beta多样性的样品聚类在一起,反映样品间的相似性。③物种注释分析 对SSD组与HC组在门、纲、目、科、属、种各分类水平的物种相对丰度采用独立双样本t检验进行组间比较分析肠道菌群组成异同。④对SSD组在α多样性以及属水平与HC组存在组间差异的菌群相对丰度与临床量表评分作Spearman相关分析。检验水准 α=0.05,双侧检验。
2 结果
2.1 两组一般人口学资料及临床资料比较
研究共纳入25例SSD患者及25名健康对照者,其中,由于微生物16S rRNA分析阶段质检不合格,剔除3份SSD组及1份HC组样本,最终有22例SSD组及24名HC组进入统计分析。两组年龄、性别、教育程度及婚姻状况差异均无统计学意义。SSD组HAMA和HAMD17总分均显著高于HC组,两组TAS-20总分差异无统计学意义。SSD组患者的病程为(3.84±4.22)年,PHQ-15总分2~18分,平均(8.32±4.00)分。见表1。
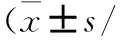
表1 两组一般人口学及临床资料比较例数)
2.2 两组肠道菌群丰度及菌群种类比较
2.2.1 OTU及其丰度分析 两组46份样本共获得2 812 921个高变区Tags。将相似度>97% Tags聚类成多个OTUs,与数据库对比进行物种注释。去除没有注释结果的OTU及不属于分析项目的物种,最终获得可用于后期研究的OTUS。结果显示, SSD组中平均每个样本含(181.14±55.17)个OTUs,HC组平均每个样本含(221.38±62.91)个OTUs,差异具有统计学意义(P=0.026)。
OTU Venn图分析:SSD组共有590个OTUs,HC组共有631个OTUs,其中有530个OTUs为两组共有,在两组分别占89.83%和83.99%。SSD组所含OTU数量小于HC组,差异有统计学意义(t=-2.297,P=0.026)。
OTU Rank曲线显示,在水平方向上,SSD组曲线宽度小于HC组,提示SSD组菌群物种组成的丰富程度较低;曲线较HC组陡峭,提示SSD组菌群物种分布相对不均匀,优势菌群所占比例相对较高。见图1。
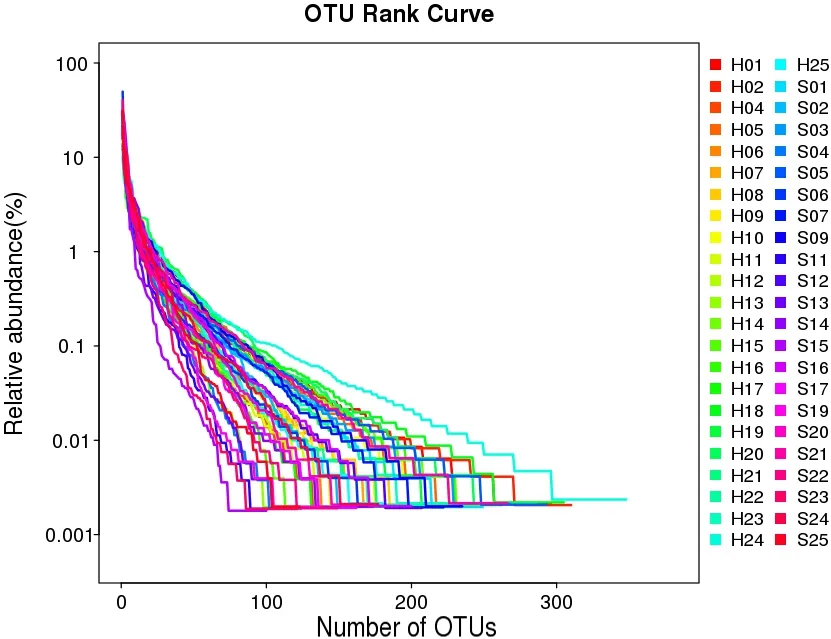
图1 OTU Rank曲线
2.2.2 α和β多样性分析 α多样性分析显示,与HC相比,SSD组的observed species指数、shannon指数较低,simpson指数较高,差异均有统计学意义;两组chao指数及ace指数差异无统计学意义。β多样性热图及聚类分析结果显示:所有样本被聚成两类,其中一类包含8名HC和12例SSD,另一类包含16名HC和10例SSD,但聚类的结果并不十分理想,不能准确区分SSD组与HC组。见表2,见图2。

图2 SSD组及HC组间α多样性比较盒型图

表2 SSD组及HC组菌群α多样性比较
2.2.3 物种注释分析 通过与数据库进行对比,对OTU进行物种分类,并分别在门、纲、目、科、属、种6个分类水平对各样本物种组成相对丰度进行比较。结果显示,在门水平,SSD组与HC组的优势菌群基本一致,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门等4个优势菌门。SSD组在大肠埃希菌种及其所属的属、科、目、纲水平的相对丰度均较HC组高;此外,在种水平还发现,SSD组活泼瘤胃球菌种的相对丰度明显高于HC组;单形拟杆菌种、布氏瘤胃球菌种的相对丰度明显低于HC组。见表3。

表3 两组菌群相对丰度比较
2.2.4 相关分析 对SSD组PHQ-15总分与其他临床量表的总分作Pearson相关分析,结果表明,PHQ-15总分与HAMA总分、HAMD17总分、TAS-20总分正相关(r=0.666、0.706、0.458,P=0.001、0.000、0.032)。在SSD组,对存在组间差异的α多样性以及菌属相对丰度与各临床量表总分作Spearman相关分析,未发现菌群多样性和相对丰度与各临床量表之间存在相关关系。见表4。

表4 SSD组菌群特征与临床量表评分的相关分析(r值)
3 讨论
临床上SSD识别率低,患者生活质量差[8-10],因此寻找特异生物学标记是目前SSD研究的热点。本研究结果发现,与HC组相比,SSD组肠道菌群多样性降低,埃希氏杆菌属及其所属的科、目、纲水平含量增加。本研究结果还显示SSD组的肠道菌群丰度较HC组降低。疼痛和疲乏是SSD的常见表现,也是慢性疲劳综合征及纤维肌痛的主要症状,目前关于后两者的肠道菌群研究有一定进展,可帮助从症状维度理解SSD的肠道菌群特征。研究发现,慢性疲劳综合征患者肠道菌群多样性降低、肠杆菌科相对丰度增加[11],纤维肌痛患者肠道菌群多样性降低、双歧杆菌相对丰度降低[12]。此外,SSD在临床表现及病理生理上与焦虑抑郁有许多相似之处,相关研究结果或可为本研究提供参考。Liu等[13]报道抑郁患者shannon指数降低,也有研究报道抑郁症患者多个指标均提示其菌群丰度降低[14],Chen等[15]报道焦虑患者的丰度较健康对照降低。上述研究均未发现α多样性指数与焦虑抑郁症状之间有相关性,与本研究结果相似。另一方面,有研究报道,未发现精神疾病患者与健康对照的β多样性存在差异,通过β多样性聚类未能将患者组与对照组较好区分开来[16]。综上所述,SSD患者与其他精神障碍类似,存在肠道菌群丰度下降, α多样性降低提示肠道菌群紊乱,潜在致病菌含量增多。肠道微生物或其代谢产物调节肠道环境,通过神经递质、自主神经系统及下丘脑-垂体-肾上腺(HPA)轴等,与大脑相互作用,参与多种精神疾病的病理过程[17]。而既往研究显示SSD 患者存在神经递质及自主神经系统功能异常,包括:5-HT 功能低下[18],在情绪任务中副交感神经活性低下[19]。故而推测肠道微生物通过影响神经内分泌途径及迷走神经途径介导SSD的发生。
肠道菌群物种注释分析发现,在门水平SSD组与HC组优势菌群差异无统计学意义,优势菌群主要包括厚壁菌门、拟杆菌门、变形菌门、放线菌门;与既往研究一致[20-21]。本研究结果显示,SSD患者在埃希氏杆菌属及其所属的科、目、纲等水平的相对丰度均较HC组高;种水平菌群分布也存在组间差异,但受基因测序方法的检测局限,本研究不作深入讨论。动物研究表明,应激使肠道菌群多样性降低,埃希氏杆菌含量增加,炎症因子释放增加,HPA轴功能亢进,最终产生肠道炎症、抑郁样行为及认知功能损害[22-25]。而SSD 患者存在免疫功能异常,包括T淋巴细胞活动降低[26]、细胞因子水平异常[27];这提示埃希氏杆菌可能通过影响炎症因子、免疫调节、神经内分泌等途径导致SSD的发生。
另外,SSD患者可能存在焦虑或抑郁症状,其受躯体症状困扰的严重程度与焦虑抑郁程度和述情障碍程度正相关;与很多研究发现类似[8,28],提示临床医生应重视SSD患者的心理因素并加以干预。
本研究结果发现,SSD患者肠道菌群多样性降低,潜在致病菌埃希氏杆菌增加,导致肠道菌群失调,可能通过炎症、免疫、神经内分泌等途径介导SSD的发生发展。本研究存在一些局限:首先,样本量较小,结果推广需谨慎。其次,16S rRNA基因测序方法只能注释部分菌种,有相当数量菌种无法被注释。再者,无法严格控制或定量分析被试饮食营养差异,可能会影响肠道菌群构成。将来的研究需扩大样本量、采用更为精准的分析技术、控制饮食混杂因素、提供更多的临床信息,以进一步探究疾病的病理机制。
