DLX3和Syncytin-1 mRNA在妊娠期糖尿病患者胎盘钙化组织中的表达及意义
2022-05-09吴昊旻梁旭霞
邬 华,方 香,李 静,蓝 娇,吴昊旻,梁旭霞
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种代谢性疾病,为妊娠期首次发生或发现的糖代谢异常,其发病原因复杂[1-2]。近年来,随着社会经济发展、人们生活水平及生活方式的改变,妊娠妇女中肥胖或超重妇女占比不断上升,GDM的发病率也随之增加。据统计,我国GDM发病率为17.5%[3]。GDM患者产后患2型糖尿病的风险增加,GDM患者在产后9个月、15个月和5.2年的2型糖尿病的罹患率分别为3.7%、4.9%、13.15%[4]。妊娠合并糖尿病对母胎均有较多危害,需引起重视[5]。妊娠合并糖尿病中超过90%为GDM,其与不良妊娠结局有着密切关系。有学者认为应将GDM纳入“大产科综合征”中,与早产、胎膜早破、巨大儿、子痫前期、自然流产、胎儿生长发育异常、死胎、新生儿低血糖、新生儿呼吸窘迫综合征等密切相关,强调了胎盘在母胎间的相互作用[6-7]。同源盒转录因子3(distal-less homeobox 3,DLX3)是一种转录调控因子,可调控滋养细胞的增殖、分化以及细胞凋亡[8]。Syncytin-1是人内源性逆转录缺陷病毒(human endogenous retroviruses,HERVs)成员中HERV-W编码的糖包膜蛋白。有研究显示,Syncytin-1具有介导识别、与宿主细胞受体结合的功能,在维持正常胎盘发育和功能方面发挥重要作用,主要表现为介导滋养细胞增殖、分化融合并维持正常的细胞凋亡[9]。Choi等[10-11]发现DLX3对骨骼、牙齿的发育有重要影响。张薇等[12]指出DLX家族基因参与调控胚胎形态发生,是骨骼发育过程中的重要转录因子。本研究旨在比较GDM患者与正常妊娠妇女胎盘钙化组织DLX3和Syncytin-1的表达水平,探讨其在GDM发病机制中的作用及其与胎盘钙化的相关性,现报告如下。
1 对象与方法
1.1研究对象 选择2015年9月至2018年9月在广西壮族自治区人民医院产科产检并住院的GDM患者30例作为观察组。纳入标准:(1)符合GDM的相关诊断标准[5,13];(2)单胎足月孕妇;(3)自然受孕;(4)因单纯产科因素择期剖宫产终止妊娠。排除标准:(1)合并其他妊娠合并症;(2)合并感染;(3)胎儿发育异常。另选择同期健康孕产妇30名作为对照组。纳入标准:(1)无GDM及其他妊娠合并症;(2)无妊娠并发症;(3)因单纯产科因素择期剖宫产终止妊娠分娩的单胎、自然受孕、足月孕妇。排除标准:(1)合并感染;(2)胎儿发育异常。观察组年龄大于对照组,差异有统计学意义(P<0.05),两组在孕前体重、民族、孕次等其他基线资料方面比较差异无统计学意义(P>0.05)。见表1。本研究经广西壮族自治区人民医院伦理委员会批准(编号:KY-KJT-2015-1号),研究对象均签署知情同意书。
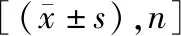
表1 两组基线资料比较
1.2GDM的诊断标准 (1)GDM为妊娠期首次发生或发现:孕产妇孕期规范产检时在孕24~28周行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),即试验前连续3 d正常饮食(每日进食碳水化合物不少于150 g),检查期间静坐、禁烟。OGTT前禁食至少8 h,5 min内口服含75 g葡萄糖的液体300 ml,分别抽取孕妇服糖前及服糖后1 h、2 h的静脉血,测定血糖水平。空腹血糖(fasting blood glucose,FBG)<5.1 mmol/L、1 h血糖<10.0 mmol/L、2 h血糖<8.5 mmol/L,任何一项异常(≥正常值)即诊断为GDM[5]。(2)若首次OGTT结果正常,孕妇具有GDM高危因素。①孕妇因素:年龄≥35岁、妊娠前超重或肥胖、糖耐量异常史、多囊卵巢综合征。②糖尿病家族史。③妊娠分娩史:不明原因的死胎、死产、流产史、巨大胎儿分娩史、胎儿畸形和羊水过多史、GDM史。④本次妊娠因素:妊娠期发现胎儿大于孕周、羊水过多;反复外阴阴道假丝酵母菌病者。妊娠30~32周重复OGTT,如有任何一项异常(≥正常值)即诊断为GDM[13]。
1.3标本的收集 于研究对象剖宫产术中胎盘娩出后15 min内取标本,于近脐带根部胎盘母体面肉眼可见钙化区取约1 cm3组织1块,以生理盐水冲洗干净,即刻分装于经焦炭酸二乙酯(diethylpyro-carbonate,DEPC)水处理过的2 ml冻存管,-80 ℃保存备用。
1.4实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测方法 采用TRIzol法提取胎盘组织标本总RNA,应用DNase I(Cat:M0303S,NEB)去除DNA后使用逆转录试剂盒(Cat:K1622,Thermo)将RNA逆转为cDNA。应用QuantiNova SYBR Green PCR Kit试剂盒(Cat:208054,QIAGEN)进行RT-qPCR检测,所用仪器为ABI 7500荧光定量PCR仪,反应体系为20 μl,按照试剂盒说明书进行配制操作。RT-qPCR扩增参数:(1)95 ℃预变性2 min;(2)95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环。引物序列见表2,由南宁捷尼斯生物科技有限公司合成。以GAPDH基因为内参,以2-△△Ct法计算相对表达量。对于Ct值≥30的样本结果,以Ct值=30进行计算和统计。

表2 引物序列
1.5临床观察指标 (1)孕期体重增加量:孕期检查发现GDM后常规加强孕期体重管理,以分娩前孕妇体重减去孕前体重所得值为孕期体重增加量。(2)巨大胎儿[5]:测量新生儿出生时体重,体重>4 000 g者为巨大胎儿。
2 结果
2.1两组孕期体重增加量及巨大儿发生率比较 观察组孕期体重增加量为(11.15±4.03)kg,对照组为(13.23±2.98)kg,两组比较差异有统计学意义(t=2.069,P=0.044)。观察组出现巨大儿3例(10.00%),对照组1例(3.33%),两组比较差异无统计学意义(χ2=0.268,P=0.605)。
2.2两组DLX3和Syncytin-1 mRNA表达水平比较 观察组DLX3 mRNA表达水平显著高于对照组(P<0.05)。两组Syncytin-1 mRNA表达水平比较差异无统计学意义(P>0.05)。见表3。
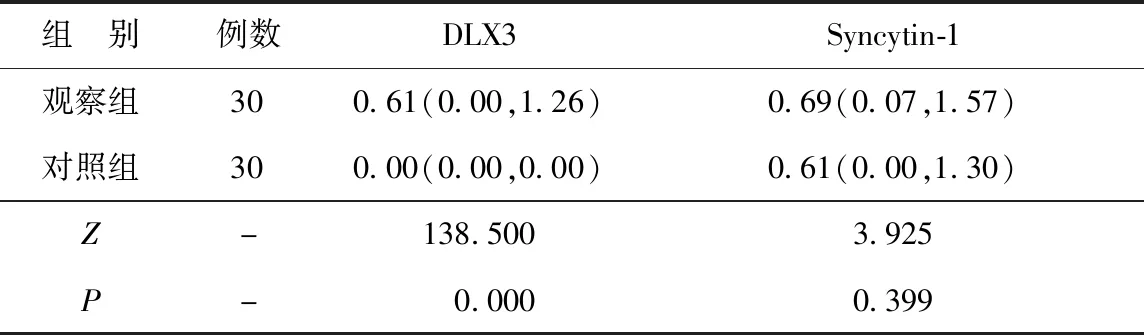
表3 两组DLX3和Syncytin-1 mRNA表达水平比较[M(P25,P75),2-△△Ct]
2.3影响GDM发生的多因素logistic回归分析结果 以年龄、孕期体重增加量和DLX3 mRNA作为自变量,以GDM的发生情况为因变量(是=1,否=0)进行多因素logistic回归分析,结果显示,较高的DLX3 mRNA表达水平是促进GDM发生的危险因素(P<0.05)。见表4。

表4 影响GDM发生的多因素logistic回归分析结果
3 讨论
3.1目前,GDM的发生机制尚未完全阐明,有研究认为其发生与胰岛素抵抗、氧化应激、细胞凋亡、炎症反应等因素有关[14]。GDM可能导致或加剧胎盘功能异常,通过改变胎盘结构或功能,从而增加围产儿不良结局的发生。DLX3是同源异型盒DLX基因家族中的一员,是一种转录调控因子,对胚胎生长发育的调控有一定作用,可调控胎盘滋养细胞的增殖、分化以及凋亡[8]。另外,有研究表明,DLX3过表达可诱导胎盘生长因子(placenta growth factor,PGF)的表达,DLX3与胶质细胞缺失因子1(glial cell missing 1,GCM-1)可协同调控人滋养细胞衍生细胞中PGF的表达,二者的协调作用可导致PGF拮抗[15-16]。李艾珍[17]的研究显示,孕中期肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和8-异前列腺素F2a(8-isoprostaglandins F2a,8-iso-PG F2a)与GDM的发生具有关联性,认为氧化应激和炎症因子可能引起GDM患者胎盘血管内皮细胞凋亡增加,导致功能障碍。GDM是妊娠常见合并症,此类孕妇孕早期可能存在糖耐量受损,加之妊娠激素影响使机体对胰岛素的敏感性进一步降低,以致不能维持正常血糖水平。本研究结果显示,与正常妊娠者相比,GDM患者的DLX3 mRNA表达水平显著增高,多因素logistic回归分析结果显示其为GDM发生的独立危险因素,提示DLX3与GDM的发病机制具有关联,具有应用于预测GDM发生的潜在临床价值。另外,DLX3参与调控胚胎形态,是骨骼发育过程中的重要转录因子。本研究取材样本为胎盘钙化部位,不排除DLX3对于GDM胎盘钙化的发病有一定的影响,但DLX3是否通过影响GDM的发生、发展而促进胎盘钙化发生,有待进一步研究。
3.2HERVs大约占人类基因组的8%。有18个逆转录病毒包膜基因中均包含一个开放阅读框,其中6个表达于胎盘组织,分别为HERV-K、HERV-R(b)、HERV-T、ERV3(HERV-R)、HERV-W和HERV-FRD,前3个在胎盘组织呈低表达,后3个在胎盘组织中呈高表达[18]。Syncytin-1是由HERVs成员中HERV-W编码而形成的糖包膜蛋白,位于染色体7q21,由表面亚单位(surface subunits,SU)和跨膜亚单位(transmembran subunits,TM)组成,前者具有介导识别、与宿主细胞受体结合的功能,后者具有促进细胞膜融合功能,主要表达于胎盘合体滋养细胞,在维持正常胎盘发育和功能方面发挥重要作用,主要为介导滋养细胞增殖、分化融合并维持正常的细胞凋亡[9]。大多数GDM患者的胎盘具有典型的组织学表现,如绒毛不成熟、绒毛纤维蛋白样坏死、毛细血管和血管增殖等[7]。Soygur等[19]通过研究GDM胎盘标本中Syncytin-1、Syncytin-2及其受体的表达,发现在GDM胎盘病理中Syncytin-2及其受体促进调节蛋白超家族2(major facilitator superfamily domaining 2,MFSD2)的表达发生了改变,与正常胎盘相比较,Syncytin-2及其受体MFSD2蛋白表达下降,提示Syncytin-2可能参与GDM的发病机制。Murphy等[20]研究显示,Syncytin-1的过表达上调了促炎因子的表达,如白细胞介素6(interleukin-6,IL-6)等。有研究认为,胎盘产生的活性氧(reactive oxygen species,ROS)及抗氧化防御功能的失衡可能导致GDM相关的氧化应激[21]。Yu等[22]指出Syncytin是胶质细胞缺失因子a(glial cell missing a,GCMa)的靶因子,GCMa可正调控Syncytin。赵先兰等[23]研究认为DLX3可能是Syncytin的上游调控因子。推测Syncytin-1可能通过促炎反应、诱导细胞死亡、氧化应激参与GDM的发生和发展,具体机制尚待进一步研究。但本研究结果显示,GDM患者与非GDM患者的胎盘组织中Syncytin-1表达水平无显著差异,这不排除由于样本量较小的影响因素,结论仍需扩大样本量进一步验证。
3.3GDM会增加巨大胎儿的发生风险,考虑原因为胎儿长期处于母体高血糖所致的高胰岛素血症环境,蛋白、脂肪合成增加而脂解作用被抑制,导致躯体过度发育[5]。史亚波等[24]研究认为GDM诱导的高糖环境可上调胎盘组织中PGF的表达水平,减少胎盘滋养细胞的凋亡,使胎盘过度发育,进而增加巨大胎儿的发生风险。本研究中观察组出现巨大儿3例(10.00%),与对照组比较差异无统计学意义(P=0.605),这也可能与本研究例数较少有关,但也不排除本研究对象均为规范产检者,观察组在确诊GDM后均予以饮食、运动指导等干预。多因素logistic回归分析结果显示孕期体重增加量与GDM发生无显著关联,这可能得益于孕期相关体重控制等干预措施的开展。
综上所述,DLX3可能参与了GDM的发病机制,也不排除DLX3促进了GDM胎盘钙化的发生,其具体的发病机制有待进一步研究。Syncytin-1在GDM患者胎盘钙化组织中的表达水平与正常妊娠者差异不显著,这不排除是由于样本量较小造成的结果偏倚,有待后续进一步扩大样本量加以验证。
