lncRNA GHET1表达水平对人胃癌细胞MGC-803增殖 迁移和侵袭的影响及其机制研究
2022-05-09唐沐希赖铭裕程若溪
唐沐希,赖铭裕,程若溪
胃癌是全球最常见的恶性肿瘤之一,也是癌症相关死亡的主要原因[1],全球每年新发胃癌患者约100万例[2]。早期胃癌的5年生存率可达95%以上,但大多数患者在诊断时已是晚期,错过了最佳手术窗口期[3]。探究胃癌的发生、发展机制对胃癌的早期诊断及治疗具有重要意义。长链非编码RNA(long non-coding ribonucleic acid,lncRNA)是非蛋白编码的RNA,其长度超过200个核苷酸[4]。lncRNA在癌症中可以作为肿瘤抑制因子或癌基因发挥作用,可调节肿瘤生长、代谢和转移等癌症特征[5]。胃癌高表达转录本1(gastric carcinoma high expressed transcript 1,GHET1)是近年来新发现的致癌lncRNA,在多种恶性肿瘤中高度表达[6]。但lncRNA GHET1对胃癌细胞的增殖、迁移等生物学行为的影响及分子机制尚不十分明确。miR-105是近年来新发现的一种microRNA(miRNA),有研究发现,miR-105在胃癌组织中表达下调[7]。但lncRNA GHET1是否通过下调miR-105的表达影响胃癌细胞的增殖、迁移及侵袭尚不明确。本研究通过构建稳定过表达和沉默lncRNA GHET1的胃癌细胞株,旨在探究lncRNA GHET1对胃癌细胞增殖、迁移和侵袭的影响及可能机制。现报道如下。
1 材料与方法
1.1材料与试剂 人胃癌细胞株MGC-803购自大连美仑生物技术有限公司。RPMI-1640培养基购自Gibco公司,特级胎牛血清购自BI公司,胰酶、青霉素-链霉素溶液购自新赛美公司。lncRNA GHET1过表达慢病毒、lncRNA GHET1过表达阴性对照慢病毒、lncRNA GHET1干扰慢病毒、lncRNA GHET1干扰阴性对照慢病毒均购自上海吉凯公司。总RNA提取试剂Trizol、反转录试剂盒(RR047A)、实时荧光定量PCR试剂盒(RR820A)均购自Takara公司。CCK-8试剂盒购自大连美仑生物技术有限公司。T25培养瓶、培养皿、6孔板、24孔板、96孔板均购自美国康宁公司。荧光显微镜(日本奥林巴斯)。
1.2实验方法
1.2.1 细胞培养 于50 ml离心管中加入5 ml胎牛血清、0.5 ml青霉素-链霉素溶液,其余部分用RPMI-1640培养基补足,轻柔混匀配制为完全培养基。T25培养瓶中加入约3.5 ml完全培养基及细胞悬液,后将培养瓶放入37 ℃、5% CO2培养箱中培养,注意观察细胞生长状态,及时传代、换液。
1.2.2 慢病毒转染 取状态良好、处于对数生长期的第2代MGC-803细胞,按5×104cells/ml接种于6孔板中,24 h后待细胞完全贴壁。设置lncRNA GHET1过表达组(过表达组)、lncRNA GHET1过表达阴性对照组(过表达对照组)、lncRNA GHET1沉默组(沉默组)、lncRNA GHET1沉默阴性对照组(沉默对照组),每组设置2个复孔。吸出孔板中的旧培养基。严格按照慢病毒试剂转染说明书,根据MGC-803细胞MOI值计算出各孔需加入慢病毒感染试剂量。按照分组加入对应的慢病毒感染试剂和感染增强试剂。转染12 h后更换完全培养基继续培养细胞,转染72 h后在荧光显微镜下观察各组细胞转染效率。转染成功(转染效率>90%)后,将各组细胞在含2 μg/ml嘌呤霉素的完全培养基中培养2 d,之后继续用含1 μg/ml嘌呤霉素的完全培养基维持培养,以进行后续实验。
1.2.3 实时荧光定量PCR检测lncRNA GHET1和miR-105的相对表达量 应用Trizol法提取各组细胞总RNA,用分光光度计检测RNA的浓度和质量合格后,应用逆转录试剂盒将其逆转录为cDNA。以cDNA为模板,应用实时定量PCR试剂盒对GHET1、miR-105进行检测。引物由上海生工公司合成,引物序列见表1。分别以GAPDH、U6作为内参,根据2-△△Ct法计算lncRNA GHET1、miR-105的相对表达量。实验重复3次独立实验。
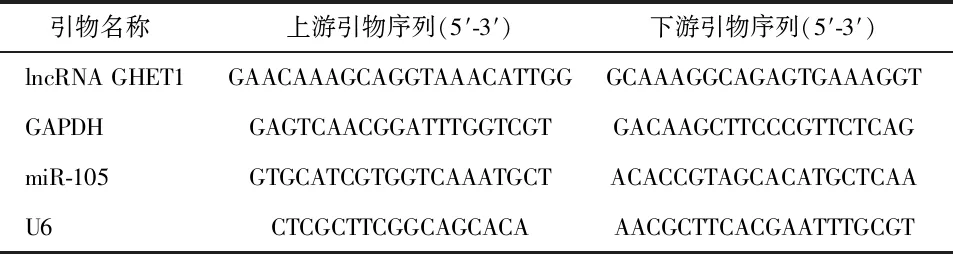
表1 引物序列
1.2.4 CCK-8实验检测各组细胞增殖能力 收集各组细胞,分别以5×103cells/孔接种至96孔板,每组设置5个复孔。分别于种板后22 h、46 h、70 h、94 h向每孔加入10 μl CCK-8试剂,避光孵育2 h后用酶标仪检测450 nm波长处的OD值。
1.2.5 Transwell实验检测细胞迁移、侵袭能力 收集各组细胞,用无血清培养基重悬细胞并计数,以5×104cells/孔接种于上室,下室加入700 μl完全培养基,培养箱中培养24 h。用棉签擦去小室内未穿膜细胞,小室采用4%多聚甲醛固定,0.1%结晶紫染色,在显微镜下拍照并用image J软件计数细胞。侵袭实验需提前在上室中加入用无血清培养基稀释的Matrigel胶并于培养箱放置3 h,其余操作步骤同迁移实验。
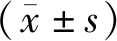
2 结果
2.1过表达和沉默lncRNA GHET1的MGC-803细胞模型的构建结果 荧光显微镜下观察见各组细胞病毒转染率均高于90%。见图1。
2.2各组lncRNA GHET1表达水平比较 实时荧光定量PCR结果显示,过表达组lncRNA GHET1的相对表达量显著高于过表达对照组(P<0.05)。沉默组lncRNA GHET1相对表达量显著低于沉默对照组(P<0.05)。见图2。结合慢病毒转染效率结果,提示实验成功建立了过表达和沉默lncRNA GHET1的MGC-803细胞模型。
2.3各组细胞增殖情况比较 CCK-8实验结果显示,过表达组OD值增长较过表达对照组快速,提示细胞增殖更快。沉默组OD值增长较沉默对照组慢,提示细胞增殖更慢。见图3。
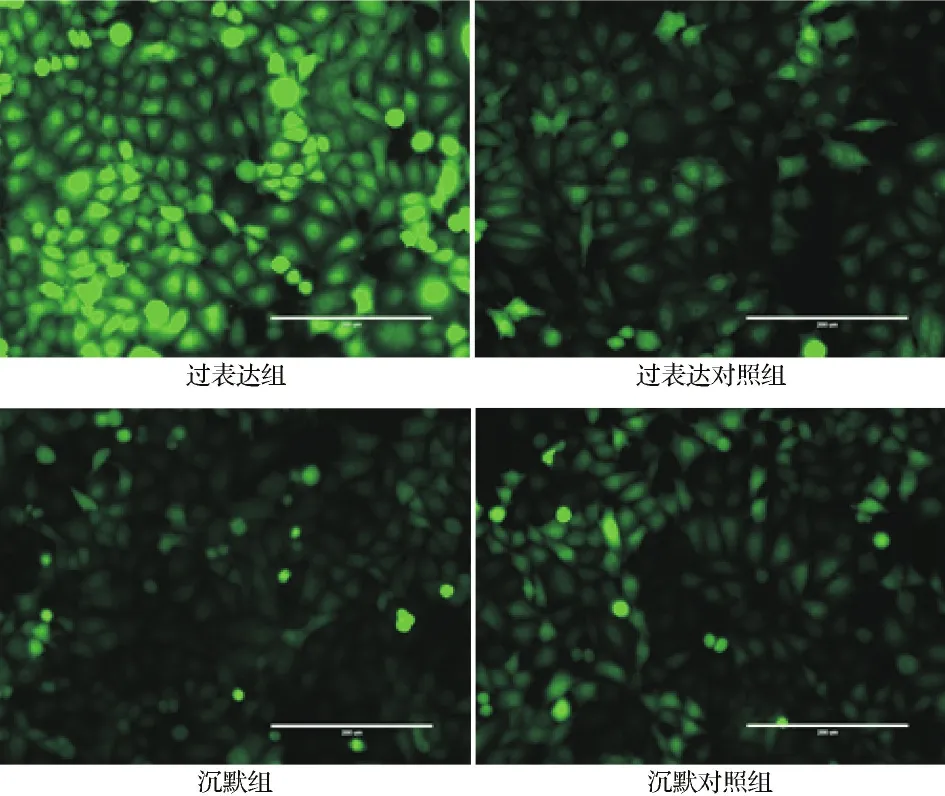
注:绿色荧光提示转染成功
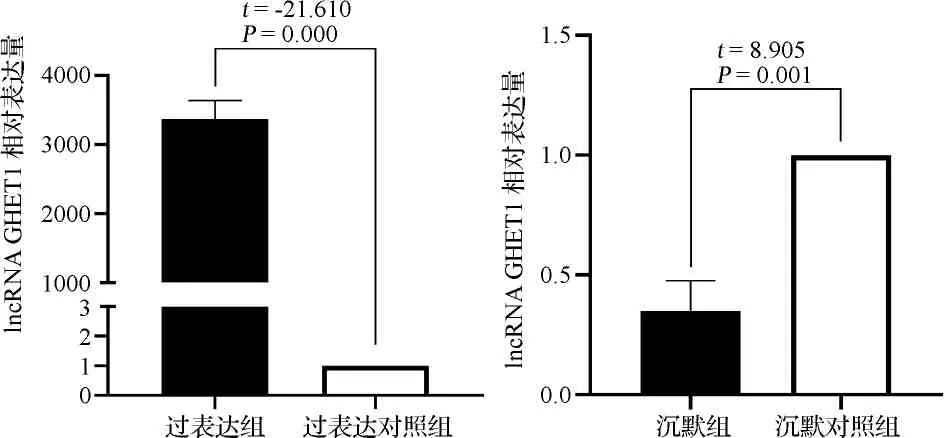
图2 各组lncRNA GHET1表达水平比较图

图3 各组不同时间点OD值情况图
2.4各组细胞迁移及侵袭能力比较 Transwell实验结果显示,过表达组迁移和侵袭细胞数多于过表达对照组,而沉默组迁移和侵袭细胞数少于沉默对照组,差异有统计学意义(P<0.05)。见表2~3,图4~5。
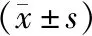
表2 过表达组和过表达对照组细胞迁移及侵袭数比较
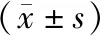
表3 沉默组和沉默对照组细胞迁移及侵袭数比较
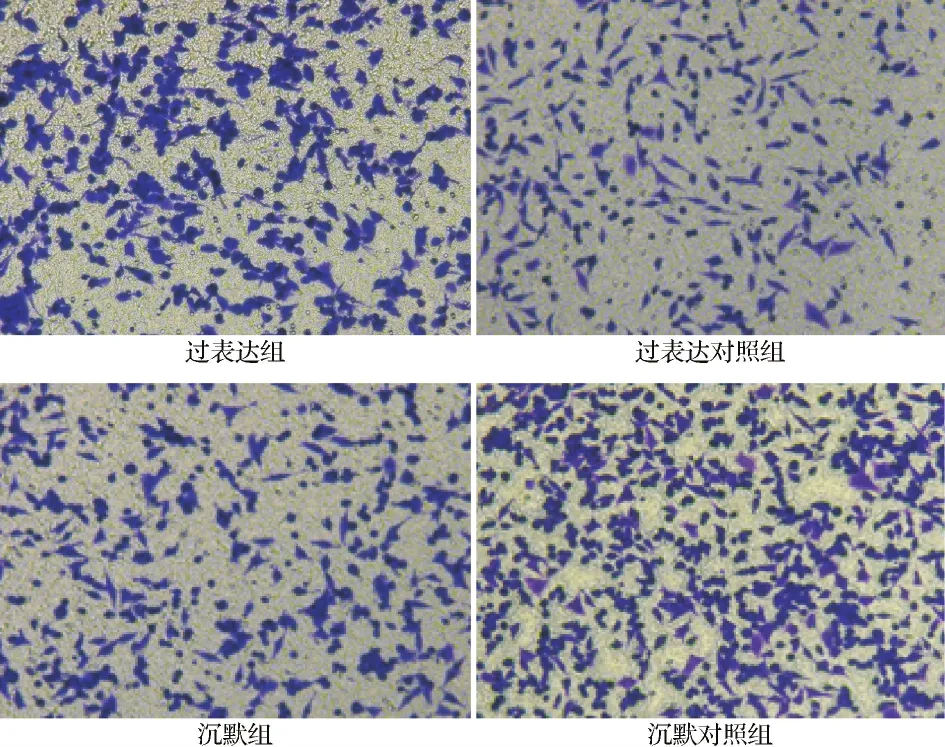
图4 Transwell细胞迁移实验结果图(×10)

图5 Transwell细胞侵袭实验结果图(×10)
2.5各组miR-105表达水平比较 实时荧光定量PCR结果显示,过表达组miR-105表达水平低于过表达对照组;沉默组miR-105表达水平高于沉默对照组,差异有统计学意义(P<0.05)。见图6。
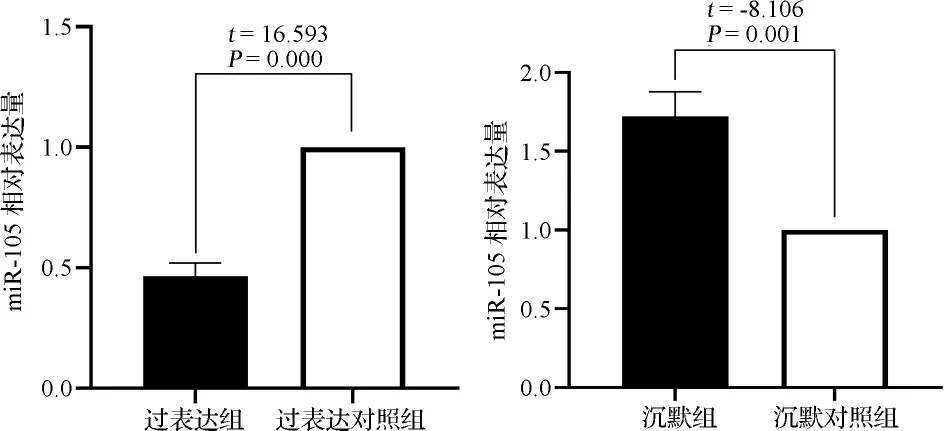
图6 各组miR-105表达水平比较图
3 讨论
3.1胃癌是癌症相关死亡的主要原因[8],超过90%为腺癌,预后不佳,平均5年生存率不足20%。如果患者在肿瘤侵入胃肌层之前得到确诊并接受治疗,其5年生存率可达90%[9]。因此,胃癌分子机制研究对于胃癌的早期诊断和治疗至关重要。在人类基因组转录的大量RNA中,蛋白质编码序列仅占总转录物的一小部分,其余的转录物是非编码RNA(non-coding RNA,ncRNA),它们缺乏编码能力[10]。lncRNA是一组异质的非蛋白质编码转录本,长度超过200个核苷酸,可参与基因表达及多种生理、病理过程。越来越多的证据表明,lncRNA通过充当癌因子或抑癌因子,在癌症的发生、发展中发挥着复杂而精确的调节作用,它们不仅可以调节癌细胞的增殖、分化、侵袭和转移,还可以调节癌细胞的代谢重编程[11]。据估计,人类体内有超过60 000个lncRNA,而且所发现的lncRNA的数目还在不断增加[12]。GHET1位于染色体7q36.1,最初被发现在胃癌组织中高表达[13]。近年来,lncRNA GHET1也被发现在结直肠癌等其他肿瘤中呈高表达[14]。本研究结果显示,过表达lncRNA GHET1的MGC-803细胞株具有更强的增殖、迁移及侵袭能力;而沉默lncRNA GHET1后,MGC-803细胞株的增殖、迁移和侵袭能力下降,提示lncRNA GHET1具有促进胃癌发生、发展的作用。
3.2miRNA是长度为17~25个核苷酸的小型非编码调控RNA,其通过识别mRNA的3′非翻译区(3′-untranslated region,3′-UTR)中的互补靶位点,在转录后抑制基因表达[15]。miRNA与细胞内几乎所有信号通路的调节有关,并且它们的失调已被证明在癌症的发展和进展中起重要作用[16]。miRNA调控环节几乎涵盖已知的所有肿瘤转移关键步骤,包括参与调控细胞上皮-间质转化(epithelial mesenchymal transition,EMT)、细胞表面分子表达等[17]。miR-105是近年来新发现的一种miRNA。Jin等[18]研究发现,miR-105在胃癌组织中表达下调,而过表达miR-105可抑制胃癌细胞的增殖和转移,提示miR-105对胃癌具有抑制作用。近年来的研究表明,lncRNA可作为一种竞争性内源性RNA(competing endogenous RNA,ceRNA)与miRNA相互作用,参与靶基因的表达调控。此外,一些lncRNA还编码某些促进肿瘤发生的miRNA。这种lncRNA与miRNA相互作用而导致基因表达失调的现象在包括肿瘤在内的许多疾病中发生[19]。有研究发现结直肠癌中存在由lncRNA/miRNA/mRNA相互作用形成的ceRNA网络,并在肝转移、EMT、炎症以及放化疗抗性等方面发挥作用[20]。Shao等[21]也发现,lncRNA-线粒体RNA加工核糖核酸内切酶RNA组份(RNA component of mitochondrial RNA processing endoribonuclease,RMRP)通过充当miR-206海绵促进癌变并被用作胃癌的新型生物标志物。
3.3生物信息学分析表明,lncRNA GHET1能够靶向miR-105而发挥作用。Xiao等[22]发现,lncRNA GHET1通过靶向miR-105调控急性髓系白血病的进展。本研究结果显示,lncRNA GHET1过表达组中miR-105的表达水平显著低于其阴性对照组,而lncRNA GHET1沉默组miR-105的表达水平显著高于其阴性对照组,提示胃癌细胞中miR-105的表达水平可能与lncRNA GHET1表达水平呈负相关。本研究通过构建慢病毒载体介导的lncRNA GHET1过表达和沉默的MGC-803细胞株,完善了此前研究中仅用瞬时转染的方法敲低lncRNA GHET1表达进行胃癌相关实验的缺陷,为进一步研究lncRNA GHET1在胃癌发生、发展中的作用机制提供了更为可靠的方法。但本研究仅通过实时荧光定量PCR的方法验证lncRNA GHET1和miR-105表达水平的相关性,仍需进一步采用双荧光素酶报告基因实验进行更准确的验证。
综上所述,lncRNA GHET1能够促进胃癌细胞的增殖、迁移及侵袭,其机制可能与下调miR-105的水平有关,为胃癌的早期诊断与治疗提供了参考。
