DC-CIK免疫治疗联合化疗对晚期肺癌患者的疗效及对血清miR-137 miR-155水平的影响
2022-05-09胡博文杜玲玉
胡博文,杜玲玉,杨 勇
肺癌是危害人类健康的主要恶性肿瘤之一,有资料显示,2018年全球新增肺癌病例约209.4万[1]。随着腔镜技术的发展,手术是临床治疗肺癌的主要方法[2],但晚期肺癌患者大多失去了手术的机会,只能采用非手术方法延长生存期。以顺铂、吉西他滨等药物为基础的化疗方案是晚期肺癌治疗的首选方法。免疫治疗是当前临床研究的热点,树突状细胞-细胞因子诱导的杀伤细胞(dendritic cell-cytokine-induced killer cells,DC-CIK)免疫治疗属于抗肿瘤过继细胞免疫治疗,能够增强人体免疫机能,抑制或杀灭肿瘤细胞[3]。有研究将DC-CIK免疫治疗联合化疗用于中晚期肺癌患者,但是观察内容多聚焦于临床疗效、免疫功能和生活质量等方面[4-5],而在对于患者生存期的影响及作用机制方面仍鲜见报道。miRNA与肿瘤的发生、发展具有显著关联,Dacic等[6]的研究发现miR-137、miR-155参与了肺癌的发生和发展。鉴此,本研究旨在分析DC-CIK免疫治疗联合化疗在晚期肺癌中的应用效果,及其对患者肿瘤标志物和miR-137、miR-155水平的影响。现报道如下。
1 对象与方法
1.1研究对象 选择2020年1月至2021年1月南京医科大学附属苏州医院收治的晚期肺癌患者83例,根据其治疗意愿分为联合组(接受DC-CIK免疫治疗联合化疗方案,40例)和化疗组(接受单纯化疗方案,43例)。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。研究获医院伦理委员会批准(K-2020-043-H01),所有研究对象知情同意参与。
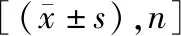
表1 两组基线资料比较
1.2纳入与排除标准 纳入标准:(1)病理检查确诊为肺癌;(2)TNM分期为Ⅲb期~Ⅳ期;(3)卡氏功能状态评分(Karnofsky performance score,KPS)≥60分;(4)预计生存周期>3个月;(5)既往未进行过抗肿瘤治疗及表皮生长因子-酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)、奥西替尼等靶向治疗;(6)确诊后一线应用顺铂+吉西他滨治疗;(7)临床资料齐全。排除标准:(1)合并严重内科疾病,如心功能不全、肾衰竭等;(2)存在血液系统功能障碍;(3)对化疗或DC-CIK免疫治疗不耐受;(4)曾接受过放化疗;(5)妊娠或哺乳期女性;(6)合并其他部位恶性肿瘤;(7)伴有代谢性疾病;(8)合并自身免疫性疾病。
1.3治疗方法 (1)化疗组接受单纯化疗方案:顺铂(江苏豪森药业集团有限公司,国药准字H20040813,6 ml∶30 mg)70 mg/m2,第1天静脉滴注;吉西他滨(南京正大天晴制药有限公司,国药准字H20093403,0.2 g)1 000 mg/m2,第1天、第8天静脉滴注;隔2周再进行第2次给药。每21 d为1个周期。(2)联合组接受DC-CIK免疫治疗联合化疗方案:在化疗组化疗的基础上进行了DC-CIK免疫治疗:在患者化疗前3 d采集外周血单核细胞进行DC-CIK培养,于采集后第3天行全身化疗,细胞培养14 d后,分2次回输给患者,每2周1次,单次回输DC-CIK数>1×109个,28 d为1个周期。两组均接受2个周期治疗。
1.4观察指标 (1)肿瘤标志物:于治疗前1 d和治疗结束后1周通过酶联免疫吸附法检测血清肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin 19 fragment,Cyfra21-1)水平,所用试剂盒分别购自Abcam和江苏飞亚生物科技有限公司。(2)免疫功能指标:于治疗前1 d和治疗结束后1周采用免疫荧光法进行淋巴细胞亚型检测,包括CD3+T细胞、CD4+T细胞及自然杀伤(natural killer,NK)细胞水平,试剂盒及免疫荧光检测仪均购自北京同生时代公司。(3)血清miR-137、miR-155水平:于治疗前1 d和治疗结束后1周采用荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术检测,血清miR-137、miR-155水平引物由上海生工生物工程技术服务有限公司合成,引物序列见表2。PCR所用仪器为美国ABI step one实时反应PCR扩增仪。以U6为内参基因,以2-△△Ct法计算miR-137、miR-155的相对表达量。(4)不良反应:记录两组治疗过程中发生的不良反应,包括胃肠道反应(如恶心/呕吐、腹胀)、血细胞变化(如白细胞减少、中性粒细胞减少)、贫血、肝功能损害、神经毒性等。(5)临床疗效:根据世界卫生组织(World Health Organization,WHO)实体瘤评价标准[7]进行评估。完全缓解(complete remission,CR):肿瘤病灶完全消失,维持时间>1个月;部分缓解(partial remission,PR):肿瘤病灶缩小>30%,维持时间>1个月;疾病稳定(stable disease,SD):肿瘤病灶缩小<30%或增大<20%,维持时间>1个月;疾病进展(progression disease,PD):肿瘤病灶增大>20%或出现新病灶。客观有效率(objective response rate,ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
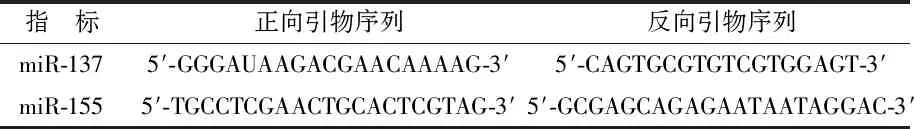
表2 引物序列
1.5随访 每月通过电话随访记录患者生存情况,观察指标包括无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。其中,PFS是指从开始治疗到肿瘤进展的时间;OS是指从开始治疗到死亡的时间。末次随访时间为2021年12月。
2 结果
2.1两组临床疗效比较 治疗后,联合组和化疗组临床疗效差异无统计学意义(P>0.05)。见表3。
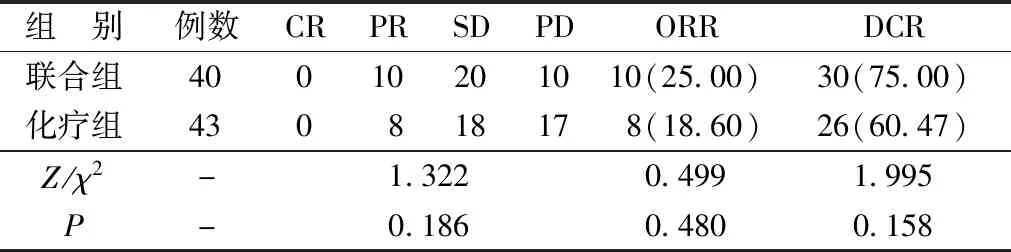
表3 两组临床疗效比较[n(%)]
2.2两组治疗前后肿瘤标志物水平比较 在治疗前,两组CEA、Cyfra21-1水平比较差异无统计学意义(P>0.05)。治疗后,两组CEA、Cyfra21-1水平均较治疗前显著降低(P<0.05),且联合组CEA、Cyfra21-1水平低于化疗组,差异有统计学意义(P<0.05)。见表4。
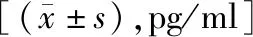
表4 两组治疗前后肿瘤标志物水平比较
2.3两组治疗前后免疫功能指标比较 在治疗前,两组CD3+T细胞、CD4+T细胞和NK细胞比较差异无统计学意义(P>0.05)。治疗后,联合组CD3+T细胞、CD4+T细胞和NK细胞水平均较治疗前显著升高(P<0.05),而化疗组免疫功能指标变化不显著(P>0.05)。联合组治疗后CD3+T细胞、CD4+T细胞和NK细胞水平高于化疗组,差异有统计学意义(P<0.05)。见表5。
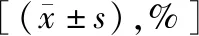
表5 两组治疗前后免疫功能指标比较
2.4两组治疗前后miR-137、miR-155水平比较 在治疗前,两组miR-137、miR-155水平比较差异无统计学意义(P>0.05)。治疗后,两组miR-137、miR-155水平均较治疗前显著降低(P<0.05),且联合组miR-137、miR-155水平低于化疗组,差异有统计学意义(P<0.05)。见表6。
2.5两组不良反应发生情况比较 联合组细胞回输后未见明显不良反应,有3例在输注24 h内出现发热,体温37.8~38.5 ℃,经对症处理后缓解。两组各不良反应发生率比较差异均无统计学意义(P>0.05)。见表7。
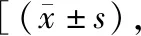
表6 两组治疗前后miR-137、miR-155水平比较 相对表达量]

表7 两组不良反应发生情况比较[n(%)]
2.6两组生存预后比较 联合组和化疗组的中位PFS分别为5个月、4个月,联合组PFS情况优于化疗组(log-rank检验:χ2=5.846,P=0.016)。联合组和化疗组的中位OS分别为7个月、6个月,联合组OS情况优于化疗组(log-rank检验:χ2=4.394,P=0.036)。见图1~2。

图1 联合组和化疗组PFS生存曲线图

图2 联合组和化疗组OS生存曲线图
3 讨论
3.1早期肺癌患者通过外科手术切除肿瘤治疗可获得较好疗效,然而大多数晚期患者已失去手术机会,因此多采用非手术方法干预,包括化疗、放疗等。顺铂是常用化疗药物之一,在抗肿瘤中效果突出[8]。吉西他滨属于特异性抗代谢类抗癌药,能够作用于细胞周期,抑制肿瘤细胞生长、增殖[9]。吉西他滨与顺铂对晚期肺癌的治疗具有协同效果,可提高临床疗效[10]。然而,常规化疗效果依旧有限,如何进一步提升晚期肺癌疗效仍处于不断探索中。
3.2相关研究指出,肺癌的发展与患者免疫功能失调有关[11],其免疫功能处于抑制状态,无法有效杀灭肿瘤细胞。树突状细胞(dendritic cell,DC)可在体内随着血液循环搜索和识别肿瘤细胞,同时将信息向免疫活性细胞传递,使其大量激活和增殖[12]。细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)能够精准识别和杀伤肿瘤细胞,清除手术残留的微小病灶,抑制肿瘤细胞扩散、复发,还可以提升机体免疫功能[13]。将DC和CIK联合起来,能够达到“1+1>2”的治疗效果。DC-CIK免疫治疗是通过体外诱导将具有免疫功能的DC和CIK细胞进行混合培养并扩增,之后将活化的免疫细胞再输回患者体内,释放细胞内穿孔素、颗粒酶等活性物质到肿瘤细胞内,以使其溶解,此外还可经Fas-FasL途径诱导肿瘤细胞凋亡,在杀伤肿瘤细胞的同时还可以刺激自身免疫系统,增强免疫机能[14-15]。DC-CIK免疫治疗适用于多数实体瘤及发生肿瘤广泛转移而无法进行手术的患者,因此对于晚期肺癌患者而言,可进行DC-CIK免疫治疗。本研究探讨DC-CIK免疫治疗联合化疗在晚期肺癌患者中的治疗效果,结果显示联合组ORR、DCR分别为25.00%、75.00%,高于对照组的18.60%、60.47%,但两组比较差异无统计学意义(P>0.05),可能与本研究样本量较少有关,但也提示DC-CIK免疫治疗有提高晚期肺癌临床效果的趋势。在免疫功能方面,在治疗后,联合组CD3+T细胞、CD4+T细胞和NK细胞水平均显著升高,且联合组水平均显著高于化疗组,表明在化疗基础上予以DC-CIK免疫治疗可以有效提升晚期肺癌患者免疫功能,这与高会霞[16]的研究结果相似,也证实了DC-CIK免疫治疗能够改善机体免疫力。
3.3CEA是敏感性较高的肿瘤标志物,在肺癌诊治及预后评估中均有应用价值[17]。Cyfra21-1是肺泡上皮细胞凋亡后生成的可溶性物质,为非小细胞肺癌(non-small cell lung cancer,NSCLC)敏感标志物[18]。本研究结果显示,在治疗后,两组CEA、Cyfra21-1水平均较治疗前显著降低,且联合组CEA、Cyfra21-1水平显著低于化疗组,提示DC-CIK免疫治疗联合化疗可以更好地降低晚期肺癌患者肿瘤标志物水平。对比两组生存预后,结果显示联合组PFS及OS情况均优于化疗组,生存预后情况更佳。
3.4许多研究表明,miRNA在肿瘤发生、发展中起到了基因调控的作用,参与了肿瘤的恶性生物学行为,可通过检测miRNA水平来及早诊断肿瘤并评估患者预后[19-20]。本研究结果显示,在治疗后,两组miR-137、miR-155水平均较治疗前显著降低,且联合组水平显著低于化疗组。miR-137、miR-155均是具有代表性的多功能miRNA,能够引起机体炎症、免疫失衡及相关抑癌机制失调,促使肿瘤生长、迁移、侵袭,促进恶性肿瘤的发生、发展。有研究发现,miR-137、miR-155均参与到肺癌发生和发展进程,且两者均可能为促癌基因[21-22]。这提示对晚期肺癌患者予以DC-CIK免疫治疗联合化疗可能是通过抑制miR-137、miR-155的表达而发挥抑制肿瘤进展的作用。
3.5由于DC-CIK免疫治疗是将患者外周血单核细胞进行DC-CIK培养,无毒副作用。本研究中联合组细胞回输后未见明显不良反应,有3例患者在输注24 h内出现发热,属于正常反应,经对症处理后缓解。两组各不良反应发生率比较差异均无统计学意义,提示DC-CIK免疫治疗联合化疗不会增加不良反应发生率。且笔者在临床中观察发现,对比单纯化疗患者,在化疗基础上予以DC-CIK治疗的患者,其对化疗的耐受性更好,生存质量也更高。Wang等[23]的研究也发现,DC-CIK免疫疗法联合常规化疗治疗中晚期NSCLC,在增强患者的细胞免疫功能、减轻炎症反应、调节肿瘤标志物水平、抑制肿瘤侵袭和转移等方面具有明显的疗效,且不良反应发生率并没有增加。另外,Zhao等[24]的研究也发现,在晚期NSCLC中,接受DC-CIK联合化疗患者的FPS和OS情况优于单纯化疗者,这与本研究结果相似,提示DC-CIK联合化疗较单纯化疗具有优越性。
综上所述,与单纯化疗相比,对晚期肺癌患者予以DC-CIK免疫治疗联合化疗,可以降低其血清肿瘤标志物CEA、Cyfra21-1水平及血清miR-137、miR-155水平,改善免疫功能和生存预后。但本文仍存在局限性:本次研究纳入患者为晚期肺癌患者,未根据肺癌病理分型进行分层分析,未能明确DC-CIK免疫治疗联合化疗对不同病理类型肺癌患者的疗效差异,这有待进一步研究探讨。
