艾叶挥发油提取物治疗放射性肺炎大鼠疗效评估*
2022-05-07钱小军
刘 露 钱小军 彭 梅
(宜春市人民医院呼吸与危重症医学科,江西 宜春 336000)
放射性肺炎是由于肺部及纵隔肿瘤、食管癌等肿瘤经放射治疗后,在放射野内正常肺组织受到损失引起的炎症反应。早期无症状,后期产生肺纤维化,导致呼吸功能损害,甚至呼吸衰竭[1]。在放射治疗后2~3 个月,或停止放疗后半年出现刺激性干咳、活动后加剧,伴有气急、心悸,偶有高热[2]。西医通过严格掌握放射剂量、照射野的大小和速度来预防放射性肺炎,治疗上主要使用肾上腺皮质激素、细胞毒性药物等[3]。中医治疗方法有养阴清肺法、活血化瘀法等[4]。
艾叶含挥发油类、黄酮类等,包括止咳、平喘、抗菌、抗病毒等作用[5]。本课题通过比较艾叶挥发油α-萜品烯醇、β-丁香烯醇、泼尼松3 种药物对放射性肺炎大鼠的治疗效果,为研发放射性肺炎的治疗药物提供一定的实验数据。
1 材料与方法
1.1 实验动物 Sprague Dawley(SD)大鼠,SPF 级,雄性60 只,体质量(180± 200)g,由北京明瀞实验动物技术有限公司,许可证号:SYXK20200019,于SPF 级实验室常规饲养。
1.2 实验药品 实验药品:艾叶挥发油α- 萜品烯醇及β- 丁香烯醇由中医药研究院提供,泼尼松片(浙江仙琚制药股份有限公司,国药准字H33021207),生理盐水(信合援生物药股份有限公司,国药准字H20023810)。
1.3 试剂 TGF-β、PDGF、IL-1 所需试剂盒均购买于上海江蓝纯公司,批号分别980790、980795、980791,SOD 试剂盒购买于上海博士德生科有限公司,批号为201501092。HE 染色试剂盒购买于南京建成生物研究所,批号为SD89762。
1.4 实验仪器 APO-9 型放射治疗机(成都中国核动力研究设计院放射仪器有限公司),CX31 型电子显微镜(美国奥林匹斯公司),DP-3 型石蜡切片机(日本岛津公司),BIOBASE 组织包埋机(济南天桥有限责任公司)。
1.5 分组、造模与给药 分组:采用随机数字表法将60只大鼠平均分为4 组,15 只组T(艾叶挥发油α-萜品烯醇),15 只组D(艾叶挥发油β-丁香烯醇),15 只组C(泼尼松),15 只组K;每组大鼠在相同条件下饲养。
造模方式:根据文献[6]推荐的放射性肺炎造模方法与剂量,用10% 水合氯醛麻醉大鼠,使用模具固定,用铅砖遮挡小鼠胸部以外区域后,采用15 Gy 大剂量单次照射,剂量率1 Gy/ min,每天照射1 次,连续照射30 d。
给药剂量:根据参考文献[7]推荐大鼠的剂量=Xmg/kg×70 kg× 0.018/200 g=X mg/kg× 70 kg× 0.018/0.2 kg=6.3X mg/kg。按单位体质量的剂量来算,大鼠的等效剂量相当于人的6.3 倍。成人的标准体质量设为70 kg。结合相关文献及药典[8]中艾叶挥发油提取物的推荐成人剂量(1 g/d)。换算本研究中每只大鼠300 g 每天用量:组T(用量104 mg/kg,组D 用量104 mg/kg,组C 用量6.3 mg/kg,组K 予等量的生理盐水。
1.6 样本采集与处理
1.6.1 行肺泡灌洗检测淋巴细胞数 对大鼠行全肺支气管肺泡灌洗术,以检测淋巴细胞数。
1.6.2 检测TGF-β、PDGF、IL-1 心脏取血清用于ELISA 检测。分离肺叶,采用酶联免疫吸附测定法检测TGF-β、PDGF、IL-1。
1.6.3 检测SOD 取大鼠右侧肺一半,采用黄嘌呤氧化酶法测SOD。
1.6.4 行HE 染色 取右侧肺另一半,采用常规HE(苏木精-伊红)染色,光镜观察各组大鼠肺部病理组织结构。采用Szapiel[9]半定量方法对HE 染色进行评定肺泡炎情况。
1.7 统计学方法 使用SPSS 26.0 统计软件进行分析。实验数据采用()表示,各组数据先进行正态性检验和方差齐性分析,若符合方差齐性和正态分布,则进行单因素方差分析,多重比较进行LSD 法;若方差不齐,则进行多重秩和检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 肺泡灌洗检测淋巴细胞数 治疗后,组T、组D、组C 肺泡灌洗液中淋巴细胞数明显低于组K;组T 数值最低,各组之间相比较,差异均具有统计学意义(P <0.05)。见表1。
表1 各组大鼠肺泡灌洗检测淋巴细胞数(,×109/L)
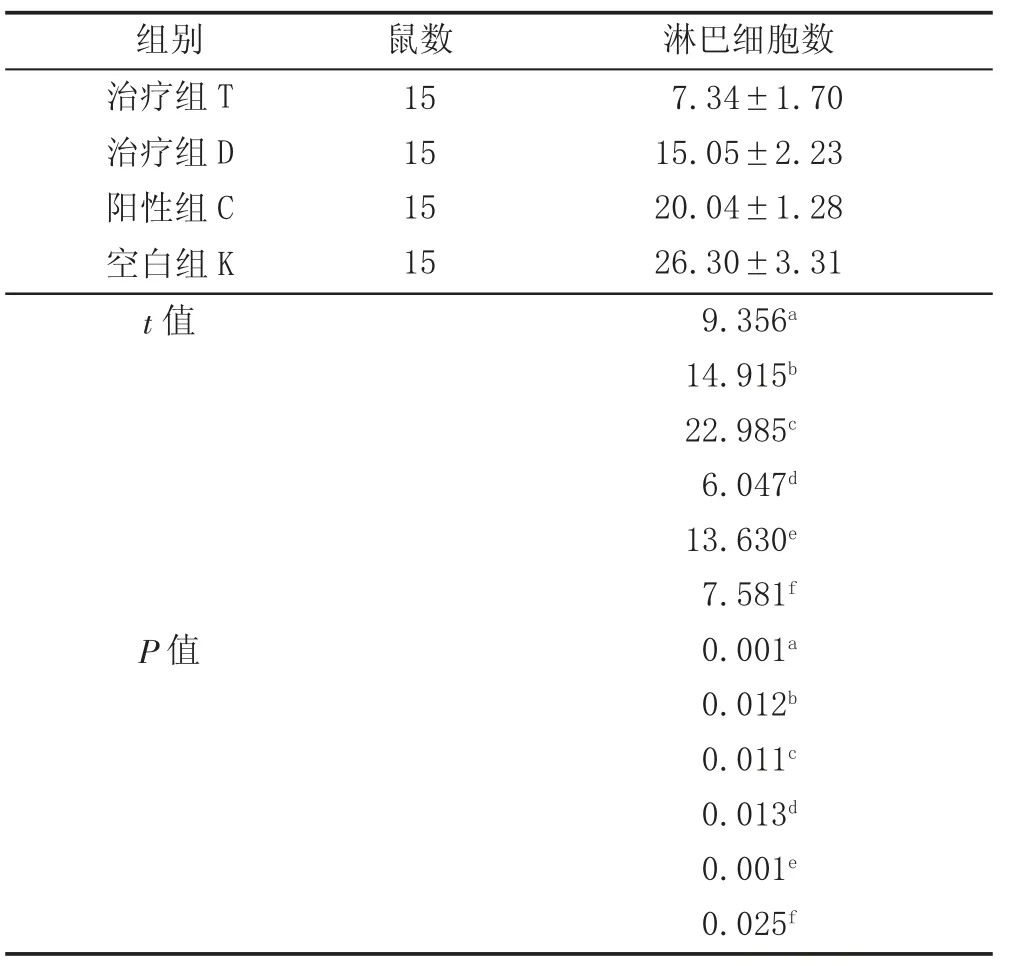
表1 各组大鼠肺泡灌洗检测淋巴细胞数(,×109/L)
注:方差分析F=188.742,P=0.001<0.01。a 为组T 与组D 比较,b 为组T 与组C 比较,C 为组T 与组K 比较,d 为组D 与组C,e 为组D 与组K 比较,f 为组C 与组K 比较。
2.2 TGF-β、PDFG、IL-1 含量检测结果 治疗后,组T、组D、组C 中SOD 含量明显高于组K;组T 数值最高,各组之间相比较,差异均具有统计学意义(P <0.05)。治疗后,组T、组D、组C 中TGF-β 含 量、PDFG 含量、IL-1 含量明显低于组K;组T 数值最低,各组之间相比较,差异均具有统计学意义(P <0.05)。见表2。
表2 各组大鼠TGF-β、PDFG、IL-1 含量检测结果()
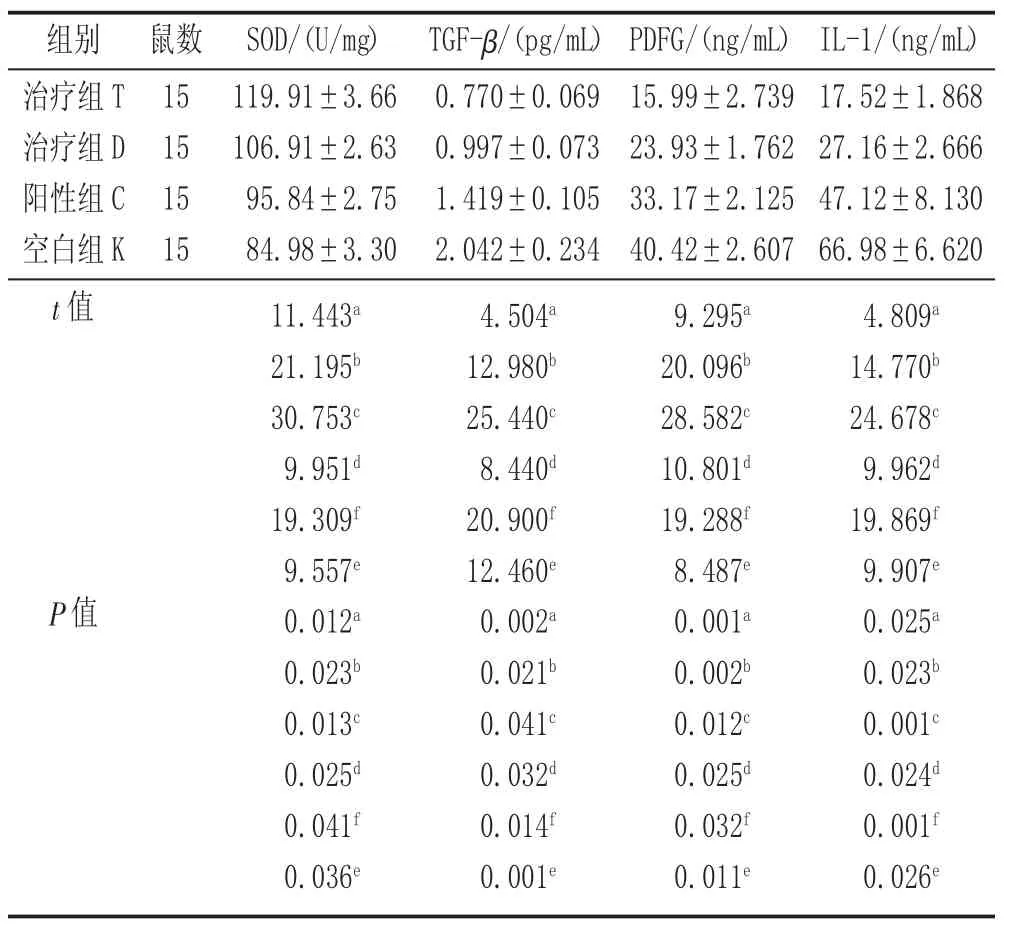
表2 各组大鼠TGF-β、PDFG、IL-1 含量检测结果()
注:SOD 方差分析F=347.706,P=0.001<0.01;TGF-β 方差分析F=246.230,P=0.002<0.01;PDFG 方差分析F=311.523,P=0.002<0.01;IL-1 方差分析F=240.330,P=0.003<0.01。a 为组T 与组D 比较,b 为组T 与组C 比较,C 为组T 与组K 比较,d 为组D 与组C,e 为组D 与组K 比较,f 为组C 与空白组K 比较。
2.3 肺部肺泡炎评分结果 治疗后,组T 大鼠仅出现轻度肺泡炎,组D 为中度肺泡炎,组C 为重度肺泡炎,组K 为极重度肺泡炎。组T、组D、组C 中肺部肺泡炎评分明显低于组K;组T 评分最低,各组之间相比较,差异均具有统计学意义(P <0.05)。见表3。
表3 各组肺部肺泡炎评分结果 (,分)
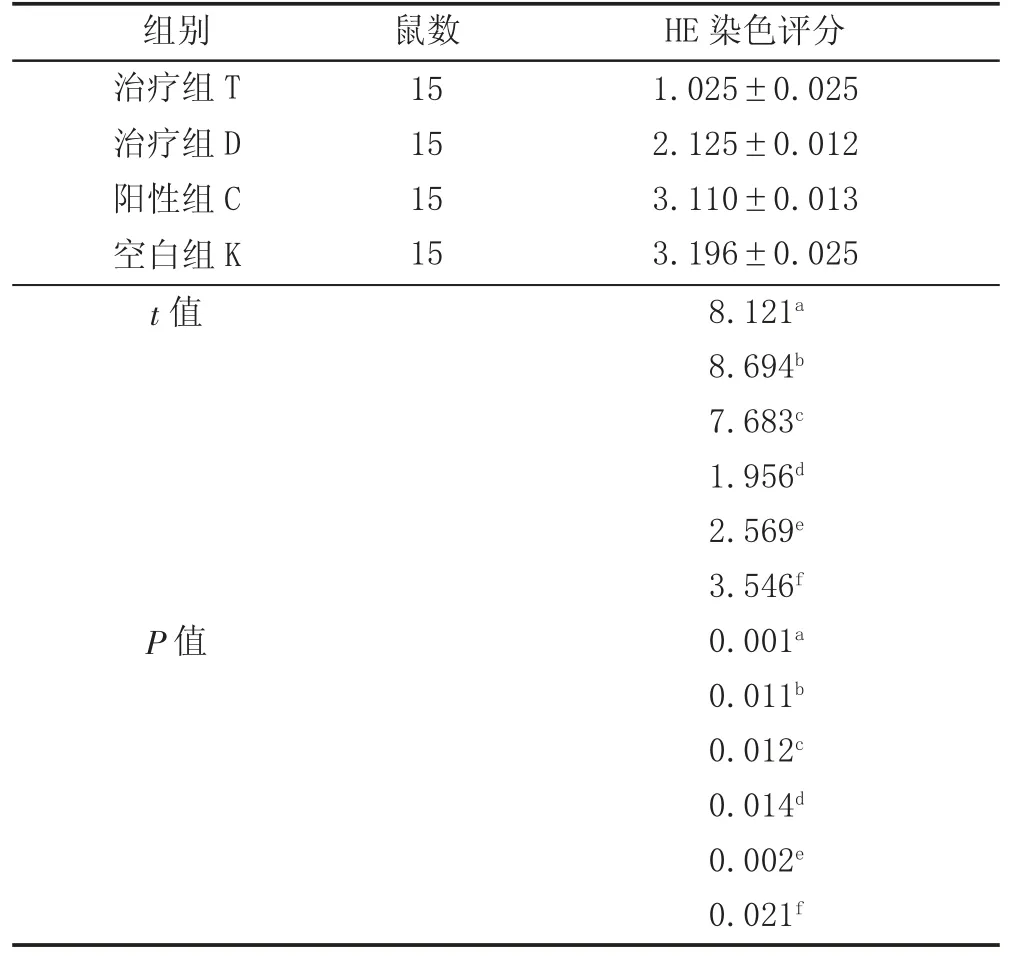
表3 各组肺部肺泡炎评分结果 (,分)
注:肺泡炎方差分析F=237.612,P=0.002<0.01;a 为治组T 与组D 比较,b 为组T 与组C 比较,C 为组T 与组K 比较,d 为组D 与组C,e 为组D与组K 比较,f 为组C 与组K 比较。
3 讨论
放射性肺炎发生的机制包括:遗传异质性、氧化应激、细胞损伤等原因[10]。肺泡毛细血管屏障由血管内皮细胞和肺泡上皮细胞构成,一旦发生放射性肺炎,肺泡腔内见大量血液渗出物和炎症细胞。会分泌大量的细胞因子,包括TGF-β、白介素-13、前列腺素E2、淋巴细胞等。TGF-β 是纤维化最密切的细胞因子,也是至今发现的最强的细胞外基质沉积促进剂[11]。CD4+T 细胞根据分泌的不同细胞因子,可分为Th1、Th2 细胞。Th2 主要通过分泌IL-1、IL-5、IL-10 以及单核细胞趋化蛋白1 等细胞因子,进一步介导体液免疫。研究发现,Th1/Th2 细胞因子的平衡向Th2 偏移是放射性肺炎发病机制之一[12]。Th2 的标志性细胞因子是IL-1,能够促进Th1 向Th2 偏移,并产生抑制Th1 细胞因子[13]。
当肺组织受到电离辐射作用后,会产生活性氧类物质。DNA、蛋白质及脂膜遭到活性氧的破坏,若机体的抗氧化体系,包括过氧化氢酶、SOD、谷胱甘肽过氧化物酶等不足以抵消这种破坏时,便会出现氧化应激损伤[14]。
巨噬细胞分为M1、M2 型巨噬细胞。多种促炎因子及一氧化氮合酶,主要由M1 巨噬细胞分泌。血管内皮生长因子、PDGF 等由M2 型巨噬细胞高表达,后诱导产生精氨酸酶,具有抗炎、促进损伤修复的作用。大量数据表明,疾病发生炎症阶段,M1 巨噬细胞的增加有助于清除病原微生物,抑制炎症反应并促进肺组织纤维化[15]。
艾叶主要有效成分为艾叶挥发油,具有抗菌、平喘、镇咳、增强免疫功能等作用[16-20]。努尔比耶·奥布力喀斯木等[21]检测出艾叶挥发油所含成分30 种,有石竹烯(13.2%)、α-萜品烯醇(5.28%)、β-丁香烯醇(4.86%)等。
本课题通过比较组T(艾叶挥发油α-萜品烯醇),组D(艾叶挥发油β-丁香烯醇),泼尼松(组C)3 种药物对治疗放射性肺炎大鼠的治疗效果,组T 中淋巴细胞数、炎性因子(TGF-β、PDGF、IL-1)含量明显低于组D、组C、组K(P <0.05)。组T 氧化应激指标(SOD)较组D、组C、组K 明显上升(P <0.05)。HE 染色,组T 大鼠仅出现轻度肺泡炎,组D 为中度肺泡炎,组C 主要为重度肺泡炎,组K 为极重度肺泡炎。组T 肺泡炎评分低于组D、组C、组K(P <0.5)。
本实验不足之处,首先,本研究为初步探索性动物实验研究,仅药物对放射性肺炎大鼠药效研究,而未对多药物剂量研究,后续进一步研究药效与剂量关系;其次,艾叶挥发油提取物治疗放射性肺炎大鼠作用机制需要进一步深入研究和探讨。
