小麦乙烯转录因子TaERF2响应湿害胁迫的表达分析
2022-05-06宋桂成周淼平余桂红姚金保马鸿翔
宋桂成 周淼平 余桂红 姚金保 马鸿翔
(1 江苏省农业科学院粮食作物研究所,江苏 南京 210014;2 扬州大学农学院,江苏 扬州 225009)
低氧胁迫是湿害造成植物代谢途径改变和生长减缓的主要原因,乙烯响应因子(ethylene-responsive factor,ERF)是植物应答非生物胁迫信号传导和调控相关基因表达的一类重要转录因子[1]。ERF是APETALA2/ethylene-responsive factor(AP2/ERF)的一个亚家族成员,含有至少一个保守的AP2/ERF结构域,大约由60个氨基酸组成[2]。ERF蛋白可以直接结合GCCbox或DRE/CRT顺式作用元件,调控靶基因的表达[3]。AP2/ERF的亚族成员含有各自保守的氨基酸序列结构和功能特征,参与植物湿害或低氧胁迫等非生物胁迫的表达调控[4]。研究发现,ERF通过参与植物激素合成、代谢物合成、活性氧(reactive oxygen species,ROS)清除等多种途径调节湿害或低氧胁迫等非生物胁迫应答[5]。淹水条件下,SNORKEL1和SNORKEL2可以诱导合成大量的赤霉素(gibberellin,GA),GA可以促进水稻茎部伸长生长,使受淹叶片伸出水面,进行有氧呼吸,提高深水稻在完全淹没条件下的耐淹性[6]。Yamauchi等[7]研究发现,低氧胁迫下乙稀合成前体1氨基环丙烷羧酸(1-cyclopropane carboxylic acid,ACC)处理小麦幼根,能增加烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶相关基因的表达,促进ROS合成,进而调控细胞程序性死亡(programmed cell death,PCD)相关信号通路,形成通气组织。ERF蛋白通过结合乙烯启动子区域GCCbox或DRE调控原件,促进乙烯合成,进而影响相关基因表达,形成通气组织,提高植株对湿害或低氧的抗性。Christianson等[8]通过对淹水处理的棉花进行转录组分析发现,淹水24 h后,受胁迫影响差异表达的1 305个基因中,ERFs主要参与激素合成、淀粉和氮代谢等途径,是调控植株湿害应答的重要响应因子。大豆ERFVII1、ERFVII4、ERFVII5和ERFVII8基因受湿害、低氧胁迫和外源乙烯的诱导表达,是大豆耐湿的重要响应因子[9]。前人研究发现,拟南芥ERF-Ⅶ家族的ERF主要参与低氧胁迫的应答,如RELATEDTOAPETALA2.2(RAP2.2)、RAP2.12通过启动子区域GCCbox或DRE顺式元件调控缺氧反应基因的表达,使植株适应缺氧环境[10-12]。
湿害造成低氧胁迫是导致小麦(TriticumaestivumL.)减产的主要因素之一[13]。研究小麦耐湿分子机制,挖掘调控耐湿的关键基因对提高小麦耐湿性和产量尤为重要[14]。在模式植物拟南芥和模式作物水稻中,ERF基因调控植株个体适应低氧胁迫环境的机制已较为完善[11-12],但在小麦中该基因仍有待深入研究。因此,挖掘和探索小麦耐低氧胁迫相关的ERF基因对提高小麦的耐湿性和产量有重要意义。
目前研究已发现小麦AP2/ERF家族基因有117个,ERF亚族共47个,虽已明确其中多数基因参与抗旱[15]、耐盐[16-17]、低温胁迫[16]等多种非生物胁迫应答[15-17],但ERF与湿害胁迫的关系和分子机制尚不清楚。Kim等[18]研究发现CRISPR/Cas9编辑TaERF3和TaDREB2可以显著提高小麦的耐干旱能力;Xu等[15]研究发现小麦TaERF2基因参与干旱、高盐和低温等非生物胁迫应答反应,可增强小麦多种胁迫的抗性;Makhloufi等[19]通过筛选硬质小麦(TriticumturgidumL.subsp.durum)的BAC文库获得TdERF1基因,并发现TdERF1与TaERF2、TaERF1有较高的同源性,同样参与盐胁迫、低温等非生物胁迫应答。因此,本研究分析TaERF2的结构域,以及与耐湿相关基因AtRAP2.12、AtRAP2.2和AtRAP2.3等的同源性,以期明确TaERF2的耐湿机制,对小麦耐湿性的遗传改良提供重要科学意义和应用价值。
1 材料与方法
1.1 ERF系统发育树构建和分组
参照Licausi 等[11]和Hess等[12]已报道的拟南芥AP2/ERF蛋白序列,采用BLAST query工具检索普通小麦品种中国春IWGSCv1.0注释蛋白序列(参数为E<1e-10,Identity>50),获得小麦AP2/ERF序列(图1)。将获取的小麦ERF序列与拟南芥耐湿相关的ERF成员进行Clustal X[20]序列比对分析,由特征序列分离出小麦耐湿相关的ERF基因。根据NCBI注册号下载已克隆小麦相关ERF蛋白序列,利用Clustal X软件对拟南芥、水稻、大豆和玉米耐湿ERF基因与小麦ERFs氨基酸序列进行多重序列比对分析,并用MEGA 6.0软件[21]通过邻接法构建系统发育树。所有基因ID详见图2。根据进化树及拟南芥AP2/ERF分组确定小麦中ERF基因的分组。
1.2 TaERFs基因组织表达差异分析
耐湿品种宁麦9号(江苏省农业科学院粮食作物研究所选育,耐湿品种[22])、不耐湿品种郑麦1354(河南省农业科学院提供,不耐湿品种),用于湿害处理和反转录PCR(reverse transcription-polymerase chain reaction,RT-PCR)试验。将长势一致的三叶一心小麦幼苗进行盆钵湿害胁迫处理,待水没过幼苗土表以上部分2 cm,于不同时间点(0、2、4、8、12、24、48、72、96 h和处理后第48小时)对根系和叶片进行取样,液氮速冻,-80℃冰箱中保存用于提取RNA。用R6827-01RNA提取试剂盒(Omegabio-Tek, 广州)提取样品总RNA,使反转录试剂盒(TaKaRa,日本)将总RNA反转录为cDNA。2×SYBR Green Realtime PCR Master Mix试剂盒(大连宝生物有限公司)进行RT-PCR试验,Actin(登录号AB181991)为内参基因,所有引物列于表1。每个反应重复3次,所得结果采用2-△△CT方法计算分析[23]。

表1 RT-qPCR引物序列
1.3 TaERF2蛋白结构域和同源性比对分析
采用在线软件MEME4.9对TaERF2蛋白序列进行保守基序分析,搜索motif值为16,基序长度范围为5~200个氨基酸残基,基序最小为10,其他值设为默认参数。TaERF2蛋白结构域通过SMART(http://smart.embl-heidelberg.de)数据库分析确定。NCBI中下载水稻和拟南芥已报道的耐湿ERF与小麦ERF蛋白序列,利用MNAMAN5.0进行同源性比对分析。
1.4 TaERF2基因结构和启动子顺式元件分析
利用GSDS在线软件分析TaERF2基因是否含有内含子及内含子的数量、TaERF2外显子和内含子位置信息,并绘制TaERF2基因的结构。利用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对TaERF2基因起始密码子前2 000 bp的基因组序列进行启动子元件分析。
1.5 TaERF2的原核表达分析
根据BioXM2.6.0(http://home.njau.edu.cn/~bioxm)软件对TaERF2基因ORF的酶切位点分析,设计用于扩增TaERF2基因ORF的引物对pGEX-TaE2-F:5′-C C G C T C G A G A T G T G C G G C G G C G C C A T C C T-3′与pGEX-TaE2-R:5′-G A C G T C G A C G T A G A A A C C A G C A G A C A A G G G-3′,上述引物对包含XhoI和SalI酶切位点。以TaERF2-T1 质粒为模板,PCR扩增引入酶切位点,50 μL扩增体系:TaERF2-T1质粒模板(100 ng·μL-1)1 μL,2×Phanta Max Master Mix 25 μL,上下游引物(10 μmol·L-1)各 2 μL,ddH2O 20 μL,扩增程序:95℃预变性3 min;95℃变性10 s,58℃退火15 s,72℃延伸50 s,32个循环;终72℃延伸5 min。电泳检测PCR产物,切胶回收目的片段,获得纯化的目的片段。将纯化的目的片段与pGEX-4T-1质粒双酶切后进行连接,连接产物转化DH5α,转化DH5α涂于培养基进行培养,挑单克隆摇菌,菌液PCR检测,测序,获得正确的含有双切位点质粒。采用热激法将重组质粒载体pGEX-TaERF2导入大肠杆菌BL21,对转化后的BL21菌株进行平板筛选,并挑单克隆扩繁,于-80℃菌液中保存备用。
将pGEX-TaERF2的BL21菌液接种于新鲜的100 mL 含有氨苄的LB培养基中,37℃振荡培养至生长期OD600=0.8,然后从10 mL扩大培养物中取2 mL菌液作为空白对照,其余8 mL菌液加入80 μL 0.1 mol·L-1异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopranoside, IPTG)至终浓度达到1 mmol·L-1。37℃诱导培养,分别于2、4、6、12和24 h吸取1 mL菌液,8 000 r·min-1离心8 min收集菌体。将收集的菌体加入100 μL 2×十二烷基硫酸钠(sodium dodecyl sulfate, SDS)上样缓冲液,使沉淀溶解悬浮,煮沸10 min,10 000 r·min-1离心10 min,取上清液,用5%浓缩胶、10%分离胶进行SDS聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),分析目的蛋白的表达情况。
2 结果与分析
2.1 TaERF2蛋白结构的分析
对TaERF2的氨基酸序列分析发现,TaERF2含有典型的AP2/ERF结构域(图1-A椭圆框),典型的YRG和RAYD元件(图1-B),并且含有3个碱性的核定位信号区和1个酸性激活区,1个磷酸化位点和4个潜在的糖基化位点(图1-A)。同源比对发现,TaERF2与拟南芥(ArabidopsisthalianaL.)RAP2.2、RAP2.12、RAP2.3、HRE1、HRE2[11,21]和水稻(OryzasativaL.)SNORKEL1、SNORKEL2[6]的耐渍基因同源性较高。
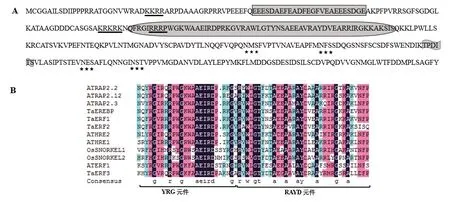
注:A:TaERF2保守域:黑色下划线表示碱性的核定位信号区,长方形方框表示酸性激活区,椭圆方框表示ERF结构域,旗帜阴影区表示磷酸化位点,星号区表示N端潜在的糖基化位;B:TaERF2与其他物种氨基酸序列的多重比对:YRG和RAYD是组成AP2/ERF结构域的两个主要基序。
2.2 TaERF2在AP2/ERF家族中类别的分析
为探究小麦TaERF2与其他物种ERF耐湿基因的同源进化关系和分组情况,将拟南芥[24-25]、水稻、大豆(GlycinemaxL.)、玉米(ZeamaysL.)AP2/ERF家族中耐湿ERF[26]与小麦TaERF2及已报道的多种胁迫抗性TaERF1[15]、抗旱和耐盐TaERF3[17,27]构建系统进化树。由图2可以看出,TaERF2(AAP32468.1)属于ERF亚族的B2组,与拟南芥ATRAP2.2(AT3G14230.1)、ATRAP2.12(AT1G53910)、ATRAP2.3(AT3G16770)[11]和水稻OsEREBP1(AAF23899.1)[6]属于同一亚族。

图2 AP2/ERF基因家族的系统进化树分析
2.3 小麦ERFs在根叶中的表达
为进一步验证TaERF2与小麦耐湿的关系,在宁麦9号根和叶组织中,将已经报道的小麦抗逆相关ERF基因TaERF3(GenBank: EF570122.1)、TaERF6(GenBank: JN681188.1)、TaERFBP(GenBank: AF542184.1)、TaERF4a(GenBank: JN681189.1)、TaERF4b(GenBank: JN681190.1)、TaERF5a(GenBank: JN681191.1)、TaERF5b(GenBank: JN681192.1)与TaERF2(GenBank: AAP32468.1)进行表达分析。由图3可知,受湿害胁迫条件下,小麦叶中TaERF2的表达情况为:2 h时其表达量与其他7个ERF基因有显著差异(图3-A),4 h时其表达量与TaERF6、TaERF5b有显著差异(图3-C),12、24、48 h时其表达量与其他7个ERF基因均无显著差异(图3-E、G、I);小麦根中TaERF2的表达情况为:渍水处理2、4、12、24、48 h 时其表达量与其他7个ERF基因有显著差异(图3-B、D、F、H、J),且渍水处理2、4 h时其表达量最高;TaERF2在小麦根中的表达量高于叶片中的表达量,而其他7个ERF基因在小麦根和叶中表达量差异均不显著。

注:A、C、E、G、Ⅰ: 湿害处理2、4、12、24、48 h,TaERF2、TaERF3、TaERF6、TaERFBP、TaERF4a、TaERF4b、TaERF5a和TaERF5b在叶中表达;B、D、F、H、J:湿害处理2、4、12、24、48 h,TaERF2、TaERF3、TaERF6、TaERFBP、TaERF4a、TaERF4b、TaERF5a和TaERF5b在根中表达。不同小写字母表示在P<0.05水平差异显著。
2.4 TaERF2基因结构和启动子区域分析
将TaERF2的mRNA全长序列与小麦基因组数据库Blast比对分析,结果如图4-A所示,TaERF2基因含有2个外显子和1个内含子,第1个外显子长度为262 bp,第2个外显子长度806 bp,内含子长度为874 bp。采用plantCARE对TaERF2基因上游2 000 bp区域的顺式元件分析发现,启动子区域含有3个缺氧诱导和厌氧诱导的顺式元件,1个ARE为缺氧诱导的顺式元件,2个GC-motif为厌氧诱导的顺式元件(图4-B)。另外,还有4个ABRE参与ABA响应的顺式元件,1个TATC-box参与GA响应的顺式元件,1个TCA-element参与SA响应的顺式元件。由上述结果推测,TaERF2可能受低氧或缺氧诱导参与小麦耐湿调控。

注:B:ABER:参与脱落酸反应的顺式作用元件;ARE:无氧诱导的重要顺式作用调节元件;CAT-box:与分生组织表达相关的顺式作用调节元件;CGTCA-motif: 参与茉莉酸反应的顺式作用调节元件;EIRE:激发子反应元件;GC-motif:参与缺氧特异性诱导的增强子元件;MBS:参与干旱诱导的MYB结合位点;TATC-box:参与赤霉素反应的顺式作用元件;TCA-element:参与水杨酸反应的顺式作用元件。
2.5 不同耐湿性小麦品种中TaERF2基因的表达差异分析
由图5可知,小麦叶片中,湿害胁迫处理2、4 h时,TaERF2在耐湿品种宁麦9号和不耐湿品种郑麦1354叶片中的表达量最高,除2、24、72和96 h外,TaERF2在耐湿和不耐湿品种叶片中的表达量间无显著差异;小麦根系中,TaERF2在宁麦9号根中的表达显著高于郑麦1354,且在2和4 h时表达量较高,显著高于其他时间点的表达量;渍水处理2和4 h时,宁麦9号根中TaERF2的表达显著高于叶片,其他处理时间点无显著差异,渍水处理4~96 h时,TaERF2在郑麦1354叶片中的表达量均显著高于根;停止渍水处理后48 h,宁麦9号和郑麦1354根和叶中TaERF2的表达均无显著差异。
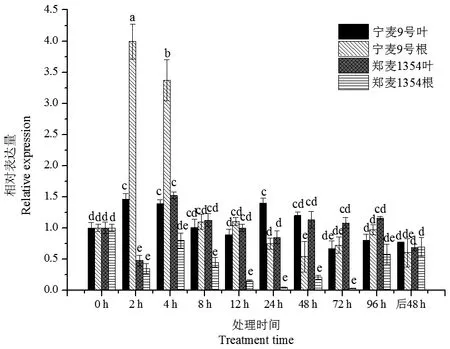
图5 TaERF2在宁麦9号和郑麦1354叶、根的表达
2.6 小麦TaERF2基因原核表达
以空载PGEX-4T-1转入感受态BL21为对照,在1 mmol·L-1IPTG、28℃诱导24 h条件下观察重组融合蛋白的表达。将重组表达菌株破碎裂解后的上清液SDS-PAGE电泳检测,如图6所示,在32~48 kDa之间有特异条带;由于表达的TaERF2蛋白预测大小为39.25 kDa,该特异条带与预测的大小基本吻合,说明该重组蛋白可以按照试验设计正确表达目的蛋白,并且由条带的宽度与染色程度可看出,重组蛋白在2 h开始大量表达,2 h后表达量明显降低。
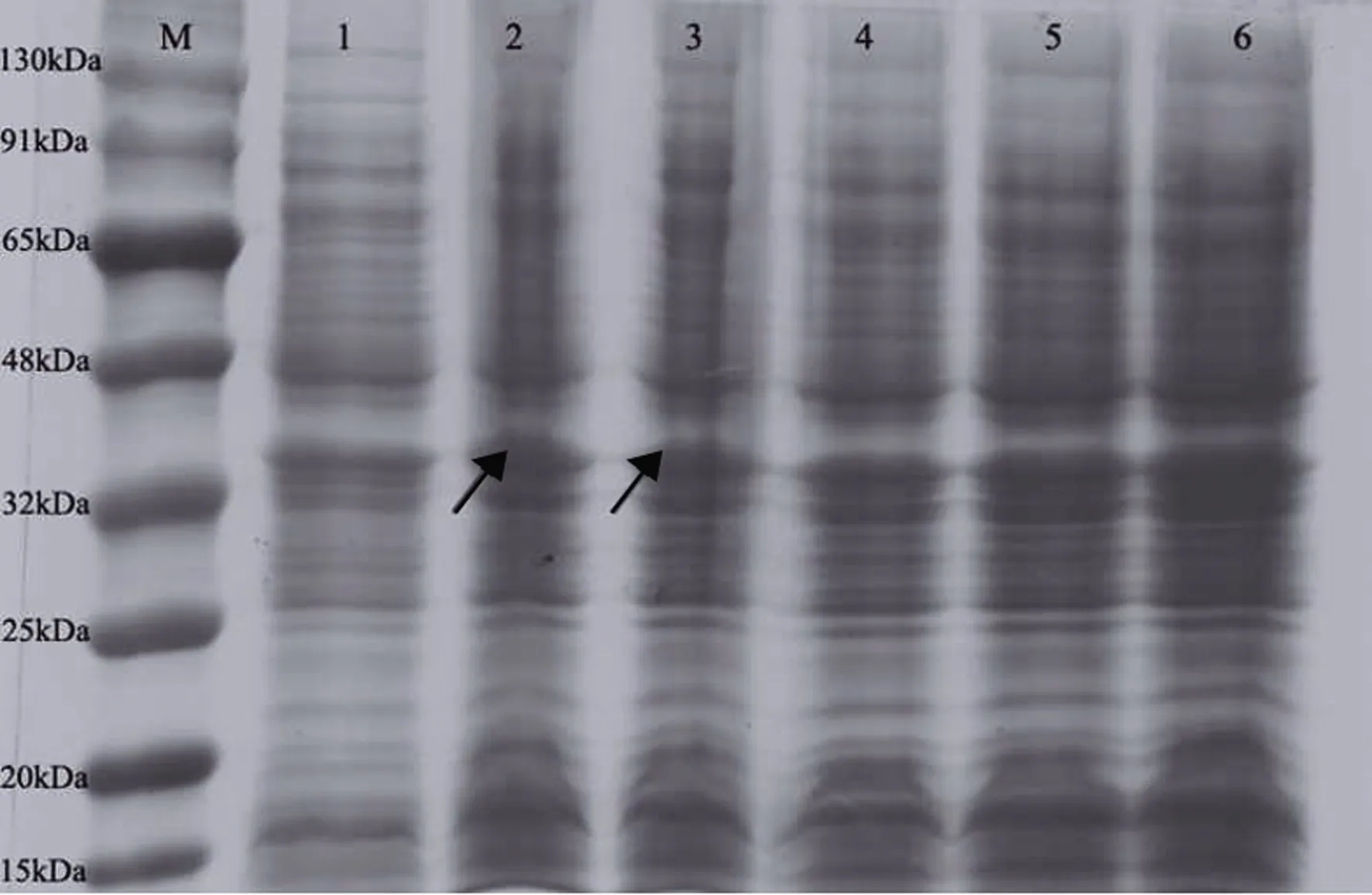
注:M: 蛋白Marker;1: IPTG诱导的pGEX-4T-1空载;2: pGEX-TaERF2诱导2 h;3: pGEX-TaERF2诱导4 h;4: pGEX-TaERF2诱导6 h;5: pGEX-TaERF2诱导12 h;6: pGEX-TaERF2诱导24 h。
3 讨论
湿害是影响小麦生产的世界性自然灾害[4]。长江中下游稻麦轮作麦区是我国的湿害重灾区,特别是小麦拔节到成熟期,降雨造成的湿害可导致小麦减产[13,28]。研究表明,小麦的耐湿性受相关基因的调控,特别是一些调控非生物胁迫的ERF基因[29]。小麦TaERF1基因含有典型AP2/ERF结构域,参与干旱、高盐和低温等非生物胁迫应答[15];二粒小麦TdERF1基因同样含有AP2/ERF结构域,并发现该基因与TaERF1具有相似的功能,且同样参与上述非生物胁迫应答[19]。本研究发现,TaERF2氨基酸序列含有1个典型的AP2/ERF结构域(图1),其磷酸化位点、核定位信号区和酸性激活区与AtRAP2.12的结构特征相同[25]。TaERF2与拟南芥RAP2.3、RAP2.12和RAP2.2及TdERF1、TaERF1OsSNORKEL1等有较高的同源性,同属于AP2/ERF家族的B2组(图2)。上述结果表明,TaERF2可能具有与拟南芥AtRAP2.12、AtHRE1[11,25]、水稻OsSNORKEL1[6]等基因相似的功能,参与小麦湿害胁迫应答。
通过对小麦叶和根中TaERF2、TaERF3、TaERF6、TaERF4a、TaERF4b、TaERF5a和TaERF5b的表达分析发现(图3),渍水胁迫后TaERF2在小麦根中的表达显著高于其他小麦ERFs基因的表达,并且在根中特异表达,表达量远高于叶片。虽然Xu等[15]和Rong等[17]研究发现TaERF1和TaERF3参与小麦多种非生物胁迫应答,但未明确其参与耐湿应答,且本研究并未发现湿害胁迫下TaERF3在根、叶中的表达有差异(如图3),且表达量低于TaERF2,因此其参与小麦耐湿应答的机制仍需进一步证实。
研究表明,小麦ERFs基因可能存在功能特异性,参与不同的非生物胁迫应答。对TaERF2基因结构和启动子区域进一步分析发现,TaERF2含有2个外显子和1个内含子,其上游启动子区域含有ABA、GA和SA等激素、缺氧厌氧顺式元件(图4),表明TaERF2参与湿害胁迫的响应。TaERF2在耐湿品种宁麦9号和不耐湿品种郑麦1354中的表达模式不同,TaERF2在宁麦9号根中的表达量显著高于郑麦1354,此外受湿害胁迫2 h后TaERF2在宁麦9号根系中大量表达,可能与宁麦9号具有较高耐湿性有关。原核表达的结果表明,TaERF2受诱导2和4 h后可快速启动表达,这与在宁麦9号根中的表达模式相似,推测TaERF2可能参与了湿害胁迫应答,并且受到胁迫后可快速应答。
4 结论
本研究对TaERF2蛋白结构、基因结构、启动子区域及表达进行了探究,结果表明,TaERF2与拟南芥AtRAP2.12、AtHRE1和水稻OsSNORKEL1、OsSNORKEL1有较高的同源性,且启动子区域含有缺氧厌氧顺式元件,推测TaERF2可能为小麦湿害胁迫响应基因。受湿害胁迫后,TaERF2在小麦根系中特异表达,在耐湿小麦品种宁麦9号根系中显著上调表达,而在不耐湿小麦品种郑麦1354根系中无明显变化。原核表达结果显示TaERF2可以快速响应pGEX-TaERF2诱导,与宁麦9号根中的表达模式相似。本研究证实TaERF2在小麦耐湿中具有一定的调节作用,为进一步明确AP2/ERF转录因子对小麦耐湿的分子调控作用提供了重要理论依据。
