岩黄连的化学成分及生物活性研究进展
2022-05-06李保宏张永康梁红宝姚景春秦国飞张贵民
张 晓,李保宏,张永康,梁红宝, ,姚景春,刘 忠,秦国飞*,张贵民, *
岩黄连的化学成分及生物活性研究进展
张 晓1,李保宏1,张永康1,梁红宝1, 2, 3,姚景春2, 3,刘 忠2,秦国飞2, 3*,张贵民1, 2, 3*
1.山东中医药大学药学院,山东 济南 250355 2.山东新时代药业有限公司,山东 临沂 276006 3.鲁南制药集团股份有限公司 中药制药共性技术国家重点实验室,山东 临沂 276006
岩黄连是我国西南地区的民间传统药物,临床上用于乙型肝炎、肝硬化、肝癌等肝病的治疗,极具开发价值。研究表明岩黄连中含丰富的生物碱、甾体、三萜、黄酮与核苷等类化合物,生物碱类为主要成分,多数化合物具有显著的生物活性,如抗病毒、抗炎、抗肿瘤、保肝、抑菌、抑制乙酰胆碱酯酶、镇痛等活性,特别是对乙肝、肝癌以及肝硬化等疾病的缓解作用比较显著。对岩黄连化学成分及生物活性的研究进展进行综述,以期为岩黄连的后续研究和深入开发提供参考。
岩黄连;生物碱;三萜;甾体;抗病毒;保肝;抑菌;镇痛
岩黄连又名石生黄堇、岩胡、土黄连、菊花黄连,为罂粟科紫堇属多年生草本植物岩黄连Bunting的全草[1],常生于山地林缘岩石隙缝中,主要分布于广西、贵州、云南等我国西南部地区,野生岩黄连采收时间多为秋后,除杂、洗净、晒干后即得。其性凉,味苦,具有清热解毒、利湿、止痛止血的功效,民间常用于治疗肝炎、口舌糜烂、火眼目翳、痢疾、腹泻、腹痛、痔疮出血等疾病[2]。目前,临床上有岩黄连注射液、岩黄连总生物碱胶囊和岩黄连片,主要用于肝癌、乙型肝炎、肝硬化、肺癌、新生儿高胆红素血症等疾病的治疗,具有很高的临床应用价值。
目前,国外尚无岩黄连化学成分及生物活性的报道,国内最早于1980年开始研究[3],但此后的25年缺乏岩黄连化学成分系统分离的报道,更多的是岩黄连总生物碱的活性研究。直到2005年,岩黄连单体化合物的研究逐渐活跃起来。截至2021年6月,从岩黄连中共报道了89个化合物,这些化合物的骨架类型众多、活性多样,涉及的结构包括生物碱、甾体、三萜和其他等类化合物,活性如抗病毒、抗炎、抗肿瘤、抗氧化、抑菌、抑制乙酰胆碱酯酶、降血糖、抗抑郁等。目前,有部分文献对岩黄连的化学成分及生物活性进行了综述[4-8],但多偏向于生物活性研究。其中,张成等[4]只给出3个化合物的结构,其他众多化合物的结构未能给出;诸葛明丽等[5]、余姣娇等[6]和黄巧琴[7]主要综述了岩黄连的药理作用及应用,对单体化学成分综述较少;唐超玲等[8]较好地阐述了岩黄连中的单体结构,以及岩黄连的药理作用,但收录的单体结构数量不够全面,且其综述的药理作用主要集中在岩黄连总生物碱,缺乏对单体成分的生物活性分析。本文对1980年5月—2021年6月岩黄连化学成分及生物活性研究的研究进展进行综述,以期为岩黄连的深层次研究和更好的利用提供参考。
1 化学成分
1.1 生物碱
岩黄连中含有丰富的生物碱类化合物,结构类型多样且发现新化合物的概率高,是我国学者的主要关注点。报道的89个化合物中生物碱(76个)约占85%,其中,新化合物14个,均为生物碱类化合物,涉及的生物碱包括苄基四氢异喹啉类、木脂酰胺类、其他类如吲哚、有机胺、胍型等结构类型。
1.1.1 苄基四氢异喹啉类 苄基四氢异喹啉类是岩黄连中数量最多的一类生物碱,也是主要的药效物质基础,碱性普遍较强;其中,报道最多的是原小檗碱类、小檗碱类,其次是阿朴菲类和苯并菲啶类,另外夹杂着少量的吗啡烷类、苯酞异喹啉类和双苄基四氢异喹啉类。
(1)原小檗碱类:岩黄连中报道的原小檗碱类化合物有20个(1~20),另有1个开环原小檗碱(21),其中,化合物3、5、15、16为新化合物。原小檗碱类生物碱的具体信息见表1,化学结构见图1。
表1 岩黄连中的原小檗碱类生物碱
Table 1 Protoberberine alkaloids from C.saxicola
编号化合物名称文献 1(−)-四氢非洲防己胺[(−)-tetrahydrocolumbamine] 3 2(+)-四氢巴马汀[(+)-tetrahydropalmatine] 3 32,9,10-三羟基-3-甲氧基四氢原小檗碱(2,9,10-thrihydroxy-3-methoxy-tetrahydroprotoberberine) 9 4d-紫堇碱(d-corydaline)10 5(−)-2,9-二羟基-3,11-二甲氧基-1,10-二硝基-四氢原小檗碱[(−)-2,9-dihydroxy-3,11-dimethoxy-1,10-dinitro-tetrahydroprotoberberine]11 6(−)-斯式紫堇碱[(−)scoulerine]10 7四氢巴马亭红碱(tetrahydropalmatrubine)12 8中位四氢刻叶紫堇明碱(mesotetrahydrocorysamine) 9 9刺罂粟碱(stylopine)10 10阿朴卡维汀(apocavidine) 9 11四氢表小檗碱(sinactine) 9 12(+)-卡维汀[(+)-cavidine]10 13碎叶紫堇碱(cheilanthifoline)10 14(+)-唐松草叶碱[(+)-thalictrifoline]11 15(+)-4-硝基异阿朴卡维汀[(+)-4-nitroisoapocavidine]11 16(+)-1-硝基阿朴卡维汀[(+)-1-nitroapocavidine]13 17(−)-13β-羟基刺罂粟碱[(−)-13β-hydroxystilopine] 3 18氢化小檗碱(canadine)10 19唐松草卡文碱(thalictricavine)12 20(−)-紫堇西定碱[(−)-corynoxidine]11 217-羟基异喹啉(7-isoquinolinol)12
(2)小檗碱类:小檗碱类化合物是岩黄连中报道的第2多的生物碱类化合物,有16个(22~37),其中,化合物31为新化合物。小檗碱类生物碱的具体信息见表2,化学结构见图2。
(3)阿朴菲类:岩黄连中报道了9个阿朴菲类生物碱(38~46)和1个开环阿朴菲生物碱(47),分别为8-羟基-9-甲氧基-11-硝基-利瑞尼碱(8-hydroxy-9-methoxy-11-nitro-lirinidine,38)[12]、异波尔定碱(isoboldine,39)[12]、紫堇块茎碱(corytuberine,40)[12]、bracteollne(41)[12]、北美鹅掌楸碱(liriotulipiferine,42)[12]、小鹰爪花碱(suaveoline,43)[12]、石生黄堇碱A(saxicolalines A,44)[20]、(+)-异紫堇定碱[(+)-isocorydin,45][21]、木兰花碱[magnoflorine,46][15]、-甲基那碎米辛(-methylnarceimicine,47)[20]。其中,化合物38、44、47为新化合物。岩黄连中阿朴菲类生物碱的化学结构见图3。
表2 岩黄连中的小檗碱类生物碱
Table 2 Berberine alkaloids from C.saxicola
编号化合物名称文献 22非洲防己碱(columbamine)14 23巴马汀(palmatine)15 24去氢分离木瓣树胺(dehydrodiscretamine)10 25药根碱(jatrorrhizine)16 26四去氢金黄紫堇碱(tetradehydroscoulerine)17 27去氢碎叶紫堇碱(dehydrocheilanthifoline)14 28表小檗碱(epiberberine)18 29脱氢卡维汀(dehydrocavidine)17 30脱氢阿朴卡维汀(dehydroapocavidine)17 31脱氢异阿朴卡维汀(dehydroisoapocavidine)17 32小檗因(berbinium)19 33小檗红碱(berberrubine)19 34小檗碱(berberine)10 35刻叶紫堇明碱(corysamine)14 36黄连碱(coptisine)15 37去氢黄连碱(dehydrocoptisine)12
(4)苯并菲啶类:苯菲啶类生物碱有9个,分别为8-丙酮基二氢白屈菜红碱(8-acetonyl-dihydrochelerythrine,48)[11]、血根碱(sanguinarine,49)[11]、二氢血根碱(dihydrosanguinarine,50)[15]、6-甲氧基二氢血根碱(6-methoxydihydrosanguinarine,51)[12]、11-甲氧基白屈菜红碱(11-methoxychelerythrine,52)[12]、白屈菜红碱(chelerythrine,53)[12]、二氢白屈菜红碱(dihydrochelerythrine,54)[15]、6-丙酮基-5,6-二氢血根碱(6-acetonyl-5,6-dihydrosanguinarine,55)[15]、岩黄连灵碱(cavidilinine,56)[22]。其中,化合物56为新化合物。岩黄连中苯并菲啶类生物碱的化学结构见图4。

图2 岩黄连中小檗碱类生物碱的化学结构

图3 岩黄连中阿朴菲类生物碱的化学结构
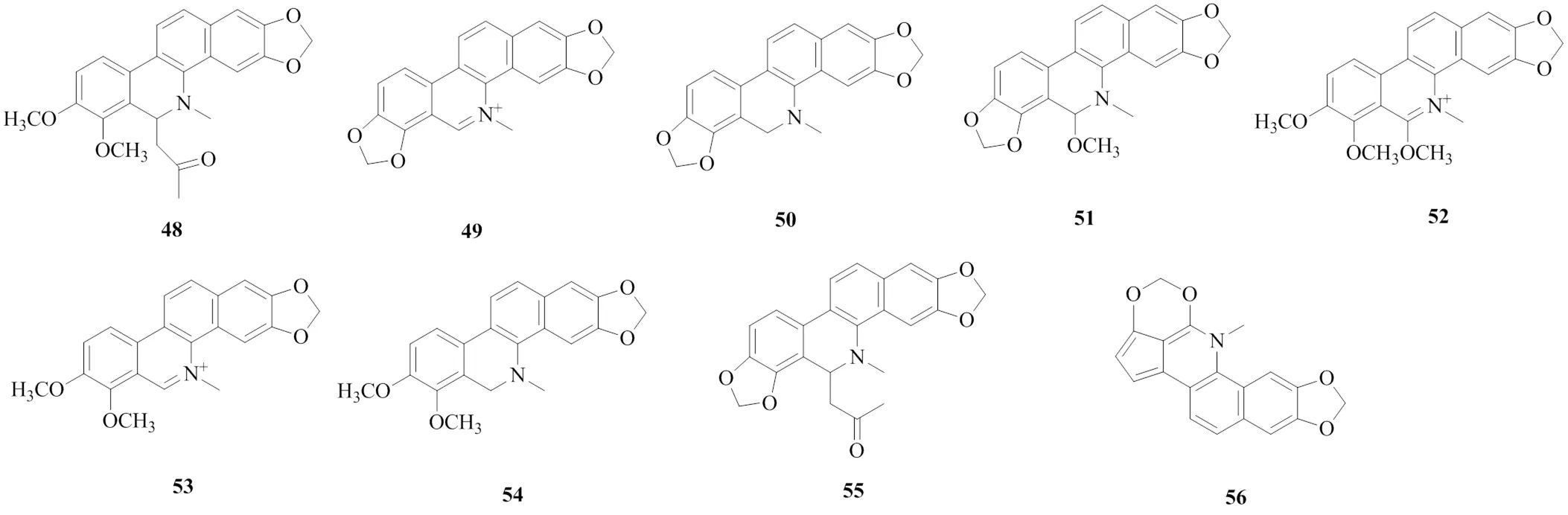
图4 岩黄连中苯并菲啶类生物碱的化学结构
(5)其他类:另外,还有一些数量较少的异喹啉生物碱,如普罗托品类别隐品碱(allocryptopine,57)[23]、原阿片碱(protopine,58)[24],苯酞异喹啉类山缘草定碱(adlumidine,59)[20]、双苄基四氢异喹啉类刺檗碱(oxyacanthine,60)[23]、简单异喹啉类黄堇碱(corypalline,61)[21]和(−)-沙罗泰里啶[(−)-salutaridine,62][15]、深山黄堇碱(pallidine,63)[10]。其他异喹啉类生物碱的化学结构见图5。
1.1.2 木脂酰胺类 木脂酰胺类生物碱8个,分别为石生黄堇碱A(corydalisins A,64)[25]、石生黄堇碱B(corydalisins B,65)[25]、石生黄堇碱C(corydalisins C,66)[25]、大麻素D(cannabisin D,67)[25]、大麻素E(cannabisin E,68)[25]、大麻素F(cannabisin F,69)[25]、1,2-二氢-6,8-二甲氧基-7羟基-1-(3,5-二甲氧基-4-羟基苯基)-1,2-二[2-(4-羟基苯基)乙基]-2,3-萘二乙酰胺(1,2-dihydro-6,8-dimethoxy-7-hydroxy-1-(3,5-dimethoxy-4-hydroxyphenyl)-1,2-bis[2-(4-hydroxyphenyl)ethyl]-2,3-naphthalene dicarboxamid,70)[25]、克罗酰胺(grossamide,71)[25],其中,化合物64~66为新化合物。木脂酰胺类生物碱的化学结构见图6。
1.1.3 其他类 另外,还有一些其他类生物碱,如吲哚类生物碱1-甲酰-5-甲氧基-6-甲基吲哚(1-formyl-5-methoxy-6-methy-lindoline,72)[17]、1-甲酰基-2-羟基-5-甲氧基-6-甲基吲哚(1-formyl-2-hydroxy-5-methoxy-6-methy-lindoline,73)[17],有机胺类生物碱十四-氨基-二十七烷(74)[26]、十四-氨基-二十八烷(75)[26],胍型类生物碱阿魏酰胍丁胺(feruloylagmatine,76)[21],其中,化合物72、73为新化合物。其他类生物碱的化学结构见图7。
1.2 甾体类
岩黄连中报道的甾体类化合物较少,均为常见的甾体及其苷类化合物,如胆甾醇(cholesterol,77)[26]、β-谷甾醇(β-sitosterol,78)[23]、豆甾醇(stigmasterol,79)[12]、胡萝卜苷(daucosterol,80)[23]。甾体类化合物的化学结构见图8。

图5 岩黄连中其他异喹啉类生物碱的化学结构

图6 岩黄连中木脂酰胺类生物碱的化学结构
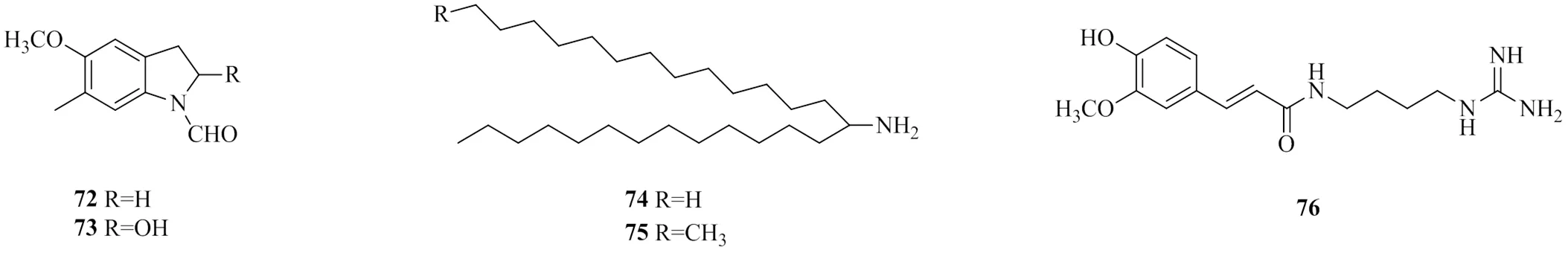
图7 岩黄连中其他类生物碱的化学结构
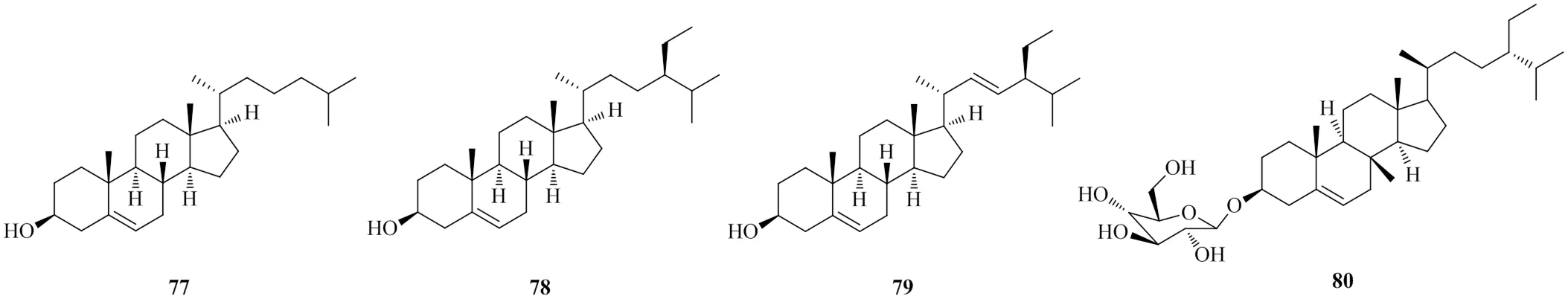
图8 岩黄连中甾体类的化学结构
1.3 三萜类
岩黄连中报道的三萜类化合物有6个,分别为齐墩果酸(oleanolic acid,81)[23]、β-香树脂醇(β-amyrin,82)[23]、β-香树脂醇乙酸酯(β-amyrin acetate,83)[23]、环桉烯醇(cycloeucalenol,84)[23]、白桦脂醇(betulin,85)[23]、白桦脂酸(betulinic acid,86)[23]。三萜类化合物的化学结构见图9。
1.4 黄酮类与核苷类
除了生物碱类、甾体类、三萜类之外,还有如槲皮素-3--β--半乳糖苷(quercetin-3--β--galactoside,87)[22]和5-羟基-3′,4′,6,7-四甲氧基黄酮(5-hydroxy-3′,4′,6,7-tetramethoxyflavonel,88)[22]的黄酮类以及核苷类化合物尿嘧啶(uracil,89)[22]。黄酮类与核苷类化合物的化学结构见图10。
2 生物活性
2.1 抗病毒
2.1.1 抗乙型肝炎病毒(hepatitis B virus,HBV) 岩黄连对乙型肝炎病毒的复制及相关蛋白的分泌具有抑制作用。HBV对肝脏会产生较为严重的损伤,岩黄连总生物碱能在较短时间内产生相应抗体,清除HBV,并修复受损的肝组织[27]。二氢白屈菜红碱(54)和(−)-沙罗泰里啶(62)对HBV均具有很强的抑制作用,两者对乙型肝炎表面抗原(hepatitis B surface antigen,HbsAg)的半数抑制浓度(median inhibitory concentration,IC50)值分别为<0.02和0.09 mg/mL[15]。石生黄堇碱A(44)和-甲基那碎米辛(47)显示中度的抗HBV活性,对HBsAg的IC50值分别为2.19、1.22 μmol/L[20]。去氢碎叶紫堇碱(27)除了能抑制HbsAg的分泌,还可以抑制乙型肝炎e抗原(hepatitis B virus e antigen,HbeAg)的分泌和乙肝病毒的复制[28]。另有实验表明脱氢卡维汀(29)和脱氢阿朴卡维汀(30)等小檗碱类化合物抑制HBV的活性显著优于阿朴卡维汀(10)等原小檗碱类化合物[12]。综上,岩黄连可能通过抑制HbsAg、HbeAg等的分泌来抑制HBV活性,清除HBV,减少HBV对肝脏的影响。
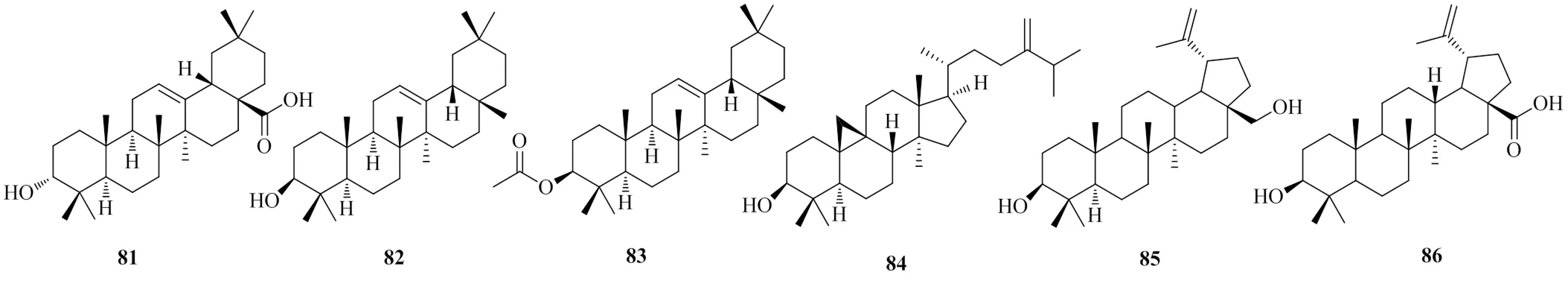
图9 岩黄连中甾体类的化学结构

图10 岩黄连中黄酮类与核苷类的化学结构
2.1.2 抗其他病毒-紫堇碱(4)可以抑制肠道病毒71(enterovirus 71,EV71)中关键结构蛋白、非结构蛋白和环氧合酶-2(cyclooxygenase-2,COX-2)的表达、以及有丝分裂原激活蛋白(mitogen activated protein kinase,MAPK)等信号通路的磷酸化,发挥抑制EV71复制的作用[29]。巴马汀(23)可以与Zika病毒的包膜蛋白结合,阻断病毒进入细胞,这或许对治疗胎儿严重先天性脑畸形和成人麻痹性格林-巴利综合征有较好作用[30]。小檗碱(34)可以嵌入病毒的DNA序列中,也可调节病毒复制的信号通路,从而抑制DNA的合成,对人乳头瘤病毒等多种病毒的复制具有抑制作用[31-32]。
2.2 抗炎
在1,1-二苯基-2-三硝基苯肼自由基清除实验中,碎叶紫堇碱(13)、氢化小檗碱(18)、深山黄堇碱(63)、去氢碎叶紫堇碱(27)的IC50值分别为0.25、2.18、1.00、1.63 mg/mL,叔胺碱的抗氧化活性要高于其相应的季胺碱,可能为岩黄连的主要抗炎成分[10]。刺罂粟碱(9)对脂多糖诱导的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等各种细胞内因子的产生具有抑制作用,通过下调一氧化氮合成酶和COX-2的表达,从而产生抗炎作用[33]。氢化小檗碱(18)对二甲苯导致的小鼠耳部炎性水肿具有抑制作用,实验组水肿程度明显降低[34]。巴马汀(23)对醋酸诱导的大鼠胃溃疡有明显的抗炎和保护胃黏膜的作用,10、20 mg/kg剂量组分别显著减少51.42%、60.92%的溃疡面积[35]。黄连碱(36)能抑制核因子-κB(nuclear factor-κB,NF-κB)的表达从而抑制IL-1β诱导的炎症反应,对于因炎症致使的软骨细胞活力下降具有逆转作用,其抗炎作用对治疗骨关节炎有一定效果[36],此外,对卵清蛋白诱导的过敏性鼻炎有抑制作用,可以明显减少鼻摩擦次数,并且降低组胺、IL-4和TNF-的水平[37]。所以岩黄连可能通过抑制NF-κB的表达、降低IL-6和IL-1β等细胞因子水平产生较强的抗炎活性,并且叔胺碱可能为主要活性物质。
2.3 抗肿瘤
岩黄连能抑制癌细胞增殖、扩散,并诱导其凋亡来产生抗肿瘤活性。研究发现岩黄连总生物碱10 μg/mL能抑制非小细胞肺癌的生长和迁徙能力,其可能是通过影响基因及其相关蛋白的表达来发挥抑制作用[38]。石生黄堇碱C(66)对人胃癌MGC-803细胞和膀胱癌T24细胞的生长抑制作用很强,IC50分别为8.81、9.62 μmol/L,且在100 μmol/L下几乎不抑制正常细胞系HL-7702的生长[25]。中位四氢刻叶紫堇明碱(8)能够下调抗凋亡蛋白、上调促凋亡蛋白的表达,促进细胞因子从线粒体向胰腺癌细胞释放,抑制胰腺癌细胞的生长[39]。非洲防己碱(22)能够抑制热休克蛋白90介导的转录激活因子3信号通路的表达,对黑色素瘤细胞的扩散、增殖具有抑制作用,从而发挥抗黑色素瘤的作用[40]。岩黄连总生物碱和脱氢阿朴卡维汀(30)抑制NF-κB的活性,从而降低NF-κB进入细胞核活化端粒酶的能力,抑制人舌鳞癌细胞的增殖[41]。血根碱(49)对于耐药肿瘤细胞具有明显的细胞毒性,对癌细胞的细胞膜上糖蛋白活性具有抑制作用,减少糖蛋白对药物的排出,使得药物摄取增加,并且能够显著抑制NF-κB的活化[42]。综上,岩黄连在发挥抗肿瘤作用中,可能通过抑制肿瘤细胞基因、NF-κB以及相关蛋白的表达来抑制肿瘤生长和扩散。
2.4 保肝
肝纤维化是一种肝损伤,能缓慢发展为肝硬化,岩黄连能缓解肝纤维化发展为肝硬化。在四氯化碳诱导的肝纤维化、肝损伤小鼠模型中,脱氢卡维汀(29)可能通过提高超氧化物歧化酶、谷胱甘肽氧化酶的活性,调节相关蛋白的表达从而降低四氯化碳对肝的伤害,对肝具有保护作用[43];巴马汀(23)、脱氢卡维汀(29)、小檗碱(34)在0.1 mg/mL时,对肝星状细胞凋亡率分别为42.12%、42.22%、36.73%[44],另外,该课题组发现转化生长因子-β1与肝纤维化之间存在至关重要的联系,CSBTA通过抑制转化生长因子-β1的表达,缓解肝纤维化发展为肝硬化[45];别隐品碱(57)对四氯化碳导致的肝纤维化、肝损伤具有一定的保护作用,但对血吸虫尾蚴感染导致的肝纤维化保护作用不明显[46]。岩黄连可能通过调节超氧化物歧化酶等的活性和促进肝星状细胞的凋亡来发挥保肝作用。
2.5 抑菌
岩黄连治疗因细菌、真菌感染的痢疾、腹泻等疾病有较好作用。二氢血根碱(50)和二氢白屈菜红碱(54)对植物病原真菌番茄灰霉病菌具有较好的抑制作用,在50 mg/L时,菌丝生长抑制率分别为95.16%、98.32%,同时对离体的番茄灰霉病菌孢子的萌发具有抑制作用,半数有效浓度值分别为56.35、44.26 μg/mL[47]。木兰花碱(46)对红色毛癣菌的孢子萌发和菌丝生长具有抑制作用,最低抑菌浓度为62.5 μg/mL,其不仅能够使菌丝生长变形,而且能够降低真菌细胞内的角鲨烯环氧化酶活性和麦角甾醇的含量,破坏真菌的细胞膜,进而抑制真菌的活性[48]。药根碱(25)对耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)的抑制活性较低,但可以和诺氟沙星协同产生强效的抑菌作用,对MRSA的耐药性有抑制作用,且能抑制药物外流[49];小檗碱(34)在128、256 μg/mL下对MRSA的平均抑菌直径分别为8、12 mm[50]。岩黄连可能通过抑制细菌和真菌增殖产生强效的抑菌作用,并且对细菌排斥药物具有一定的抑制作用。
2.6 抑制乙酰胆碱酯酶
2,9-二羟基-3,11-二甲氧基-1,10-二硝基-四氢原小檗碱(5)、(+)-1-硝基-阿朴卡维汀(16)、巴马汀(23)、脱氢卡维汀(29)、小檗碱(34)和血根碱(49)对乙酰胆碱酯酶均具有强抑制活性,IC50值分别为(8.77±0.2)、(1.87±0.48)、(2.20±0.46)、(9.92±0.23)、(1.70±0.31)、(1.93±0.01)μmol/L[11]。此外,小檗碱还可以减少β-淀粉样蛋白的生成、降低神经炎症、减少炎症对神经细胞的伤害[51],还具有神经营养的作用,使神经细胞能够保持较好状态,缓解阿尔茨海默症[52]。
2.7 降血糖
二氢血根碱(50)通过抑制单磷酸腺苷活化的蛋白激酶α(AMP-activated protein kinase α,AMPKα)的表达,上调过氧化物酶增殖物激活受体γ及其基因的表达,显著增强小鼠胚胎成纤维细胞对葡萄糖的摄取,降低血糖浓度[53]。齐墩果酸(81)和熊果酸可以产生良好的协同作用,二者可以和α-葡萄糖苷酶的不同位点结合,导致其构象改变而活性降低,使血糖降低[54]。白桦脂酸(86)是G-蛋白偶联胆汁酸受体5(G-protein coupled bile acid receptor 5,TGR5)的激动剂,通过激活TGR5来增加细胞摄取葡萄糖,刺激胰高血糖素肽Ⅰ的分泌,从而降低血糖[55]。
2.8 抗抑郁
单胺氧化酶A可以促进5-羟色胺脱氨而失去活性,四氢非洲防己胺(1)与单胺氧化酶A有较好的亲和力,IC50值为(44.66±4.16)μmol/L,减少5-羟色胺失活,使更多的5-羟色胺发挥活性[56]。药根碱(25)能阻断单胺神经传递,抑制摄取-2转运体对5-羟色胺和去甲肾上腺素的再摄取作用,产生抗抑郁的作用[57]。
2.9 镇痛
岩黄连对因癌症治疗产生的疼痛具有较好的镇痛作用。骨癌治疗会引起转移性骨痛,岩黄连总生物碱对骨溶解以及破骨细胞的生成具有抑制作用,明显降低患者因治疗而产生的疼痛感,具有较好的镇痛作用[58]。岩黄连总生物碱对因顺铂治疗而导致的神经性疼痛具有改善作用,腹膜注射顺铂后,TNF-α和IL-1β含量以及瞬态受体电位香草样受体1(transient receptor potential vanilloid receptor 1,TRPV1)表达均增高,经CSBTA治疗后,TNF-α和IL-1β含量、TRPV1表达回归正常水平,神经性疼痛导致的热、冷和机械性痛觉过敏等得到改善[59]。紫杉醇治疗癌症会产生周围神经病变等不良反应,实验组经岩黄连总生物碱治疗,当质量分数为120 mg/kg时,治疗20 d,实验组与对照组的冷痛阈值已没有显著性差异,大鼠血清中IL-1β等细胞因子明显降低,周围神经病变明显得到改善,其机制可能是岩黄连总生物碱通过调节蛋白激酶Cε/p38 MAPK/TRPV1信号通路,降低促炎因子的水平,实现镇痛作用[60]。热板法和扭体法小鼠模型中,氢化小檗碱(18)的低(2 g/mg)、中(6 g/mg)、高(18 g/mg)剂量组痛阈值均有明显的提升作用[34]。所以,岩黄连的镇痛作用可能是通过调节IL-1β等细胞因子和相关信号通路的表达,使疼痛阈值恢复或高于正常水平,达到镇痛作用。
2.10 其他
岩黄连水提液可以缓解因新生儿高胆红素血症导致的大鼠听觉损伤,耳蜗核组织胆红素沉积明显减少,这可能与磷脂酶C/磷酸肌醇信号通路的激活有关[61]。四氢巴马汀(2)对放疗肺部肿瘤引起的肺部细胞损伤有保护作用,可减轻肺纤维化和肺部慢性炎症、改变脂质过氧化水平[62]。此外,化合物2还具有抑制氧化应激和乙酰胆碱酯酶活性、减少炎症发生、上调胶质细胞源性神经营养因子蛋白的表达,对氯胺酮诱导的学习障碍和记忆损伤具有保护作用[63]。
卡维汀(12)对乙醇诱导的胃黏膜损伤具有保护作用[64],还能够通过抑制促炎因子和细胞因子从而保护小鼠因外毒素而导致的休克,并且能够显著减轻脂多糖诱导的肺、肝、肾的损伤[65],此外,对离体豚鼠的回肠具有解痉作用,在10 μg时解痉率达84%[66]。表小檗碱(28)能够抑制AMPKα/蛋白激酶B等信号通路的磷酸化,下调脂肪形成的转录因子的表达,抑制脂肪形成[67],抑制线粒体相关途径,促进细胞凋亡和阻滞细胞周期而抑制肿瘤的生长,产生抗胃癌作用[68],还能够减轻糖尿病所引起的相关代谢障碍,减轻肾脏纤维化,治疗因糖尿病引起的糖尿病肾病[69]。
3 结语与展望
岩黄连主产于广西、贵州、云南等我国西南部地区,在民间常以全草煎服或研碎涂抹患处等为主要使用方法,应用历史悠久,治疗肝炎、痢疾、目翳等疾病效果优良。近年来,以岩黄连总生物碱为有效成分开发的岩黄连注射液、岩黄连片和岩黄连胶囊等在临床上治疗肝脏疾病效果良好,但岩黄连的相关质量标准未被《中国药典》2020年版收录,对其化学成分和生物活性总结归纳意义重大。
研究表明,岩黄连化学成分较为复杂,目前已经报道的89个化合物中,包括生物碱、甾体、三萜和黄酮等类化合物,生物碱类为主要成分,多数化合物具有显著的生物活性,如明显的抗病毒、抗炎、抗肿瘤、保肝、抑菌、抑制乙酰胆碱酯酶、镇痛等活性,特别是对乙肝、肝癌以及肝硬化等疾病的缓解作用比较显著。但是目前相关研究主要集中在岩黄连总生物碱的活性方面,对岩黄连化学成分和作用机制的相关研究仍然较少,因此,有必要对岩黄连进行系统性的分离和生物活性测定以及相关机制的研究,为岩黄连的开发和药效物质基础研究提供相关依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 韦记青, 蒋水元, 蒋运生, 等.药用植物岩黄连研究概述 [J].广西科学院学报, 2006, 22(2): 108-111.
[2] 毛宇昂, 梁永红.岩黄连的研究综述 [J].时珍国医国药, 2006, 17(4): 630-631.
[3] 柯珉珉, 张宪德, 吴练中, 等.岩黄连有效成分的研究 [J].中国药学杂志, 1980, 15(6): 41.
[4] 张成, 姚兴东, 雷福厚.岩黄连中生物碱的研究进展 [J].化工技术与开发, 2020, 49(12): 9-13.
[5] 诸葛明丽, 蒋伟哲, 肖萍, 等.壮药岩黄连研究进展 [J].海峡药学, 2019, 31(5): 31-34.
[6] 余姣娇, 邱志霞, 刘秋燕, 等.岩黄连的研究进展 [J].药学研究, 2018, 37(6): 342-345.
[7] 黄巧琴.药用植物石生黄堇研究进展 [J].现代农业科技, 2011(15): 117-118.
[8] 唐超玲, 刘平, 郑华, 等.岩黄连化学成分及药理作用研究进展 [J].中药新药与临床药理, 2018, 29(1): 104-109.
[9] Li H L, Zhang W D, Han T,.Tetrahydroprotoberberine alkaloids from[J]., 2007, 43(2): 173-175.
[10] 何志超, 王冬梅, 李国成, 等.岩黄连生物碱类成分及其抗氧化活性研究 [J].中草药, 2014, 45(11): 1526-1531.
[11] Huang Q Q, Bi J L, Sun Q Y,.Bioactive isoquinoline alkaloids from[J]., 2012, 78(1): 65-70.
[12] 李慧梁.岩黄连活性成分系统研究及藜芦毒性成分研究 [D].上海: 第二军医大学, 2006.
[13] Li H L, Zhang W D, Wei Z,.A new nitro alkaloid fromBunting [J]., 2005, 16(3): 367-368.
[14] 周元瑶, 陈燕祥, 朱斌, 等.高效液相色谱-二极管阵列检测法用于植物药中原小檗碱型季铵生物碱的研究 [J].中草药, 1989, 20(7): 5-8.
[15] 吴颖瑞, 马云宝, 赵友兴, 等.岩黄连的抗乙肝病毒活性成分研究 [J].中草药, 2012, 43(1): 32-37.
[16] 吴杨, 陆兔林, 季德, 等.岩黄连中生物碱的分离和结构鉴定 [J].南京中医药大学学报, 2015, 31(1): 81-83.
[17] Li H L, Han T, Liu R H,.Alkaloids fromand their anti-hepatitis B virus activity [J]., 2008, 5(5): 777-783.
[18] 夏稷子.岩黄连与黄连的薄层色谱比较 [J].基层中药杂志, 2002, 16(1): 36.
[19] 王奇志, 梁敬钰, 冯煦.岩黄连中的一个新生物碱 [J].中国天然药物, 2009, 7(6): 414-416.
[20] Wu Y R, Ma Y B, Zhao Y X,.Two new quaternary alkaloids and anti-hepatitis B virus active constituents from[J]., 2007, 73(8): 787-791.
[21] Cheng X X, Wang D M, Jiang L,.DNA topoisomerase I inhibitory alkaloids from[J]., 2008, 5(7): 1335-1344.
[22] Wang Q Z, Liang J Y, Feng X.A new alkaloid from the herb of[J]., 2009, 7(6): 414-416.
[23] 王奇志, 梁敬钰, 原悦.岩黄连化学成分 [J].中国天然药物, 2007, 5(1): 31-34.
[24] Jarošová P, Sándor R, Slaninková A,.Quaternary protoberberine alkaloids and their interactions with DNA [J]., 2019, 73(12): 2965-2973.
[25] Zhang B, Huang R Z, Hua J,.Antitumor lignanamides from the aerial parts of[J]., 2016, 23(13): 1599-1609.
[26] 毛宇昂.岩黄连化学成分和活性的研究 [D].南宁: 广西医科大学, 2006.
[27] 刘立, 张光华.岩黄连治疗病毒性肝炎并高胆红素血症31例 [J].药物流行病学杂志, 2001, 10(4): 182.
[28] Zeng F L, Xiang Y F, Liang Z R,.Anti-hepatitis B virus effects of dehydrocheilanthifoline from[J]., 2013, 41(1): 119-130.
[29] Wang H Q, Hu J, Yan H Y,.Corydaline inhibits Enterovirus 71 replication by regulating COX-2 expression [J]., 2017, 19(11): 1124-1133.
[30] Ho Y J, Lu J W, Huang Y L,.Palmatine inhibits Zika virus infection by disrupting virus binding, entry, and stability [J]., 2019, 518(4): 732-738.
[31] Warowicka A, Nawrot R, Goździcka-Józefiak A.Antiviral activity of berberine [J]., 2020, 165(9): 1935-1945.
[32] Shao J P, Zeng D B, Tian S H,.Identification of the natural product berberine as an antiviral drug [J]., 2020, 10(1): 164.
[33] Jang S I, Kim B H, Lee W Y,.Stylopine frominhibits LPS-induced inflammatory mediators in RAW 264.7 cells [J]., 2004, 27(9): 923-929.
[34] 黄祖良, 韦启后, 汤春荣, 等.氢化小檗碱镇痛和消炎作用的研究 [J].江西中医学院学报, 2002, 14(1): 33-34.
[35] Wang L, Wang X, Zhang S L,.Gastroprotective effect of palmatine against acetic acid-induced gastric ulcers in rats [J]., 2017, 71(1): 257-264.
[36] Zhou K, Hu L, Liao W J,.Coptisine prevented IL-β-induced expression of inflammatory mediators in chondrocytes [J]., 2016, 39(4): 1558-1565.
[37] Fu S L, Ni S H, Wang D N,.Coptisine suppresses mast cell degranulation and ovalbumin-induced allergic rhinitis [J]., 2018, 23(11): 3039.
[38] Li M M, Wang J Y, Mo B W,.Total alkaloids ofBunting inhibits migration of A549 cells by suppressing Cdc42 or Vav1 [J]., 2018, 15(1): 475-482.
[39] Zhou J B, Peng G, Li J,.Anticancer activity of tetrahydrocorysamine against pancreatic adenocarcinoma cell line PANC-1and[J]., 2016, 15(1): 141.
[40] Yang T, Wei L L, Ma X,.Columbamine suppresses proliferation and invasion of melanoma cell A375 via HSP90-mediated STAT3 activation [J]., 2021, 41(1): 99-104.
[41] 徐睿, 廖建兴.岩黄连总碱和脱氢阿卟卡维丁对Tca8113中NF-kappa B表达活性的影响 [J].口腔颌面外科杂志, 2010, 20(4): 241-244.
[42] Saeed M E M, Mahmoud N, Sugimoto Y,.Molecular determinants of sensitivity or resistance of cancer cells toward sanguinarine [J]., 2018, 9: 136.
[43] Wang T, Zhao L J, Li P,.Hepatoprotective effects and mechanisms of dehydrocavidine in rats with carbon tetrachloride-induced hepatic fibrosis [J]., 2011, 138(1): 76-84.
[44] 陆世银, 郑华, 程邦, 等.基于组效关系的壮药岩黄连抑制HSC-T6细胞增殖活性成分辨识研究 [J].中草药, 2017, 48(7): 1354-1361.
[45] 梁永红, 贾杰, Spencer P S, 等.岩黄连生物总碱对肝纤维化大鼠TGF-β1及MMP-9的影响 [J].时珍国医国药, 2008, 19(11): 2620-2622.
[46] 肖俐, 曾建国, 刘林, 等.别隐品碱抗肝纤维化作用 [J].中草药, 2011, 42(6): 1158-1163.
[47] Feng G, Zhang J, Liu Y Q.Inhibitory activity of dihydrosanguinarine and dihydrochelerythrine against phytopathogenic fungi [J]., 2011, 25(11): 1082-1089.
[48] Luo N X, Jin L, Yang C Q,.Antifungal activity and potential mechanism of magnoflorine against[J]., 2021, 74(3): 206-214.
[49] Yu H M, Wang Y F, Wang X Q,.Jatrorrhizine suppresses the antimicrobial resistance of methicillin-resistant[J]., 2019, 18(5): 3715-3722.
[50] Chu M, Zhang M B, Liu Y C,.Role of berberine in the treatment of methicillin-resistantinfections [J]., 2016, 6: 24748.
[51] Cai Z Y, Wang C L, Yang W M.Role of berberine in Alzheimer’s disease [J]., 2016, 12: 2509-2520.
[52] Lu J Q, Cao Y Z, Cheng K Y,.Berberine regulates neurite outgrowth through AMPK-dependent pathways by lowering energy status [J]., 2015, 334(2): 194-206.
[53] Chow Y L, Iwata Y, Sato F.Dihydrosanguinarine enhances glucose uptake in mouse 3T3-L1 cells [J]., 2017, 2(10): 6916-6925.
[54] Ding H F, Hu X, Xu X M,.Inhibitory mechanism of two allosteric inhibitors, oleanolic acid and ursolic acid on α-glucosidase [J]., 2018, 107(Pt B): 1844-1855.
[55] Lo S H, Cheng K C, Li Y X,.Development of betulinic acid as an agonist of TGR5 receptor using a newassay [J]., 2016, 10: 2669-2676.
[56] Zhang Y Y, Wang Q Q, Liu R J,.Rapid screening and identification of monoamine oxidase-A inhibitors fromusing enzyme-immobilized magnetic beads based method [J]., 2019, 1592: 1-8.
[57] Sun S Y, Zhou S S, Lei S W,.Jatrorrhizine reduces 5-HT and NE uptake via inhibition of uptake-2 transporters and produces antidepressant-like action in mice [J]., 2019, 49(10): 1237-1243.
[58] Ju L J, Hu P P, Chen P,.Bunting total alkaloids attenuate walker 256-induced bone pain and osteoclastogenesis by suppressing RANKL-induced NF-κB and c-Fos/NFATc1 pathways in rats [J]., 2021, 11: 609119.
[59] Kuai C P, Ju L J, Hu P P,.alkaloids attenuate cisplatin-induced neuropathic pain by reducing loss of IENF and blocking TRPV1 activation [J]., 2020, 48(2): 407-428.
[60] Xue C, Liu S X, Hu J,.Bunting total alkaloids attenuate paclitaxel-induced peripheral neuropathy through PKCε/p38 MAPK/TRPV1 signaling pathway [J]., 2021, 16(1): 58.
[61] 雷瑞瑞, 周栩平, 王新华, 等.基于PLC/IP3通路探讨岩黄连对新生儿高胆红素血症大鼠听觉系统损伤的影响 [J].中草药, 2021, 52(12): 3649-3655.
[62] Yu J, Che J J, Liu L,.Tetrahydropalmatine attenuates irradiation induced lung injuries in rats [J]., 2016, 153: 74-81.
[63] Zhang Y L, Sha R, Wang K G,.Protective effects of tetrahydropalmatine against ketamine-induced learning and memory injury via antioxidative, anti-inflammatory and anti-apoptotic mechanisms in mice [J]., 2018, 17(5): 6873-6880.
[64] Li W F, Wang X M, Zhang H L,.Anti-ulcerogenic effect of cavidine against ethanol-induced acute gastric ulcer in mice and possible underlying mechanism [J]., 2016, 38: 450-459.
[65] Li W F, Zhang H L, Niu X F,.Effects and mechanisms of cavidine protecting mice against LPS-induced endotoxic shock [J]., 2016, 305: 46-54.
[66] Bhakuni D S, Chaturvedi R.The alkaloids of[J]., 1983, 46(4): 466-470.
[67] Choi J S, Kim J H, Ali M Y,.Anti-adipogenic effect of epiberberine is mediated by regulation of the Raf/MEK1/2/ERK1/2 and AMPKα/Akt pathways [J]., 2015, 38(12): 2153-2162.
[68] Yu M, Ren L, Liang F,.Effect of epiberberine fromFranch on inhibition of tumor growth in MKN-45 xenograft mice [J]., 2020, 76: 153216.
[69] Xiao Y, Deng J, Li C,.Epiberberine ameliorated diabetic nephropathy by inactivating the angiotensinogen (Agt) to repress TGFβ/Smad2 pathway [J]., 2021, 83: 153488.
Research progress on chemical constituents and biological activities of
ZHANG Xiao1, LI Bao-hong1, ZHANG Yong-kang1, LIANG Hong-bao1,2, 3, YAO Jing-chun2, 3, LIU Zhong2, QIN Guo-fei2, 3, ZHANG Gui-min1, 2, 3
1.College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2.Shandong New Time Pharmaceutical Co., Ltd., Linyi 276006, China 3.State Key Laboratory of Generic Manufacture Technology of Chinese Traditional Medicine, Lunan Pharmaceutical Group Co., Ltd., Linyi 276006, China
, a traditional folk medicine in Southwest China, is used for treatment of hepatitis B, liver cirrhosis, liver cancer and other liver diseases in clinic, which has great development value.Studies have shown that there are abundant alkaloids, sterides, triterpenoids, flavonoids and nucleosides in, and alkaloids are the main components.Most of the compounds have significant biological activities, such as antiviral, anti-inflammatory, anti-tumor, hepatoprotective, antibacterial, inhibitory activity against acetylcholinesterase, and analgesic activities, etc.It has significant remission effects especially for hepatitis B, liver cancer, liver cirrhosis and other diseases.Research progress on chemical constituents and biological activities ofwere reviewed in this paper, in order to provide the reference for further research and development of.
Bunting; alkaloids; triterpenoids; steroids; antiviral; hepatoprotective activity; antibacterial activity; analgesic activity
R282.710.5
A
0253 - 2670(2022)09 - 2861 - 11
10.7501/j.issn.0253-2670.2022.09.030
2021-11-09
国家重大新药创制专项(2018ZX09201010-005);临沂市自主创新重大专项(2019ZDZX001)
张 晓(1998—),男,硕士研究生,研究方向为天然药物化学成分研究。E-mail: szyzhangxiao@163.com
通信作者:张贵民,男,研究员,博士生导师,研究方向为中药及天然药物研究开发。E-mail: lunanzhangguimin@163.com
秦国飞,男,工程师,研究方向为天然药物新药研发。E-mail: qinguofei@126.com
[责任编辑 崔艳丽]
