不同稳定剂修饰的槲皮素纳米晶在大鼠体内注射药动学及组织分布研究
2022-05-06车智慧李方琴沈成英申宝德袁海龙
胡 菲,车智慧,王 哲,李方琴,闫 巧,沈成英,申宝德,袁海龙*
• 药理与临床•
不同稳定剂修饰的槲皮素纳米晶在大鼠体内注射药动学及组织分布研究
胡 菲1, 2,车智慧2,王 哲2,李方琴1, 2,闫 巧2,沈成英3,申宝德1*,袁海龙2*
1.江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004 2.空军特色医学中心药学部,北京 100142 3.江西省人民医院药学部,江西南昌 330004
以普朗尼克F68(F68)、普朗尼克F127(F127)、甘草酸(glycyrrhizinic acid,GL)、维生素E聚乙二醇琥珀酸酯(TPGS)为稳定剂制备槲皮素纳米晶(quercetin nanocrystals,QT-NCs),探讨不同稳定剂种类对QT-NCs注射药动学及组织分布的影响。采用HPLC法测定大鼠血浆和组织中的槲皮素质量浓度,并用DAS 2.0软件计算其药动学参数,进行比较。药动学结果显示,AUC0~t呈如下顺序:QT-NCs/GL[(464.87±100.51)mg·L/h]>QT-NCs/TPGS[(339.82±73.82)mg·L/h]>QT-NCs/F68[(293.00±44.72)mg·L/h]>QT-NCs/F127[(245.01±28.72)mg·L/h]。组织分布研究结果显示,不同稳定剂修饰的QT-NCs具有不同的组织分布行为,肝脏的AUC0~t顺序与血浆AUC0~t一致。此外,QT-NCs/GL在肝、脾、肺的分布最高(<0.01)。稳定剂种类可以影响QT-NCs的注射药动学及组织分布。
槲皮素;纳米晶;稳定剂;药动学;组织分布
近年来,纳米晶(nanocrystals,NCs)作为克服难溶性药物及天然产物生物利用度低下问题的主要方法之一受到广泛关注。NCs是由少量稳定剂(表面活性剂和/或聚合物)稳定的纯药物结晶纳米粒,平均粒径小于1000 nm,通常为200~500 nm[1]。由于较小的粒径与较大的比表面积,NCs在改善难溶性药物溶出,提高生物利用度方面优势突出[2-4],具有载药量高、毒副作用小、制备工艺简单、应用广泛等优点[5-6]。NCs早期主要用于改善难溶性药物的口服生物利用度[7],目前已拓展至注射、经皮、肺部、眼部等多种给药途径[8],尤其注射给药应用广泛[9-10]。
NCs处方中的稳定剂用量虽然少,但对于维持NCs的物理稳定至关重要。在NCs的制备过程中,稳定剂可吸附在纳米粒表面,通过静电排斥和/或空间位阻作用防止纳米粒的聚集与团聚,从而维持NCs的稳定[11-12]。基于NCs的粒径大小及物理稳定性筛选合适的稳定剂制备难溶性药物纳米晶一直是纳米晶开发与研究的热点之一。然而,一些稳定剂不仅能够维持NCs的稳定,还可以通过与细胞相互作用而影响药物的吸收分布行为[13-16]。具有P-糖蛋白(P-glycoprotein,P-gp)抑制作用的普朗尼克、维生素E聚乙二醇琥珀酸酯(TPGS)和具有较好生物膜黏附作用的羟丙甲纤维素可通过抑制药物的外排或增加药物的肠道滞留而促进药物的吸收[12,17]。本课题组前期研究发现,这些稳定剂对难溶性药物槲皮素纳米晶(quercetin-nanocrystals,QT-NCs)的体外溶出和口服吸收也有影响[18]。
鉴于NCs在注射给药方面的广泛应用,本研究在前期基础上,进一步探索稳定剂种类对QT-NCs注射药动学及组织分布的影响。分别以普朗尼克F68(F68)、普朗尼克F127(F127)、甘草酸(glycyrrhizinic acid,GL)、TPGS为稳定剂制备相同粒径的QT-NCs,SD大鼠尾iv给药后测定血浆和各脏器组织(心、肝、脾、肺、肾)中QT的浓度,研究稳定剂种类对QT-NCs注射药动学及组织分布的影响。
1 仪器与材料
LC-20AD型高效液相色谱仪(含LC-20AD二元梯度泵、DGU-20A3脱气机、SIL-20AC自动进样器、CTO-20AC柱温箱)购自日本岛津公司;Winner 802型纳米激光粒度仪购自济南微纳颗粒仪器股份有限公司;DF-101S型集热式恒温加热磁力搅拌器购自北京恒丰长伟科技有限公司;BT-125D型电子天平购自赛多利斯科学仪器有限公司;TGL-16G型台式离心机购自上海安亭科学仪器厂;VORTEX-5型涡旋混合仪购自其林贝尔仪器公司;高通量组织研磨仪购自上海万柏生物科技有限公司。
槲皮素原料药(批号CY160517,质量分数≥95%)购自陕西慈缘生物技术公司;对照品槲皮素(批号16111201)、山柰酚(批号17092102)购自成都普菲德生物技术公司,质量分数均≥98%;甘草酸(批号190421,质量分数≥95.0%)购自北京世纪奥科生物技术有限公司;F127和F68购自北京凤礼精求商贸有限责任公司;TPGS(批号BCBW9938)购自美国Sigma公司;磷酸购自天津福晨试剂厂;色谱甲醇购自Fisher Chemical公司。
SPF级雄性SD大鼠,体质量(200±20)g,由北京科宇动物养殖中心提供,动物许可证号SCXK(京)2018-0010。动物实验伦理经空军特色医学中心批准,批准号为空特(科研)第2021-75-PJ01。
2 方法与结果
2.1 NCs的制备
采用介质研磨法制备QT-NCs[19-20]。称取槲皮素原料药40 mg及稳定剂(F68、F127、GL、TPGS)8 mg,置于10 mL西林瓶中,加入4 mL蒸馏水,加入搅拌子及4 mL氧化锆珠子,将西林瓶置于磁力搅拌器上,1500 r/min搅拌研磨2 h,取出,滤过去除氧化锆珠子,即得QT-NCs混悬液。
2.2 NCs的粒径结果
按照“2.1”项制备3批样品,取样品适量,加蒸馏水稀释到合适浓度,采用纳米激光粒度仪测定平均粒径及多分散指数(polydispersity index,PDI),采用马尔文激光粒度仪测定Zeta电位,平行测定3次,取其平均值。结果见表1,显示QT-NCs/F127、QT-NCs/GL、QT-NCs/F68和QT-NCs/TPGS粒径均为200 nm,PDI约为0.2。QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS的电位基本一致,QT-NCs/GL电位绝对值相对较高。
表1 QT-NCs的粒径和PDI(, n = 3)
Table 1 Particle size and PDI of QT-NCs (, n = 3)
样品粒径/nmPDIZeta电位/mV QT-NCs/F127201±100.19±0.02−(14.27±0.15) QT-NCs/GL199±120.20±0.02−(25.17±0.45) QT-NCs/F68194±100.20±0.01−(14.43±0.55) QT-NCs/TPGS205±130.20±0.01−(12.23±0.31)
2.3 大鼠体内注射药动学研究
2.3.1 色谱条件 InterSustain C18色谱柱(250 mm×4.6 mm,5 µm),流动相为甲醇-0.1%磷酸水溶液(55∶45);体积流量为1.0 mL/min;柱温为30 ℃;检测波长为375 nm;进样量为20 μL。
2.3.2 对照品及内标溶液的制备 精密称定槲皮素对照品适量,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为1.20 mg/mL的槲皮素对照品储备液,备用。另取山柰酚对照品适量,精密称定,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为488.00 µg/mL的内标储备液,取适量,用甲醇稀释为质量浓度为97.60 µg/mL的内标溶液,备用。
2.3.3 血浆样品的处理[21]取大鼠血浆样品200 μL,置1.5 mL离心管中,依次加入50 μL 97.60 μg/mL的山柰酚内标物溶液、25%盐酸200 μL,涡旋90 s混匀,90 ℃水浴中反应15 min,冷却后加无水乙醇350 μL,涡旋90 s混匀,8000 r/min离心10 min,取上清液20 μL按“2.3.1”项下色谱条件进样分析。
2.3.4 专属性考察 将大鼠空白血浆、空白血浆加适量槲皮素对照品、大鼠给药后血浆样品,参照“2.3.3”项下方法处理(空白血浆内标溶液以同体积甲醇替代),按“2.3.1”项下色谱条件分析,结果显示空白血浆中的内源性物质对槲皮素的测定无干扰,其色谱图见图1。
2.3.5 标准曲线的绘制 取200 μL空白血浆,精密加入不同浓度的槲皮素对照品溶液适量,得到槲皮素质量浓度分别为0.25、1.25、12.50、25.00、50.00、100.00、150.00、300.00 μg/mL的血浆对照品系列溶液,按“2.3.3”项下方法处理后,再按“2.3.1”项下色谱条件进样测定,记录峰面积。以槲皮素质量浓度()为横坐标、槲皮素的峰面积与内标山柰酚的峰面积比值()为纵坐标进行线性回归,得回归方程为=0.043 5-0.024 2(2=0.999 8)。结果,表明槲皮素在0.25~300.00 μg/mL线性关系良好。
2.3.6 检测限与定量限 取质量浓度为1.25 µg/mL的槲皮素血浆对照品溶液,梯度稀释后,按“2.3.3”项下方法处理后,再按“2.3.1”项下色谱条件进样测定,信噪比为10时所能检测到的质量浓度为定量限,信噪比为3时所能检测到的质量浓度为检测限。结果表明,定量限为0.25 μg/mL,检测限为0.12 μg/mL。
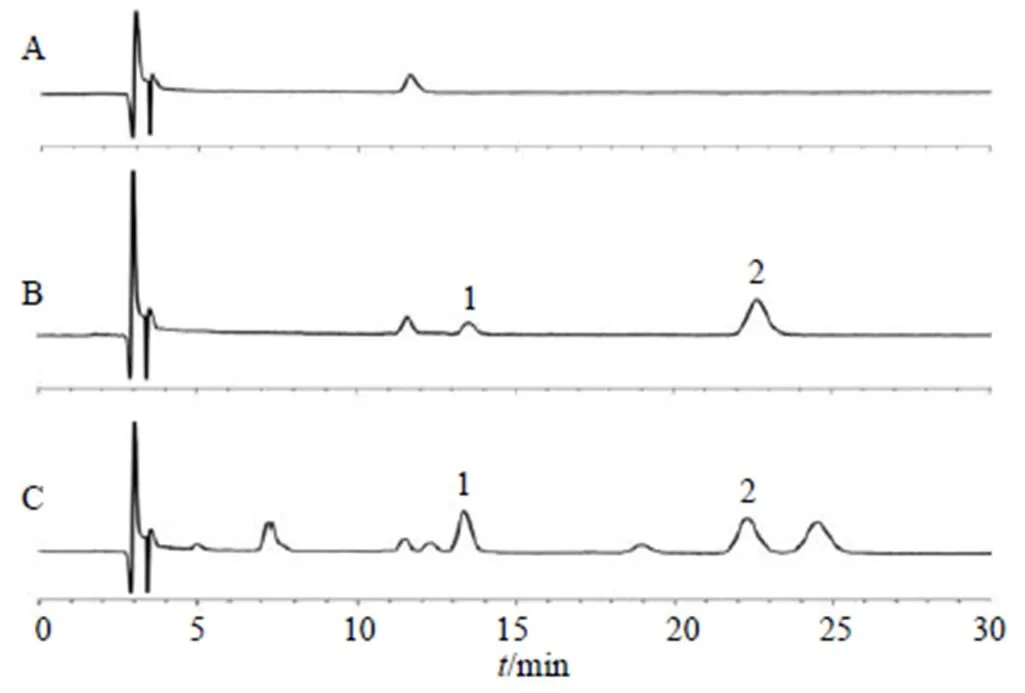
1-槲皮素 2-山柰酚,图3~7同
2.3.7 精密度试验 配制0.75、110.00、225.00 μg/mL的低、中、高质量浓度的血浆样品,按“2.3.3”项下方法处理后,再按“2.3.1”项下色谱条件进样测定,平行测定6次,计算日内精密度,连续测定3 d,计算日间精密度,结果表明日内精密度RSD分别为4.12%、1.19%、1.07%;日间精密度RSD分别为6.88%、1.01%、0.70%。表明精密度良好。
2.3.8 稳定性试验 配制0.75、110.00、225.00 μg/mL的低、中、高质量浓度的血浆样品,在−20 ℃反复冻融3次,按“2.3.3”项下方法处理后,再按“2.3.1”项下色谱条件进样测定,考察其冻融稳定性;将处理后的样品室温放置24 h,按“2.3.1”项下色谱条件进样测定,考察其室温放置稳定性。结果显示低、中、高质量浓度的槲皮素血浆样品反复冻融后的RSD分别为3.69%、1.53%、0.95%;低、中、高质量浓度的槲皮素血浆样品处理后室温放置24 h后的RSD分别为5.75%、1.45%、1.87%,表明血浆样品在反复冻融3次及处理后的生物样品室温放置24 h均稳定。
2.3.9 提取回收率试验 配制0.75、110.00、225.00 μg/mL的低、中、高质量浓度的血浆样品,每个质量浓度平行制备3份,按“2.3.3”项下方法处理后,按“2.3.1”项下色谱条件分析。取与3种质量浓度相同的槲皮素对照品溶液,按“2.3.1”项下色谱条件分析,以槲皮素对照品溶液的峰面积为标准,计算槲皮素在相应质量浓度的血浆样品中的提取回收率。结果表明低、中、高3个质量浓度的血浆样品中槲皮素的平均提取回收率分别为99.49%、95.67%、99.41%,且RSD符合要求。
2.3.10 药动学研究 取雄性SD大鼠24只,分为QT-NCs/F127组、QT-NCs/F68组、QT-NCs/GL组和QT-NCs/TPGS组,每组6只,实验前禁食不禁水12 h。测定载药量[QT-NCs/F127:(86.81±1.02)%;QT-NCs/F68:(93.06±0.30)%;QT-NCs/GL:(91.89±0.60)%;QT-NCs/TPGS:(87.93±0.33)%]后,按照载药量计算给药剂量(100 mg/kg),分别尾椎iv QT-NCs/F127、QT-NCs/F68、QT-NCs/GL和QT-NCs/TPGS,然后分别于给药后0.083、0.250、0.500、1.000、2.000、4.000、6.000、8.000、12.000、24.000 h眼眶取血0.5 mL,置于1.5 mL肝素钠浸润过的离心管内,5000 r/min离心10 min分离血浆,按照“2.3.3”项下方法处理后,再按“2.3.1”项下色谱条件分析,计算槲皮素的血药浓度,绘制药-时曲线,结果见图2;采用DAS 2.0软件计算药动学参数,结果见表2。与QT-NCs/F127组比较,QT-NCs/GL、QT-NCs/F68和QT-NCs/TPGS的AUC0~均显著增加(<0.05、0.01),并呈现如下顺序:QT-NCs/GL>QT-NCs/TPGS>QT-NCs/F68>QT-NCs/F127。此外,QT-NCs/TPGS的AUC0~t、1/2z及max约为QT-NCs/F127的1.39、1.24和1.33倍(<0.05、0.01)。
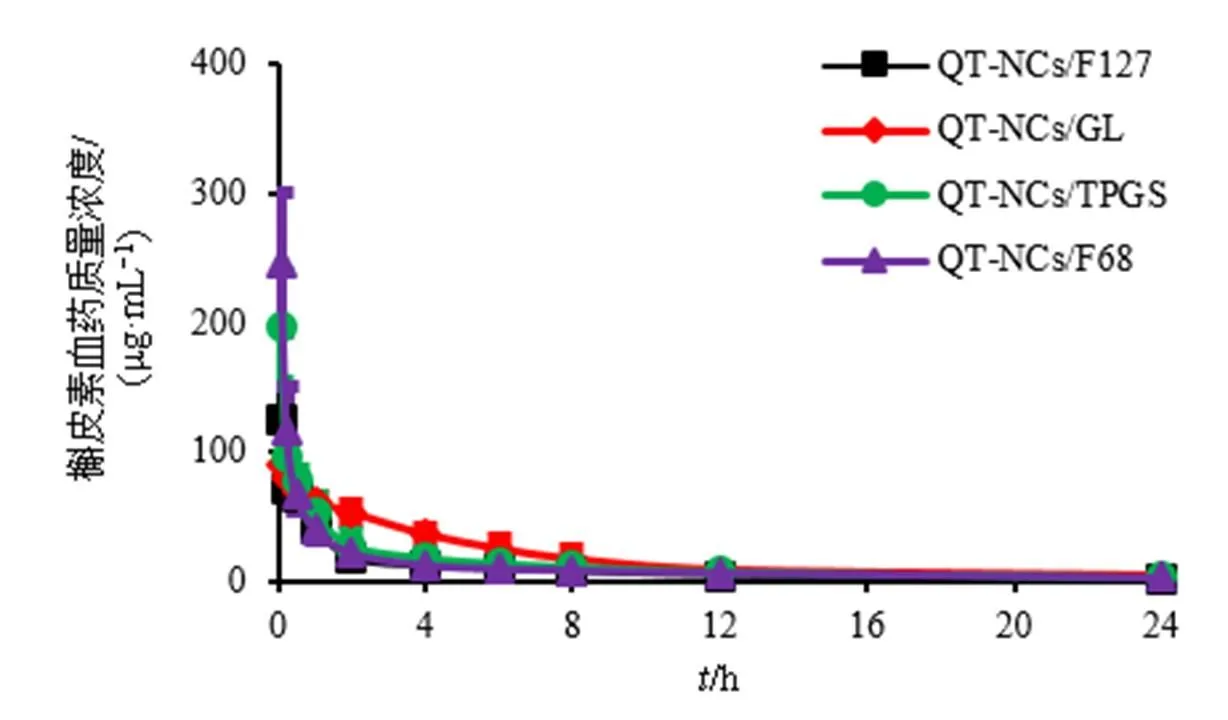
图2 QT-NCs/F127、QT-NCs/GL、QT-NCs/TPGS和QT-NCs/F68的药-时曲线(, n = 6)
表2 QT-NCs/F127、QT-NCs/GL、QT-NCs/TPGS和QT-NCs/F68的主要药动学参数(, n = 6)
Table 2 Main pharmacokinetic parameters of QT-NCs/F127, QT-NCs/GL, QT-NCs/TPGS and QT-NCs/F68 (, n = 6)
组别AUC0~t/(mg·h·L−1)MRT0~t/ht1/2z/hCmax/(mg·L−1) QT-NCs/F127245.01±28.725.89±0.487.73±1.40125.54±19.91 QT-NCs/GL464.87±100.51**6.01±0.696.36±3.4791.59±11.08 QT-NCs/F68293.00±44.72*##6.01±0.9810.70±3.42246.42±55.07**## QT-NCs/TPGS339.82±73.82*#6.04±0.519.55±1.00*197.62±41.29**##
与QT-NCs/F127组比较:*<0.05**<0.01;与QT-NCs/GL组比较:#<0.05##<0.01
*<0.05**<0.01QT-NCs/F127 group;#<0.05##<0.01QT-NCs/GL group
2.4 大鼠体内注射组织分布研究
2.4.1 色谱条件 InterSustain C18色谱柱(250 mm×4.6 mm,5 µm),流动相为甲醇-0.1%磷酸水溶液(56∶44);体积流量为1.0 mL/min;柱温为30 ℃;检测波长为375 nm;进样量为20 μL。
2.4.2 对照品及内标溶液的制备 精密称定槲皮素对照品适量,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为1.34 mg/mL的槲皮素对照品储备液,备用。另取山柰酚对照品适量,精密称定,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为488.00 µg/mL的内标储备液,取适量,用甲醇稀释为质量浓度为48.80 µg/mL的内标溶液,备用。
2.4.3 组织匀浆液的处理[21]取大鼠组织匀浆液200 μL,置1.5 mL离心管中,依次加入50 μL 48.80 μg/mL的山柰酚内标物溶液、25%盐酸200 μL,涡旋90 s混匀,90 ℃水浴中反应15 min,冷却后加无水乙醇350 μL,涡旋90 s混匀,8000 r/min离心10 min,取上清液20 μL,按“2.4.1”项下色谱条件进样分析。
2.4.4 专属性考察 将大鼠空白组织匀浆、空白组织匀浆适量槲皮素对照品、大鼠给药后匀浆样品,参照“2.4.3”项下方法处理(空白血浆内标溶液以同体积甲醇替代),按“2.4.1”项下色谱条件分析,结果显示空白匀浆中的内源性物质对槲皮素的测定无干扰,其色谱图见图3~7。
2.4.5 标准曲线的制备 取200 μL空白组织匀浆,加入不同浓度的槲皮素对照品溶液适量,得到质量浓度为0.33、1.67、16.70、33.40、66.80、133.60 μg/mL的心、肺、肾组织样品标准液以及质量浓度为0.33、1.67、16.70、33.40、66.80、133.60、334.00 μg/mL的肝、脾组织样品标准液,按“2.4.3”项下方法处理后,再按“2.4.1”项下色谱条件进样测定,记录峰面积。以槲皮素质量浓度()为横坐标、槲皮素的峰面积与内标山柰酚的峰面积比值()为纵坐标进行线性回归,求得回归方程。各组织标准曲线方程见表3。取质量浓度为1.67 µg/mL的槲皮素组织样品标准品溶液,梯度稀释后,按“2.4.3”项下方法处理后,再按“2.4.1”项下色谱条件进样测定定量限和检测限,结果见表3。
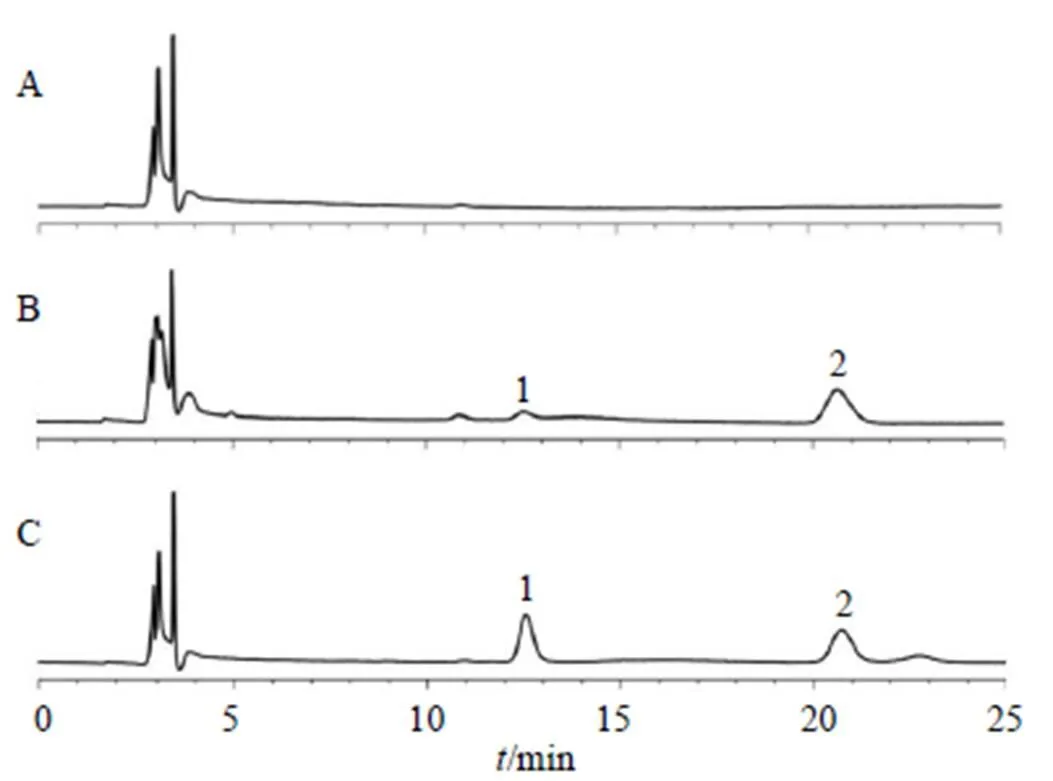
图3 空白心脏(A)、空白心脏+槲皮素对照品 (B) 和含药心脏 (C) 的HPLC色谱图
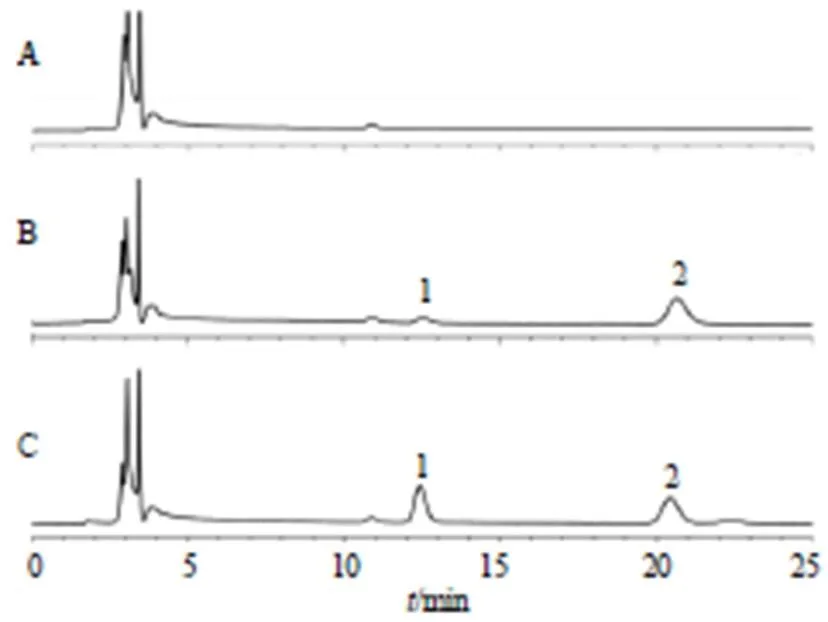
图4 空白肝脏(A)、空白肝脏+槲皮素对照品 (B) 和含药肝脏 (C)的HPLC色谱图
图5 空白脾脏(A)、空白脾脏+槲皮素对照品 (B) 和含药脾脏 (C)的HPLC色谱图
图6 空白肺脏(A)、空白肺脏+槲皮素对照品 (B) 和含药肺脏 (C)的考察HPLC色谱图
图7 空白肾脏(A)、空白肾脏+槲皮素对照品 (B) 和含药肾脏 (C)的HPLC色谱图
2.4.6 精密度试验 配制含1.00、50.00、100.00 μg/mL的低、中、高质量浓度的心、肺、肾组织匀浆样品以及含1.00、125.00、250.00 μg/mL的低、中、高质量浓度的肝、脾组织匀浆样品,按“2.4.3”项下方法处理后,再按“2.4.1”项下色谱条件进样测定,平行测定6次,计算日内精密度,连续测定3 d,计算日间精密度。日内精密度RSD为0.83%~3.63%,日间RSD为0.92%~4.69%,表明精密度良好。
表3 各组织中槲皮素的回归方程及线性范围
Table 3 Regression equation and linear range of quercetin in each tissue
样品回归方程R2线性范围/(μg·mL−1)定量限/(μg·mL−1)检测限/(μg·mL−1) 心Y=0.088 7 X+0.073 70.999 40.33~133.600.330.16 肝Y=0.084 9 X+0.119 10.999 90.33~334.000.330.16 脾Y=0.076 5 X+0.070 50.999 20.33~334.000.330.16 肺Y=0.082 3 X+0.084 50.999 40.33~133.600.330.16 肾Y=0.083 3 X-0.009 50.999 90.33~133.600.330.16
2.4.7 稳定性试验 配制1.00、50.00、100.00 μg/mL的低、中、高质量浓度的心、肺、肾组织匀浆样品以及含1.00、125.00、250.00 μg/mL的低、中、高质量浓度的肝、脾组织匀浆样品,在−20 ℃反复冻融3次,按“2.4.3”项下方法处理后,再按“2.4.1”项下色谱条件进样测定,考察其冻融稳定性;将处理后的样品室温放置24 h,按“2.4.1”项下色谱条件进样测定,考察其室温放置稳定性。结果显示组织匀浆样品反复冻融后的RSD为0.91%~3.78%;处理后室温放置24 h后的RSD为0.88%~5.33%,表明组织样品在反复冻融3次及处理后的生物样品室温放置24 h均稳定。
2.4.8 回收率试验 配制1.00、50.00、100.00 μg/mL的低、中、高质量浓度的心、肺、肾组织匀浆样品以及含1.00、125.00、250.00 μg/mL的低、中、高质量浓度的肝、脾组织匀浆样品,每个质量浓度平行制备3份,按“2.4.3”项下方法处理后,按“2.4.1”项下色谱条件分析。取与上述3种质量浓度相同的槲皮素对照品溶液,按“2.4.1”项下色谱条件分析,以槲皮素对照品溶液的峰面积为标准,计算槲皮素在相应浓度的组织样品中的提取回收率,结果见表4。各组织中槲皮素的提取回收率为85%~105%,RSD为1.31%~3.48%,符合要求。
2.4.9 组织分布研究 取雄性SD大鼠192只,分为QT-NCs/F127组、QT-NCs/F68组、QT-NCs/GL组和QT-NCs/TPGS组,实验前禁食不禁水12 h。按照载药量计算给药剂量(100 mg/kg),分别尾椎iv QT-NCs/F127、QT-NCs/F68、QT-NCs/GL和QT-NCs/TPGS,然后分别于给药后0.083、0.500、1.000、2.000、4.000、8.000、12.000、24.000 h时间点麻醉,依次取心、肝、脾、肺、肾组织置于生理盐水中,洗净,滤纸吸干。放入−20 ℃冰箱中进行冷冻保存,备用。分别称取各组织约0.5 g(不足者取全部组织),按2.0 mL/g加入生理盐水,制成组织匀浆。按照“2.4.3”项下方法处理后,再按“2.4.1”项下色谱条件分析,计算槲皮素的组织质量浓度,绘制药-时曲线,结果见图8;采用DAS 2.0软件计算药动学参数,结果见表5。由图8可知,尾iv QT-NCs/GL、QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS后,QT-NCs/GL在肝、肺中的质量浓度高于QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS。由表5可知,在肝、脾中,与QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS 3组相比,QT-NCs/GL的AUC0~和MRT0~均存在显著差异(<0.01);尤其在肝脏中,4组QT-NCs的AUC0~呈现如下顺序:QT-NCs/GL>QT-NCs/TPGS>QT-NCs/F68>QT-NCs/F127。在肾脏中,与QT-NCs/F127相比,QT-NCs/GL、QT-NCs/TPGS和QT-NCs/F68的AUC0~分别增加1.72、1.34和1.59倍(<0.05)。在肺中,与QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS 3组相比,QT-NCs/GL的AUC0~显著升高(<0.01)。在心脏中,QT-NCs/GL与QT-NCs/F127、QT-NCs/F68、QT-NCs/TPGS的MRT0~均存在显著差异(<0.01)。
表4 各组织中槲皮素的提取回收率
Table 4 Extraction recovery of quercetin in various tissues
样品理论质量浓度/(μg·mL−1)提取回收率/%RSD/% 心1.0096.58±3.113.22 50.0096.86±2.082.14 100.0094.77±1.611.69 肝1.0098.63±2.512.55 125.0095.59±2.913.05 250.0094.92±1.661.75 脾1.0097.61±1.281.31 125.0087.85±1.321.50 250.0089.08±1.391.56 肺1.0095.95±2.742.86 50.0094.68±2.042.15 100.0087.34±1.591.82 肾1.0089.87±1.501.67 50.0088.45±2.022.28 100.0090.95±3.163.48
3 讨论
本课题组前期已经研究了不同稳定剂对QT-NCs体外溶出及口服吸收的影响[18]。本研究在前期研究的基础上,进一步探讨不同稳定剂修饰的QT-NCs在大鼠体内注射药动学及组织分布的影响。结果显示,不同稳定剂修饰的QT-NCs药动学及组织分布存在显著差异,血浆及肝脏中的AUC0~t呈现如下顺序:QT-NCs/GL>QT-NCs/TPGS>QT-NCs/F68>QT-NCs/F127,表明稳定剂种类会影响QT-NCs的注射药动学及组织分布。各给药组均以肝脏中药物分布最高,表明QT-NCs具有一定的被动肝靶向能力,而不同稳定剂修饰的QT-NCs在同一脏器中的分布不一致,则主要是因为QT-NCs注射后能以整体粒子形式分布至各个脏器[21],而纳米粒表面修饰的不同稳定剂具有不同的生理活性[12],可能会影响脏器细胞对槲皮素的摄取及外排,进而影响槲皮素的分布。
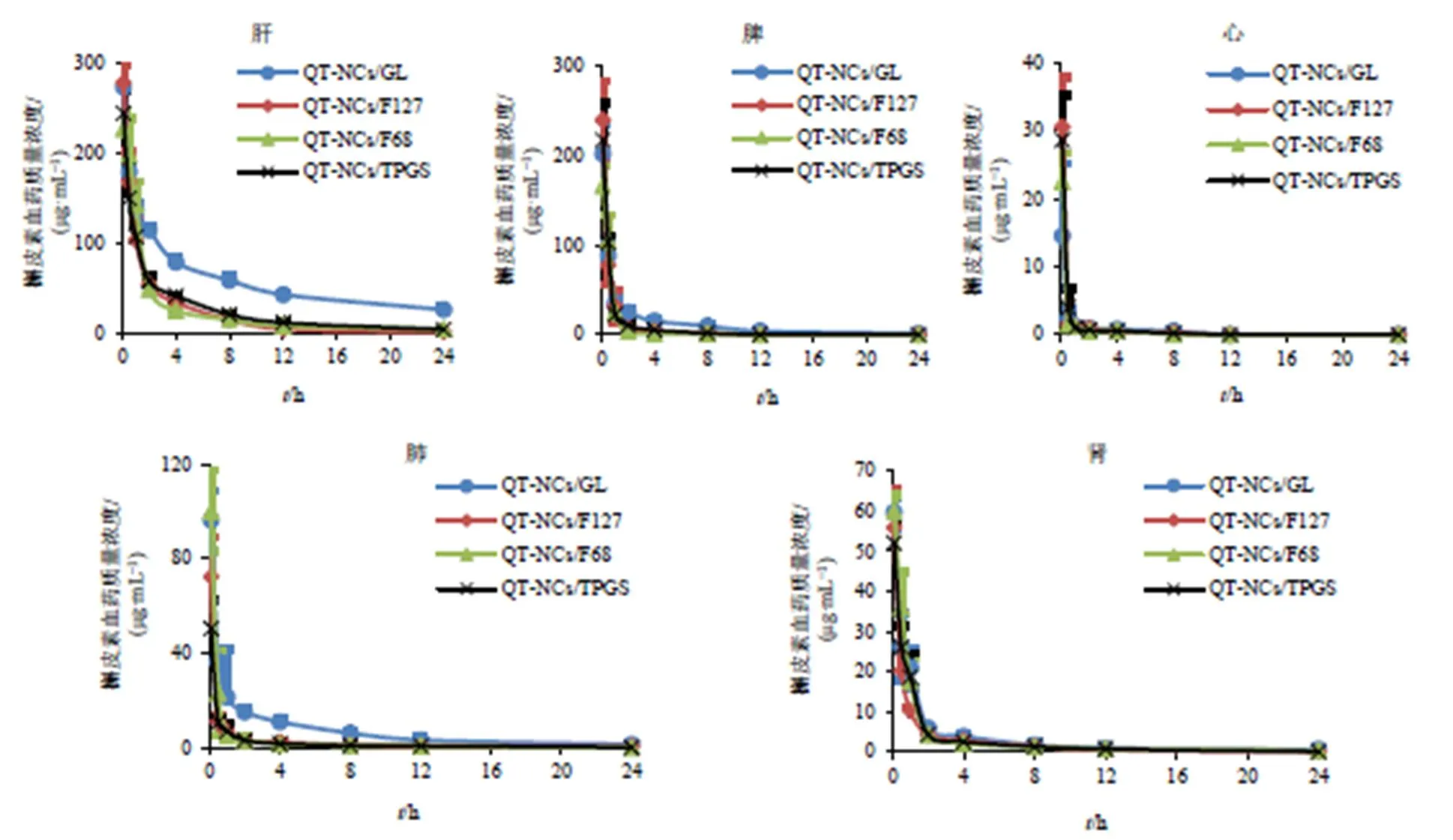
图8 QT-NCs/GL、QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS在肝、脾、心、肺、肾的药-时曲线(, n = 6)
表5 QT-NCs/GL、QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS在各组织的主要药动学参数(, n = 6)
Table 5 Main pharmacokinetic parameters of QT-NCs/GL, QT-NCs/F127, QT-NCs/F68 and QT-NCs/TPGS in each organization (, n = 6)
组织组别AUC0~t/(mg·h·L−1)MRT0~t/ht1/2z/hCmax/(mg·L−1) 肝QT-NCs/GL1 400.10±70.837.93±0.189.51±3.25273.08±24.69 QT-NCs/F127519.21±55.00**3.41±0.45**3.48±0.70*277.89±21.40 QT-NCs/F68559.67±30.25**4.42±0.33**6.55±3.01231.84±17.96*▲ QT-NCs/TPGS627.16±43.83**▲★4.93±0.08**▲▲★5.19±0.79*▲243.70±25.68 脾QT-NCs/GL286.45±11.384.06±0.365.02±0.65202.70±34.58 QT-NCs/F127154.37±26.75**0.86±0.07**2.23±0.69**239.80±43.81 QT-NCs/F68127.69±16.62**0.64±0.07**▲▲0.58±0.06**▲▲166.19±22.79▲ QT-NCs/TPGS164.44±15.94**★0.99±0.04**▲★★1.69±0.60**★217.39±41.18 肾QT-NCs/GL82.26±13.723.61±0.955.31±2.2259.73±3.83 QT-NCs/F12753.16±5.77*1.97±0.08*2.56±1.1255.88±9.42 QT-NCs/F6870.43±8.68▲2.55±0.875.60±2.4259.99±4.07 QT-NCs/TPGS61.59±6.93*2.00±0.25**3.95±0.7352.06±5.53 肺QT-NCs/GL173.73±15.885.10±0.596.31±0.6296.49±12.17 QT-NCs/F12752.03±7.18**3.57±0.49**9.94±7.5872.39±16.90 QT-NCs/F6857.67±15.21**1.36±0.34**▲▲4.00±0.98**100.13±17.28 QT-NCs/TPGS38.72±6.29**▲2.08±0.25**▲▲★3.76±1.79**50.52±11.85**★★ 心QT-NCs/GL10.97±3.622.12±0.535.59±3.8114.51±10.61 QT-NCs/F12712.85±3.960.88±0.40**3.38±2.6030.53±7.30* QT-NCs/F689.28±1.500.59±0.07**1.36±0.6322.52±4.19 QT-NCs/TPGS13.48±2.85★0.88±0.48**2.29±1.8728.61±6.65
与QT-NCs/GL组比较:P<0.05 P<0.01;与QT-NCs/F127组比较:P<0.05 P<0.01;与QT-NCs/F68组比较:★<0.05★★<0.01
*< 0.05**< 0.01QT-NCs/GL group;P< 0.05 P< 0.01QT-NCs/F127 group;★< 0.05★★< 0.01QT-NCs/F68 group
不同稳定剂修饰的QT-NCs中,以QT-NCs/GL组肝脏的药物浓度最高,提示GL修饰的NCs具有一定的主动肝靶向能力,可用于开发肝靶向纳米晶;这主要是因为肝脏细胞表面有GL的特异性结合位点[22],能够增强肝脏细胞对QT-NCs/GL的摄取。此外,GL能够增强P-gp活性,QT-NCs被肝脏摄取后由于P-gp活性的增强而增加槲皮素的外排入血,导致其较高的血药浓度。文献报道[12,17],TPGS、F68、F127均能够抑制P-gp活性,3种稳定剂修饰的QT-NCs表现出不同的药动学及组织分布行为,可能是因为它们对P-gp抑制作用不同,且F68修饰的NCs具有一定的长循环作用[23]。
综上所述,本研究对QT-NCs/GL、QT-NCs/F127、QT-NCs/F68和QT-NCs/TPGS 4种QT-NCs进行了大鼠体内注射药动学及组织分布研究,结果表明,不同稳定剂对于靶向组织分布能产生影响,表明稳定剂种类能影响QT-NCs注射药动学及组织分布。后续可进一步研究不同稳定剂修饰的QT-NCs与脏器细胞的相互作用,以阐明导致其注射药动学及组织分布差异的原因。同时,根据不同稳定剂修饰的QT-NCs的组织分布特点,开发靶向制剂。此外,未来还可以研究更多稳定剂对不同难溶性药物NCs体内行为的影响,以探索稳定剂种类对难溶性药物NCs体内行为影响的规律,为NCs靶向制剂的开发奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Shen B D, Wu N, Shen C Y,.Hyperoside nanocrystals for HBV treatment: Process optimization,andevaluation [J]., 2016, 42(11): 1772-1781.
[2] Goel S, Sachdeva M, Agarwal V.Nanosuspension technology: Recent patents on drug delivery and their characterizations [J]., 2019, 13(2): 91-104.
[3] Jacob S, Nair A B, Shah J.Emerging role of nanosuspensions in drug delivery systems [J]., 2020, 24: 3.
[4] 申宝德, 沈成英, 徐玲霞, 等.难溶性中药纳米混悬剂的体内外行为研究进展 [J].中国中药杂志, 2018, 43(19): 3828-3833.
[5] Qiu L, Zhao X H, Zu Y G,.Ursolic acid nanoparticles for oral delivery prepared by emulsion solvent evaporation method: Characterization,evaluation of radical scavenging activity and bioavailability [J]., 2019, 47(1): 610-621.
[6] Wang Y C, Zheng Y, Zhang L,.Stability of nanosuspensions in drug delivery [J]., 2013, 172(3): 1126-1141.
[7] Gao L, Liu G Y, Ma J L,.Application of drug nanocrystal technologies on oral drug delivery of poorly soluble drugs [J]., 2013, 30(2): 307-324.
[8] Mohammad I S, Hu H Y, Yin L F,.Drug nanocrystals: Fabrication methods and promising therapeutic applications [J]., 2019, 562: 187-202.
[9] Patel D, Zode S S, Bansal A K.Formulation aspects of intravenous nanosuspensions [J]., 2020, 586: 119555.
[10] Ahire E, Thakkar S, Darshanwad M,.Parenteral nanosuspensions: A brief review from solubility enhancement to more novel and specific applications [J]., 2018, 8(5): 733-755.
[11] Yang H, Kim H, Jung S,.Pharmaceutical strategies for stabilizing drug nanocrystals [J]., 2018, 24(21): 2362-2374.
[12] Tuomela A, Hirvonen J, Peltonen L.Stabilizing agents for drug nanocrystals: Effect on bioavailability [J]., 2016, 8(2): 16.
[13] Liu Q Y, Guan J, Sun Z,.Influence of stabilizer type and concentration on the lung deposition and retention of resveratrol nanosuspension-in-microparticles [J]., 2019, 569: 118562.
[14] Liu Y, Ma Y Q, Xu J N,.Apolipoproteins adsorption and brain-targeting evaluation of baicalin nanocrystals modified by combination of Tween 80 and TPGS [J]., 2017, 160: 619-627.
[15] Hong C, Dang Y, Lin G B,.Effects of stabilizing agents on the development of myricetin nanosuspension and its characterization: Anandevaluation [J]., 2014, 477(1/2): 251-260.
[16] Gao W, Chen Y, Thompson D H,.Impact of surfactant treatment of paclitaxel nanocrystals on biodistribution and tumor accumulation in tumor-bearing mice [J]., 2016, 237: 168-176.
[17] Fu Q, Li B, Zhang D,.Comparative studies of thedissolution andpharmacokinetics for different formulation strategies (solid dispersion, micronization, and nanocrystals) for poorly water-soluble drugs: A case study for lacidipine [J]., 2015, 132: 171-176.
[18] 胡菲, 沈成英, 申宝德, 等.不同稳定剂对槲皮素纳米晶体外溶出及大鼠体内口服药动学的影响 [J].中草药, 2021, 52(21): 6485-6492.
[19] 申宝德, 连王权, 沈成英, 等.微型化介质研磨法制备难溶性黄酮类化合物纳米混悬剂 [J].中草药, 2017, 48(21): 4413-4418.
[20] 刘肖, 刘娟, 庞建云, 等.微型化介质研磨法制备槲皮素纳米混悬剂[J].中国中药杂志, 2017, 42(15): 2984-2988.
[21] Shen B D, Shen C Y, Zhu W F,.The contribution of absorption of integral nanocrystals to enhancement of oral bioavailability of quercetin [J]., 2021, 11(4): 978-988.
[22] Ishida S, Sakiya Y, Taira Z.Disposition of glycyrrhizin in the perfused liver of rats [J]., 1994, 17(7): 960-969.
[23] Wang T, Qi J P, Ding N,.Tracking translocation of self-discriminating curcumin hybrid nanocrystals following intravenous delivery [J]., 2018, 546: 10-19.
Pharmacokinetics and tissue distribution of quercetin nanocrystals modified with different stabilizers following intravenous delivery in rats
HU Fei1, 2, CHE Zhi-hui2, WANG Zhe2, LI Fang-qin1, 2, YAN Qiao2, SHEN Cheng-ying3, SHEN Bao-de1, YUAN Hai-long2
1.Key Laboratory of Modern Chinese Medicine Preparation of Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2.Department of Pharmacy, Air Force Medical Center, PLA, Beijing 100142, China 3.Department of Pharmacy, Jiangxi Provincial People’s Hospital, Nanchang 330004, China
To prepare quercetin nanocrystals (QT-NCs) with pluronic F68 (F68), pluronic F127 (F127), glycyrrhizic acid (GL), vitamin E polyethylene glycol succinate (TPGS) as stabilizers and explore the effects of stabilizers on pharmacokinetics and tissue distribution following intravenous delivery.High performance liquid chromatography (HPLC) was used to determine the concentration of quercetin in plasma and tissues of rats, and DAS 2.0 software was used to calculate its pharmacokinetic parameters for comparison.The pharmacokinetic results showed that AUC0~tof QT-NCs was in the following order: QT-NCs/GL [(464.87 ± 100.51) mg·L/h] > QT-NCs/TPGS [(339.82 ± 73.82) mg·L/h] > QT-NCs/F68 [293.00 ± 44.72] mg·L/h] > QT-NCs/F127 [(245.01 ± 28.72) mg·L/h).AUC0~tof QT-NCs in liver showed similar order to that of plasma.Furthermore, the distribution of QT-NCs/GL in liver, spleen and lung were the highest (< 0.01).The stabilizers’ types can influence the pharmacokinetics and tissue distribution of QT-NCs following intravenous delivery.
quercetin; nanocrystals; stabilizers; pharmacokinetics; tissue distribution
R285.61
A
0253 - 2670(2022)09 - 2697 - 09
10.7501/j.issn.0253-2670.2022.09.012
2021-11-29
国家自然科学基金资助项目(81803741);国家自然科学基金资助项目(81873092);江西中医药大学博士科研启动基金资助项目(2021BSZR025)
胡 菲(1997—),女,硕士研究生,研究方向为中药新型给药系统研究。Tel: 17779140130 E-mail: 1256719791@qq.com
通信作者:申宝德,博士,研究方向为中药制剂新技术与新剂型研究。E-mail: shenbaode@163.com
袁海龙,研究员,博士生导师,研究方向为中药新型给药系统研究。Tel: (010)66928505 E-mail: yhlpharm@126.com
[责任编辑 李亚楠]
