不同浓度 EDTA 对产 ESBL多重耐药大肠埃希菌抗菌药物敏感性的恢复作用
2022-05-05温庆辉黎凤英李燕嫦黄金印王凤平
温庆辉, 黎凤英, 李燕嫦, 黄金印, 王凤平
(1. 东莞市人民医院检验科,广东 东莞 523059;2. 东莞谢岗医院检验科;广东 东莞 523059)
近年来,由于抗菌药物的广泛使用,临床耐药菌株的分离率越来越高。大肠埃希菌是临床医院感染分离率较高的菌种,也是产超广谱β-内酰胺酶(extended-spectrum beta-lactamase,ESBL)细菌的代表菌种。产ESBL的多重耐药大肠埃希菌对青霉素类、氨基糖苷类、磺胺类及头孢菌素类抗菌药物的耐药率均较高,甚至β-内酰胺酶抑制剂的复方药物在其耐药性方面也没有明显优势,对于临床治疗而言,这是一个巨大的挑战[1]。ESBL易与其他耐药基因融合,使细菌产生多重耐药性,因此大肠埃希菌在肺部感染、泌尿系感染、血流感染等患者抗感染治疗时,常产生多重耐药性,可能延误治疗最佳时机,造成严重的后果[2]。因此,寻找对产ESBL的多重耐药大肠埃希菌有效的抑菌、杀菌措施,成为临床上亟待解决的问题之一。乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)可与许多阳离子结合成复合物,被广泛用于稳定剂和螯合剂中。除此之处,EDTA还能够通过限制生长必需的阳离子来破坏细菌细胞膜中的二价配合物,起到抑菌作用。目前,大部分关于EDTA的研究主要集中在其作为抗菌剂防止致病菌污染等方面,且均为高浓度的EDTA,是通过抑制细菌生长来抑制生物被膜的形成,或通过EDTA螯合特性产生的杀菌效果来清除成熟的生物被膜,关于EDTA与多重耐药大肠埃希菌抗菌药物敏感性恢复作用的研究较少。本研究拟通过分析不同浓度EDTA联合抗产ESBL多重耐药大肠埃希菌药物的最小抑菌浓度(minimum inhibitory concentration,MIC),探讨不同浓度EDTA对产ESBL多重耐药大肠埃希菌抗菌药物敏感性的恢复作用,为临床用药提供参考。
1 材料和方法
1.1 菌株来源
收集2018年6月—2020年1月东莞市人民医院临床细菌感染患者送检的中段尿、血液等各类临床样本中分离得到的240株产ESBL多重耐药大肠埃希菌。质控菌株大肠埃希菌(ATCC 25922)购自国家卫生健康委临床检验中心。
1.2 方法
1.2.1 EDTA稀释 用去离子水将EDTA(批号890201D,上海试剂总厂)分别稀释为低浓度(0.5 mg/mL)、标准浓度(1.0 mg/mL)与高浓度(2.0 mg/mL),37 ℃保存。抗菌药物头孢哌酮、左氧氟沙星等均购自英国Oxoid公司。
1.2.2 菌株鉴定 严格按照第4版《全国临床检验操作规程》要求分离、培养细菌,采用法国生物梅里埃公司VITEK 2 Compact自动化鉴定药敏仪进行细菌鉴定。
1.2.3 体外药物敏感性试验 采用纸片扩散法进行体外药物敏感性试验,严格按美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M100文件[3]要求判读结果。
1.2.4 ESBL检测 采用双纸片扩散确证法[3]检测ESBL,药物敏感性平板和菌液的制备与常规药物敏感性试验相同,将菌液涂于M-H琼脂平板(上海沪宇生物科技有限公司)上,贴上药敏纸片,1张为三代头孢菌素,1张为含有β-内酰胺酶抑制剂(克拉维酸10 mL)的纸片,2张纸片中心对中心相距为25~30 mm,35 ℃保存,24 h后观察结果,显示协同则表示为阳性,相反则为阴性。
1.2.5 MIC测定 在分离出的240株产ESBL多重耐药大肠埃希菌中随机选取80株,采用琼脂平皿二倍稀释法[4],分阴性组、药物组和药物+EDTA组(平皿中加入2 mmol/L EDTA 1 mL),每组加入106CFU/mL产ESBL大肠埃希菌临床分离株菌悬液[挑取琼脂平板培养基上培养24 h的临床分离菌株,用无菌0.9%氯化钠溶液调制成0.5个麦氏单位比浊度的菌悬液(约1.5×108CFU/mL),再用无菌0.9%氯化钠溶液10倍稀释],加入已含有高、中、低3个浓度EDTA和抗菌药物的MH琼脂平皿中,37 ℃培养16~24 h后观察结果,以没有细菌生长的抗菌药物稀释最小浓度的平皿为被测抗菌药物的MIC。比较EDTA低浓度组(0.5 mg/mL)、标准浓度组(1 mg/mL)和高浓度组(2 mg/mL)多种抗菌药物的MIC。
1.2.6 观察指标 分析检出产ESBL多重耐药大肠埃希菌样本类型的分布情况;产ESBL多重耐药大肠埃希菌对抗菌药物的耐药情况和敏感情况;比较药物组与药物+EDTA组MIC的变化;比较不同浓度EDTA对抗菌药物MIC的影响。
1.3 统计学方法
采用WHONET 5.6软件进行统计分析。
2 结果
2.1 产ESBL多重耐药大肠埃希菌样本类型分布
共分离出240株产ESBL多重耐药大肠埃希菌,其中中段尿样本分离率最高,为47.92%(115株),其次为血液样本(38株,15.83%)。见表1。
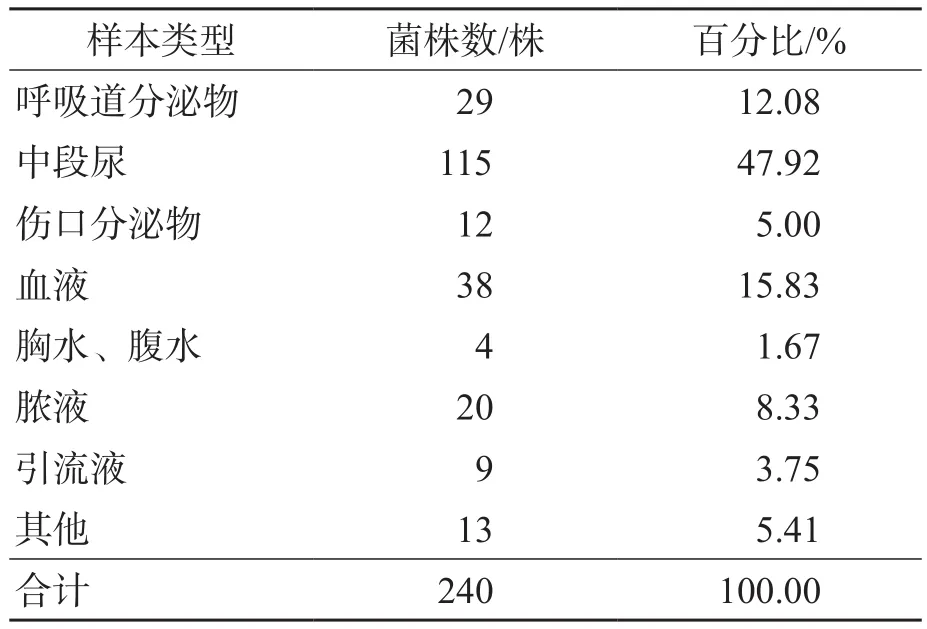
表1 产ESBL多重耐药大肠埃希菌样本类型分布
2.2 产ESBL多重耐药大肠埃希菌对常用抗菌药物的耐药和敏感情况
240株产ESBL多重耐药大肠埃希菌对头孢哌酮、阿米卡星的敏感性较高(>90%),对头孢噻肟的耐药率为100%,对头孢吡肟、氨曲南、妥布霉素的耐药率>50%,见表2。
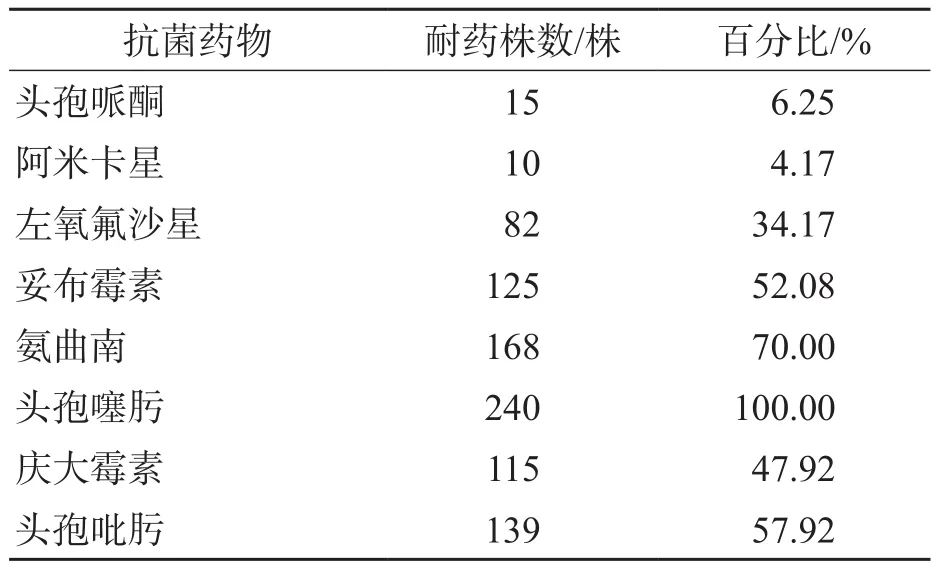
表2 产ESBL多重耐药大肠埃希菌对常用抗菌药物的耐药性
2.3 药物组和药物+EDTA组产ESBL多重耐药大肠埃希菌MIC
药物组与药物+EDTA组MIC差异较大,其中头孢哌酮、左氧氟沙星、头孢吡肟的MIC差异最明显,其次是阿米卡星、妥布霉素、庆大霉素,氨曲南变化较小,头孢噻肟无变化。见表3。

表3 药物组和药物+EDTA组产ESBL大肠埃希菌的MIC mg/L
2.4 不同浓度EDTA组产ESBL多重耐药大肠埃希菌抗菌药物MIC测定结果
抗菌药物联合标准浓度和高浓度EDTA时,MIC变化比联合低浓度EDTA时更为显著,但联合标准浓度与高浓度EDTA的MIC无差异。头孢噻肟MIC在3个浓度EDTA组中均无变化。见表4。

表4 不同浓度EDTA组产ESBL多重耐药大肠埃希菌的MIC mg/L
3 讨论
大肠埃希菌作为产ESBL的代表菌种,其多重耐药与细菌外排泵功能增强、膜通透性下降有关。此外,生物被膜的形成使大肠埃希菌对多种抗菌药物产生抵抗力。细菌形成生物膜往往会导致抗菌药物治疗失败。EDTA是一种重要的螯合剂,用途广泛,不仅可以作为洗涤剂,也是螯合剂的代表性物质,能和碱金属等形成稳定的水溶性络合物[5],更可以作为血液抗凝剂[6]用于临床。
本研究共分离出240株产ESBL多重耐药大肠埃希菌,其中尿液样本分离率最高,其次为血液样本和呼吸道分泌物,与展冠军等[7]的研究结果基本一致。有研究发现,EDTA对革兰阳性菌和革兰阴性菌均有抑菌活性[8];HAMOUD等[9]指出抗菌肽与EDTA联用可导致铜绿假单胞菌成熟生物膜生成量显著下降;MAISETTA等[10]证实了EDTA的协同抗菌作用,发现EDTA可显著降低铜绿假单胞菌对所有抗菌药物的MIC。本研究中,药物组和药物+EDTA组头孢哌酮、左氧氟沙星、头孢吡肟的MIC差异最明显,其次是阿米卡星、妥布霉素、庆大霉素。氨曲南MIC变化较小,头孢噻肟无变化,与相关研究结果[11]一致。
本研究结果显示,当抗菌药联合标准浓度及高浓度EDTA时,其抗菌药物MIC变化比联合低浓度EDTA时更为显著,但联合标准浓度与高浓度EDTA的MIC无差异;3个EDTA浓度组中头孢噻肟的MIC均无变化。有研究发现,联合使用EDTA后,环丙沙星、庆大霉素、氨苄西林的MIC分别由0.125、0.5、128 μg/mL降至分别由0.004、0.25、4 μg/mL[12-14]。EDTA主要通过破坏生物膜结构,显著降低生物膜胞外多糖和活菌比例,显著降低生物膜厚度、平均扩散距离和结构熵[15]。郭志华等[16]发现,低浓度EDTA同样能影响细菌生物被膜的形成,但并不是随着EDTA浓度的增长呈相关变化,高浓度EDTA与低浓度EDTA相比,并未增加细菌对抗菌药物的敏感性,与本研究结论一致。
综上所述,不同浓度的EDTA对多数被测菌株均有显著的协同抗菌作用,能明显降低细菌对抗菌药物的敏感性,具有重要的临床意义。其优点在于,一方面可以减少药物过量导致的耐药性增高的现象,另一方面可以通过MIC来确定最佳药物剂量,缩短用药时间,从而减轻多重耐药菌感染患者的负担。
