微波辐射预处理菌源对生物暗发酵制氢的影响
2022-05-05张靖楠昌行行张嘉祺何培新张志平宋丽丽杨旭魏涛
张靖楠,昌行行,张嘉祺,何培新,张志平,宋丽丽,杨旭,魏涛
郑州轻工业大学 食品与生物工程学院,河南 郑州 450001
0 引言
随着全球工业化的发展,环境污染和能源危机已成为制约社会发展的重要因素。氢能作为一种高效、清洁的可再生能源,在社会生产实践中的应用范围不断扩展,是未来重要的新能源物质[1]。暗发酵制氢是指微生物利用氢酶的催化作用降解有机物产生H2,同时生成挥发性脂肪酸(VFAs)、醇类等代谢产物[2]。与其他制氢方法相比,暗发酵制氢具有产H2速率高、工艺简单、底物利用范围广等优势[3]。目前,暗发酵制氢通常采用堆肥、污泥[4-5]、牧畜粪便[6-7]等作为发酵菌源。这些天然混合菌源中不仅含有严格厌氧的梭状芽孢杆菌属(Clostridium)、兼性厌氧的埃希氏菌属(Escherichia)、肠杆菌属(Enterobacter)[8]等产氢菌,同时也存在产甲烷菌[9]、产乙酸菌[10]等耗氢菌。耗氢微生物的存在势必会对暗发酵制氢产生负面影响。为了获得高效的产氢菌,同时抑制或杀灭耗氢菌,在暗发酵制氢前通常需要对菌源进行预处理。目前常用的菌源预处理方式主要包括酸、碱[11-12]、化学抑制剂[13]、水热[14]、超声波[15-16]等,这些预处理方法普遍存在操作复杂、处理时间长、能耗高等缺点。因此,有必要寻求新的安全高效、操作简便的菌源预处理方法。
微波是指波长为1 mm~1 m,频率为300 MHz~3000 GHz的电磁波[17]。微波辐射作为一种节能高效的热能技术,具有加热效率高、过程易控、环境友好等特点[18],被广泛用于生物质酶解产糖、食品加工、环境污染治理等诸多领域[19-20]。马欢等[21]采用微波辐射技术对水稻秸秆进行预处理,发现微波辐射可以破坏水稻秸秆表面特殊的“角质-双硅层”结构和木质素-半纤维素复合体,提高纤维素酶的酶解效果。微波辐射还可以通过热效应和非热效应破坏微生物菌体[22],抑制和杀灭不耐受高温的微生物菌体。目前,微波辐射及微波辅助酸或碱预处理工农业有机废物暗发酵制氢的研究多侧重于预处理工艺优化或对有机废物结构变化的影响[23-26],鲜见微波辐射预处理引起菌源微生物群落结构变化进而影响暗发酵制氢的研究。
本文以牛粪堆肥为天然菌源、葡萄糖为发酵底物,拟考查微波辐射预处理对生物暗发酵制氢性能的影响,采用Illumina NovaSeq高通量测序技术对微波辐射预处理前后菌源的菌群结构进行解析,以期揭示微波辐射预处理引起的微生物群落结构变化影响暗发酵制氢的机制,为构建稳定、高效的暗发酵制氢体系提供一定的理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
牛粪堆肥(含水率40%左右),取自郑州市新郑奶牛场;葡萄糖及其他常用化学试剂,均为分析纯,国药集团化学试剂有限公司产。
1.2 培养基
种子发酵培养基(600 mL):葡萄糖6.0 g,L-半胱氨酸0.3 g,蛋白胨2.4 g,NaCl 1.8 g,FeSO4·7H2O 0.06 g,KH2PO40.6 g,K2HPO40.6 g,MgCl20.06 g,pH值为7.0。
发酵产氢培养基(50 mL):葡萄糖0.5 g,L-半胱氨酸0.025 g,KH2PO40.05 g,NH4HCO30.05 g,去离子水45 mL,种子液5 mL,营养液0.3 mL,调节pH值为 6.5。
营养液(1 L):FeCl20.002 78 g,NaCl 0.01 g,MgSO4·7H2O 0.1 g,CaCl2·2H2O 0.01 g,Na2MO4·2H2O 0.01 g,MnSO4·7H2O 0.015 g。
1.3 主要仪器与设备
M1-L213B型微波炉,美的集团股份有限公司产;THZ-82B型气浴恒温振荡器,江苏金怡仪器科技有限公司产;Aglient-7890B型气相色谱仪、Aglient-7820A型气相色谱仪,美国安捷伦科技有限公司产;D2012plus型离心机,大龙兴创实验仪器股份公司产;SHC-A型H2发生器、QLB-A型纯净空气泵,北京创杰新世纪科技发展有限公司产。
1.4 实验方法
1.4.1 菌源预处理在前期研究的基础上,将牛粪堆肥与去离子水按照料液比1∶2.2(g/mL)混合,微波辐射5 min后,用筛网过滤收集菌液。未微波辐射处理的菌源作为对照组。
1.4.2 种子预培养将1.4.1中所得菌液放入装有种子发酵培养基的血清瓶中,充N2营造厌氧环境,封盖后放入摇床,设置摇床转速160 r/min,温度(35±1) ℃进行种子预培养。
1.4.3 暗发酵产气实验采用10%接种量将培养至对数期的种子液移取至含有葡萄糖的发酵产氢培养基中,调节发酵体系初始pH值为6.5,充入高纯N2除去培养基中的O2,封盖后放入摇床,设置摇床转速160 r/min,温度(35±1) ℃进行发酵产气实验,定期取样分析气体成分和液相代谢产物。
1.5 分析方法
1.5.1 气相产物分析采用定时排饱和食盐水法测量发酵瓶内的气体体积。采用气相色谱仪(Aglient-7890B)测定气相产物(H2,CH4,CO2)含量,检测条件如下:色谱仪安装热导池检测器(TCD),色谱柱为6英尺Porapak Q不锈钢填充柱,高纯N2为载气(30 mL/min),TCD检测温度为150 ℃,柱温为50 ℃,手动进样,进样量为400 μL,进样口温度为150 ℃[27]。
1.5.2 液相代谢产物分析采用气相色谱仪(Aglient-7820A) 测定液相代谢产物,检测条件如下:色谱仪安装氢火焰检测器(FID),FID检测温度为280 ℃,色谱柱为HP-5毛细管柱(30 m×0.32 mm×0.25 μm),高纯N2为载气(30 mL/min),升温过程为35 ℃保持1 min,以5 ℃/min升至100 ℃并保持2 min;SHC-A型H2发生器的H2流量为40 mL/min;QLB-A型纯净空气泵的空气流量为400 mL/min;自动进样,进样量为0.5 μL,进样口温度为220 ℃;分流比为10∶1。进样前,将发酵液抽滤后加入浓度为6 mol/L的HCl进行酸化,再用高速离心机于8000 r/min条件下离心10 min,取1.5 mL上清液,用0.45 μm滤膜过滤后进行测定[27]。
1.5.3 菌群结构分析采用Illumina NovaSeq高通量测序技术对细菌16S rDNA V3-V4 区和古生菌16S rDNA进行测序。细菌V3-V4区引物为:357F(5′-ACTCCTACGGRAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。古生菌引物为:Arch519F(5′-CAGCCGCCGCGGTAA-3′),Arch915R(5′-GTGCTCCCCCGCCAATTCCT-3′)。对测定后的原始序列进行质控、拼接和序列优化,优化后的序列用Usearch软件对数据进行去嵌合体和聚类分析,以97%相似度为标准将序列聚类成为分类单元,将操作分类单元(Operational Taxonomic Unit, OTU)代表序列与Silva数据库比对并进行物种注释,利用mothur(Version 1.33.3)进行Alpha多样性指数分析(包括Chao1指数、Shannon指数、Simpson指数等物种多样性分析);选取不同的分类水平进行群落组成的统计分析;利用R语言进行韦恩(Venn)图、群落结构柱形图等统计学和可视化分析。
2 结果与分析
2.1 微波辐射预处理对暗发酵产气的影响分析
暗发酵制氢过程中累积产气量变化曲线如图1所示。由图1可以看出,微波辐射预处理样品在24 h左右累积产H2量达到最大值,为109.9 mL/g,对照组在28 h累积产H2量达到最大值,为85.9 mL/g,微波辐射预处理组累积产H2量较对照组提高了27.9%;无论对照组还是微波辐射预处理组,均在第8 h检测到CO2的产生,但在暗发酵过程中,微波辐射预处理组的累计产CO2量始终大于对照组。在整个暗发酵过程中,无论是微波辐射预处理组还是对照组,均未检测到CH4的产生。这可能是因为产甲烷菌的最佳生长pH值为6.5~8.2[28],而本实验发酵初始pH值为6.5,酸化和产氢产乙酸阶段生成的挥发性有机酸会导致发酵系统pH值大幅度下降[29],当pH值<6或pH值>8时,会对产甲烷菌的活性产生抑制,进而影响CH4的生成[30]。
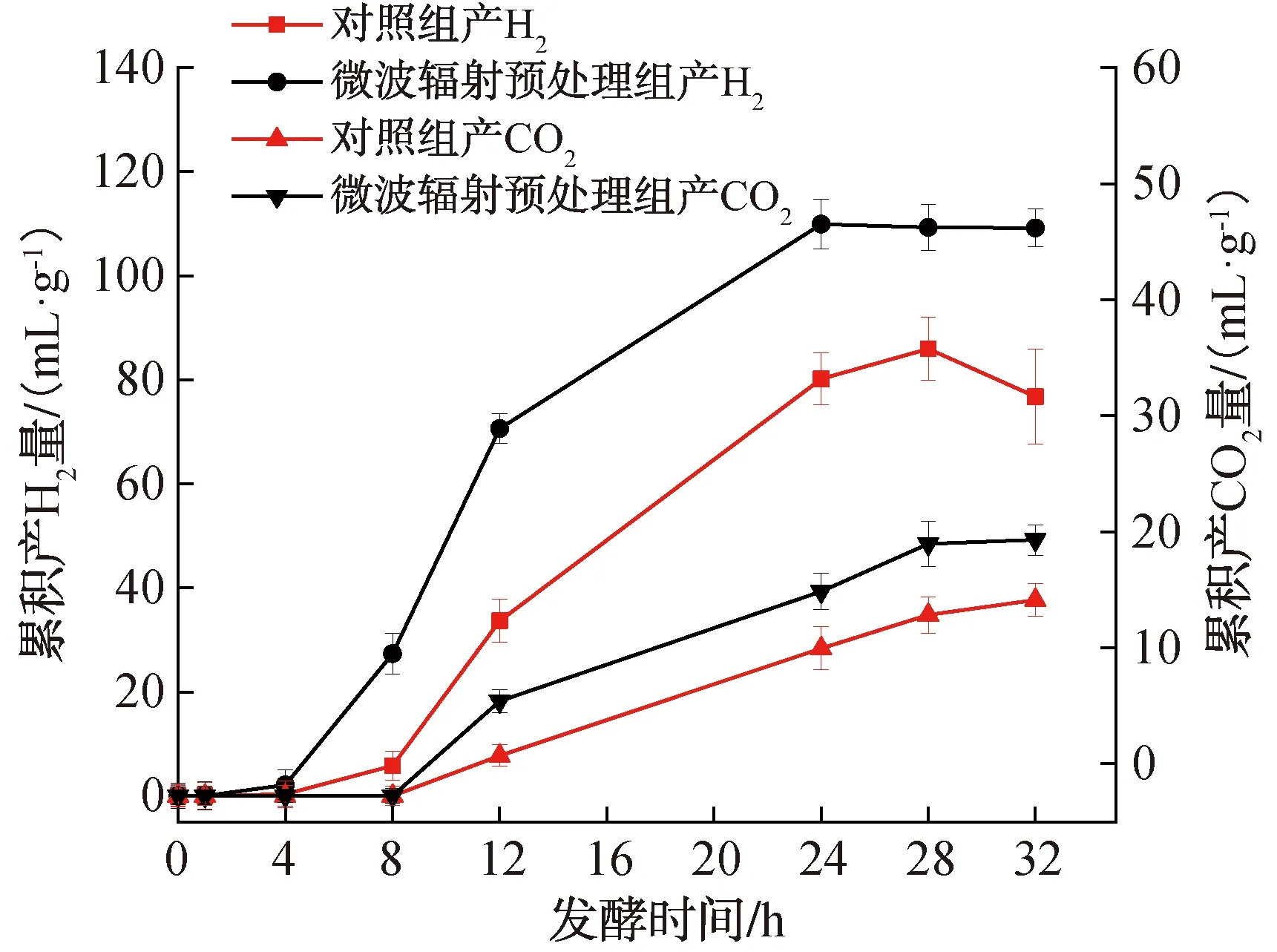
图1 暗发酵制氢过程中累积产气量变化曲线Fig.1 Change curve of cumulative gas production during dark fermentative hydrogen production
2.2 微波辐射预处理对液相代谢产物的影响分析
挥发性有机酸醇是暗发酵制氢过程中的主要副产物。液相代谢产物组成及其质量浓度如图2所示。由图2可以看出,在发酵初期(0~4 h),丙酸和乙酸均为微波辐射预处理组和对照组的主要液相代谢产物。在发酵中期(4~24 h),液相代谢产物发生明显变化,对照组丙酸含量大幅增加,乙酸含量相对减少;微波辐射预处理组丙酸含量明显减小,丁酸含量明显增加。发酵24 h时,微波辐射预处理组的丁酸累积含量达到最大值0.8 g/L,此时累积产H2量也达到最大值。暗发酵结束时,微波辐射预处理组的丁酸含量较对照组提高了24.1%。这与宋梓梅等[31]的研究结果一致,代谢产物中丁酸含量的增长有助于提高厌氧发酵的H2产量。
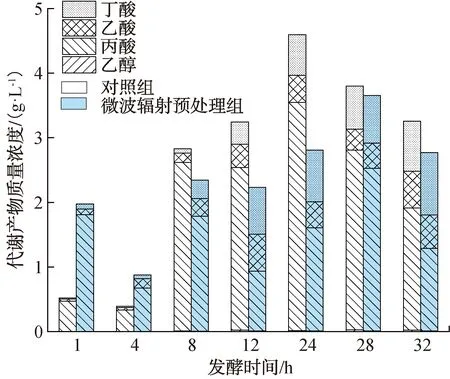
图2 液相代谢产物组成及其质量浓度Fig.2 Composition and mass concentration of liquid phase metabolites
2.3 微波辐射预处理对菌源菌群结构的影响分析
2.3.1Alpha多样性指数分析菌源菌群Alpha多样性指数比较见表1。由表1可知,各组样品的Coverage指数均>0.99,表明本次测序对样品中的细菌和古生菌的覆盖率较高,可满足各组样品中细菌和古生菌Alpha多样性分析的需要。微波辐射预处理组中,细菌和古生菌的Chao1指数都低于对照组,表明经微波辐射预处理后,菌源物种种类减少,丰度降低;古生菌的Chao1指数远低于细菌,也表明菌源中古生菌的丰度远低于细菌。另外,与对照组相比,微波辐射预处理组中细菌和古生菌的Shannon指数较小,而Simpson指数较大,表明经微波辐射预处理后,细菌和古生菌的多样性降低。
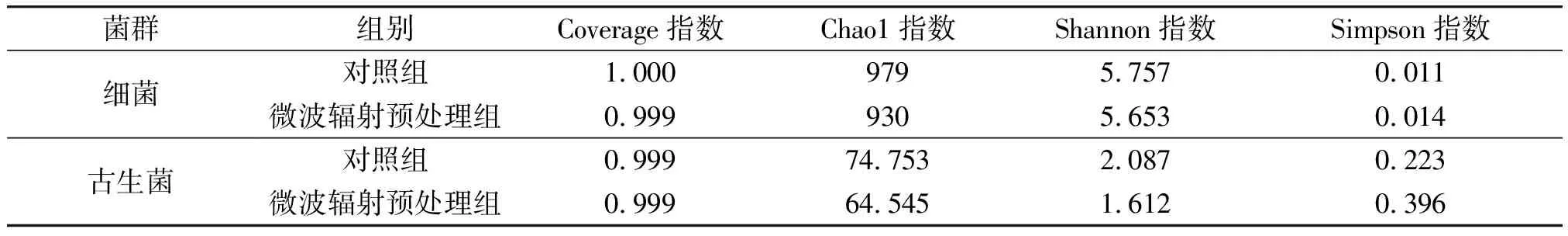
表1 菌源菌群Alpha多样性指数比较Table 1 Comparison of Alpha diversity index of bacteria
2.3.2Veen图分析Venn图可用于统计多个样本所共有和独有的OTU数目,能直观反映样本的物种数目组成相似性及重叠情况[32]。细菌和古生菌基于OTU水平的群落Veen图如图3所示。由图3可以看出,细菌群落共有的OTU数目为916个,分别占对照组和微波辐射预处理组样本OTU总数的92.9%和93.1%;古生菌群落共有的OTU数目为52个,分别占对照组和微波辐射预处理组样本OTU总数的70.3%和81.3%。这表明,经微波辐射预处理后,菌源样本的细菌群落相对较稳定,丰度有一定程度降低,而古生菌群落丰度下降较大。
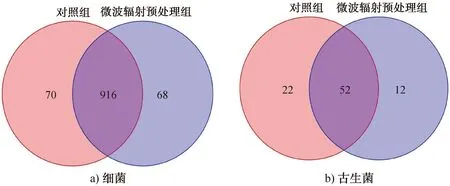
图3 细菌和古生菌基于OTU水平的群落Veen图Fig.3 Community Venn diagram of bacteria and archaea based on OTU level
2.3.3 群落结构分析1)细菌门和属的变化分析。16S rRNA基因高通量测序及分析表明,细菌群落共发现29个门,176个属。细菌群落在门水平上的相对丰度如图4a)所示。由图4a)可以看出,对照组中,相对丰度相对较高的细菌依次为变形菌门(Proteobacteria,44.9%)、绿弯菌门(Chloroflexi,14.43%)、拟杆菌门(Bacteroidetes,11.5%)、放线菌门(Actinobacteria,6.51%)和厚壁菌门(Firmicutes,2.89%);微波辐射预处理组中,相对丰度相对较高的细菌依次为变形菌门(46.5%)、绿弯菌门(14.42%)、放线菌门(7.7%)、拟杆菌门(6.11%)和厚壁菌门(4.7%)。这表明,经微波辐射预处理后,菌源中的变形菌门、放线菌门和厚壁菌门的相对丰度均升高,而拟杆菌门的相对丰度降低。
细菌群落在属水平上的相对丰度如图4b)所示。由图4b)可以看出,检测到的主要细菌属为特吕珀菌属(Truepera)、Bauldia、膨胀芽孢杆菌属(Tumebacillus)、假洪吉氏菌属(Pseudohongiella)和芽孢杆菌属(Bacillus)。微波辐射预处理后,能有效降解有机物的特吕珀菌属[33]和膨胀芽孢杆菌属[34-35]细菌的相对丰度均升高。值得注意的是,与对照组相比,经微波辐射预处理后,菌源中芽孢杆菌属的相对丰度增加,表明微波辐射预处理能够有效抑制或杀灭不产芽孢的细菌。芽孢杆菌是主要的厌氧发酵产氢菌[8],其相对丰度的增加有利于发酵系统产H2量的增加。
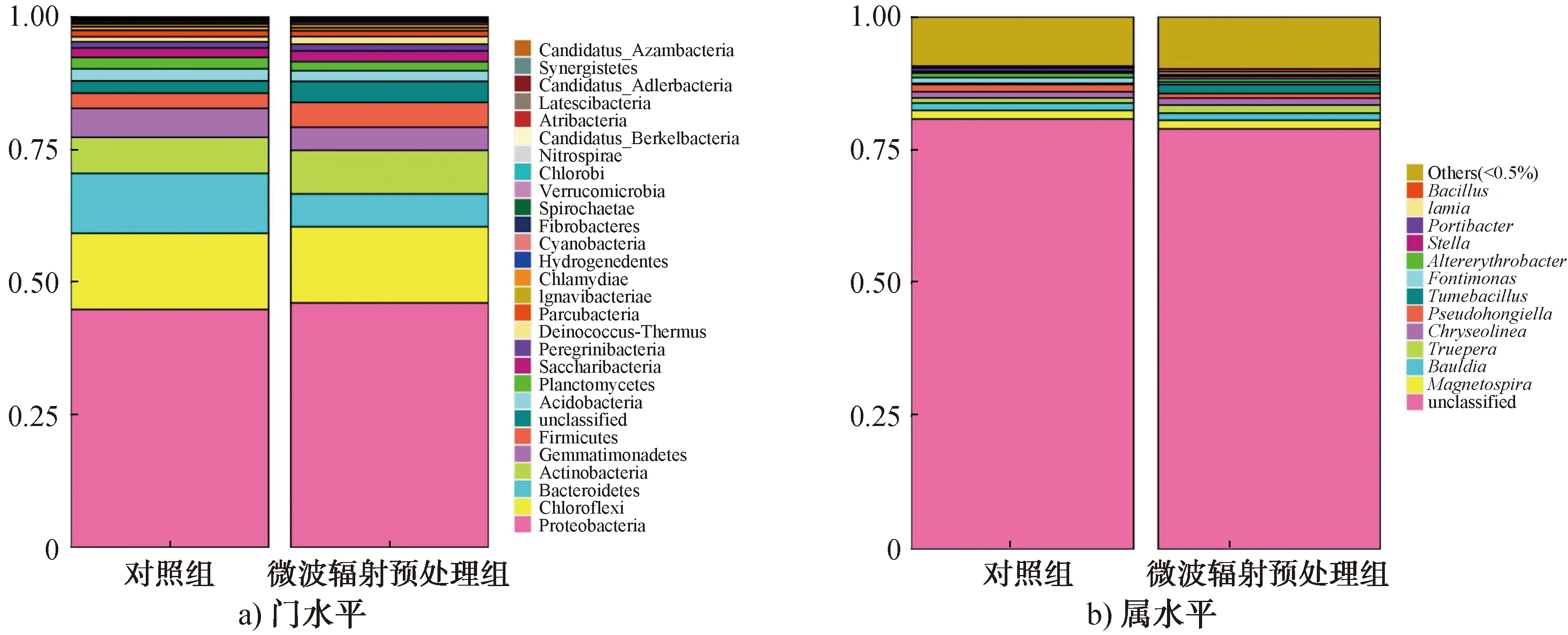
图4 细菌群落在门水平和属水平上的相对丰度Fig.4 Relative abundance of bacterial community at level of phylum and genus
2)古生菌门和属的变化分析。古生菌群落在门水平上的相对丰度如图5a)所示。由图5a)可以看出,对照组中,广古生菌门(Euryarchaeota)的相对丰度较高,为51.68%;奇古生菌门(Thaumarchaeota) 相对丰度为48.32%。广古生菌门是耗氢产甲烷菌的主要来源[36]。经微波辐射预处理后,广古生菌门相对丰度减少至31.65%,而奇古生菌门相对丰度增长至68.35%,表明经微波辐射预处理后,菌源中的产甲烷菌数量减少。
古生菌群落在属水平上的相对丰度如图5b)所示。由图5b)可以看出,未确定分类地位的古生菌相对丰度较高(91%左右)。属水平上,主要的优势古生菌为甲烷短杆菌属(Methanobrevibater)、甲烷八叠球菌属(Methanosarcina)、第七产甲烷古菌属(Methanomassiliicoccus)、甲烷球形菌属(Methano-sphaera)和甲烷囊菌属(Methanoculleus),此外还有少量的产甲烷杆菌属(Methanobacterium)和鬃毛甲烷菌属(Methanosaeta)古生菌。产甲烷杆菌属和甲烷短杆菌属都属于氢营养型产甲烷菌,均能够以H2作为电子供体,通过电子传递,还原CO2生成CH4[37-38];甲烷球形菌属同样可以利用H2作为电子供体,还原甲醇生成CH4,但必须以乙酸作为生长因子[39];鬃毛甲烷菌属以H2、甲酸盐、二元醇和CO作为电子供体,还原CO2生成CH4[40];第七产甲烷古菌属属于甲基营养型和氢营养型的混合型[41];甲烷八叠球菌属在厌氧消化过程中以乙酸作为代谢底物[42],同时还能以甲醇、甲胺、H2/CO2为代谢基质[43]。经微波辐射预处理后,甲烷八叠球菌属、第七产甲烷古菌属、甲烷球形菌属的相对丰度均减小,甲烷短杆菌属的相对丰度略有升高。这可能是因为产甲烷杆菌属和鬃毛甲烷菌属的相对丰度减小,造成甲烷短杆菌属的相对丰度略有升高。上述分析表明,微波辐射预处理后,产甲烷菌相对丰度的减小降低了暗发酵制氢过程中的耗氢作用,使系统的产H2性能得以提高。
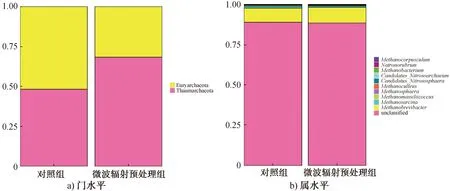
图5 古生菌群落在门水平和属水平上的相对丰度Fig.5 Relative abundance of archaea community at level of phylum and genus
3 结论
本文研究了微波辐射预处理牛粪堆肥菌源微生物群落结构变化对暗发酵制氢性能的影响。结果表明,经微波辐射预处理后,菌源暗发酵的最大累积产H2量达109.9 mL/g,比对照组提高了27.9%;高通量测序显示,微波辐射预处理导致菌源微生物数量减少,而主要的厌氧发酵产氢菌芽孢杆菌属的相对丰度比对照组有所升高,产甲烷杆菌属等产甲烷耗氢菌的相对丰度降低。微波辐射能够损伤微生物基因组DNA,抑制或杀灭敏感的耗氢菌。主要的产氢微生物芽孢杆菌则具有极强的耐辐射和耐热能力,短时间微波辐射处理不会对其造成损伤,因而微波辐射预处理后系统的产H2能力得以提高。可见,采用微波辐射预处理产氢菌源,能够抑制产甲烷耗氢菌的活性,同时保留产氢微生物芽孢杆菌的活性,是有效提高暗发酵制氢产H2量的方法之一。后续实验将进一步探究微生物种群之间的互作关系,解析微生物代谢途径与产H2量之间的关联性,以期为暗发酵制氢提供更好的技术调控策略。
