奶牛乳房炎6种主要致病菌多重PCR检测方法的建立及初步应用
2022-05-04谢玉杰缪西鹏姜兴佳牛耀祖许立华
谢玉杰,高 瑞,缪西鹏,赵 辉,姜兴佳,牛耀祖,许立华
(1.宁夏大学 农学院,宁夏 银川 750021;2.宁夏威科嘉动物科技有限公司,宁夏 银川 750021)
自我国实施奶业振兴战略以来,在国家政策的大力支持下,奶产业呈现出蓬勃发展的势头,2020年我国牛奶年产量达3440.1万t[1]。伴随着奶牛业的发展,奶牛乳房炎一直是影响奶牛养殖业最常见的感染性疾病之一。奶牛乳房炎通常是指奶牛乳腺组织受到微生物感染、物理或化学刺激而引起的一种炎性病变,导致产奶量下降与生产性能丧失等一系列问题,给奶牛养殖业带来重大的经济损失[2]。全球1/3的奶牛患有乳房炎,我国奶牛乳房炎的发病率高于30%[3]。致病性大肠杆菌、金黄色葡萄球菌、牛支原体、绿脓杆菌、无乳链球菌、停乳链球菌等是引起乳房炎最主要的几种病原菌[4-5]。传统的细菌分离培养方法具有操作相对繁琐、检测周期较长、阳性检测率低等问题,制约了对乳房炎致病菌的检出率,从而影响了奶牛乳房炎的早期预防和治疗[6]。为了及时、准确地诊断病原性奶牛乳房炎,减少奶牛乳房炎给奶牛养殖业上带来的损失,本研究建立了奶牛乳房炎主要致病菌6重PCR检测方法,用以检测奶牛乳房炎的主要致病菌,并为其早期诊断治疗及流行病学调查提供技术支撑。
1 材料与方法
1.1 材料
1.1.1菌株及乳样 金黄色葡萄球菌(ATCC29313)、无乳链球菌(ATCC13813)、绿脓杆菌(CVCC3359)、停乳链球菌(ATCC12388)、致病性大肠杆菌(ATCC35150)、多杀性巴氏杆菌(CVCC447)、鼠伤寒沙门氏菌(ATCC14028)、粪肠球菌(ATCC29212)、白色念珠球菌(ATCC90028)、牛支原体均由宁夏大学农学院兽医实验试鉴定保存。所用检测乳样取自宁夏地区部分牧场乳房炎病例。
1.1.2主要设备及试剂 PCR扩增仪为C1000Touch;凝胶自动成像系统为Gel Doc XR+,均购自于BIORAD公司;DL2000 DNA MARKER购自于TaKaRa公司;细菌DNA提取试剂盒购自于天根生化科技(北京)有限公司;PerfectStart Taq DNA Polymerase(含2.5 mM dNTPs)购自于全式金公司;omega柱式E.Z.N.A. Food DNA Kit基因组DNA抽提试剂盒购自于OMEGA公司;PPLO Broth、PPLO Agar购自于BD Difco公司。伊红美蓝琼脂培养基粉末、NAC琼脂培养基粉末、NAC液体培养基粉末BETA-SSA琼脂培养基粉末、金黄色葡萄球菌显色培养基(第二代)、NB肉汤培养基粉末、月桂基硫酸盐胰蛋白胨(LST)肉汤、煌绿乳糖胆盐肉汤(BGLB)、冻干兔血浆、精氨酸双水解酶(绿脓杆菌)、氧化酶试纸片、均购自于青岛海博生物技术有限公司。
1.2 方法
1.2.1引物的设计与合成 使用Primer Premier 5软件,以GeneBack中已发布的金黄色葡萄球菌的nuc基因、无乳链球菌的ef-tu基因、绿脓杆菌的eta基因、停乳链球菌的16srRNA基因、致病性大肠杆菌的Phoa基因、牛支原体的oppD/F基因保守区域设计6对引物并由生工生物工程(上海)股份有限公司合成。引物序列信息见表1。

表1 PCR引物序列信息
1.2.2核酸的提取 标准菌株进行复壮培养后,使用天根公司的细菌基因组DNA提取试剂盒提取1mL菌液细菌的核酸,具体操作参照说明书。
1.2.3各病原菌单一PCR检测方法的建立 分别以6种细菌的核酸作为模板,进行单一PCR扩增。反应条件(50μL):DNA模板1μL,上下游引物(10μmol/L)各1μL,Taq酶1μL,10×PerfectStartTMTaq Buffer 5μL,dNTPs(2.5 mmol/L)4μL,ddH2O补至50μL。PCR扩增程序:94℃预变性3 min;94℃变性30 s,58.3℃退火30 s,72℃延伸1 min,共35个循环;72℃终延伸5 min。
1.2.4多重PCR反应条件的优化 以6种细菌的核酸等体积混合液作为模板,对PCR反应的退火温度由50~60℃设定为8个梯度,分别为60、59.4、58.3、56.3、53.9、52、50.7和50℃;引物终浓度由0.2~1.0μmol/L每0.2μmol/L依次递增,共设5个梯度;Mg2+浓度由2~5mmol/L每0.5 mmol/L依次递增,共设7个梯度;酶浓度由0.5 U~2.5 U每次0.5 U依次递增,共设5个梯度,利用矩阵法筛选以上反应条件,以确定最佳反应程序及体系。
1.2.5多重PCR特异性试验 分别用牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌及6种核酸等体积混合液作为特异性试验的模板,利用优化后的多重PCR检测方法对多杀性巴氏杆菌、鼠伤寒沙门氏菌、粪肠球菌、白色念珠球菌的核酸样品进行检测,并用ddH2O作为阴性对照,以确定方法的特异性。
1.2.6多重PCR敏感性试验 使用微孔板分光光度计分别测定牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌的核酸浓度,将各细菌核酸浓度统一稀释到10ng/μL,再10倍倍比稀释各细菌核酸,以各梯度核酸及6种核酸等体积混合液作为模板,分别用优化后的单一PCR和多重PCR检测方法进行反应,以检测单一PCR方法和多重PCR方法的最低检测限。
1.2.7多重PCR重复性试验 将一次提取好的6种细菌的核酸等体积混合液分为4份分别作为模板,用优化后的多重PCR检测方法进行反应。每个模板每隔1周进行1次试验,重复检测4次。
1.2.8多重PCR对临床样品的检测 用omega柱式E.Z.N.A.Food DNA Kit基因组DNA抽提试剂盒对宁夏地区98份临床乳房炎病例乳样各0.5 mL进行核酸的提取,用优化后的多重PCR进行检测,并与单一PCR检测方法进行对照。此外,将检测结果为阳性的乳样进行细菌分离与纯化并按照国标《食品安全国家标准 食品微生物学检验 大肠菌群计数食品安全国家标准》《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》《食品安全国家标准 食品微生物学检验β型溶血性链球菌检验》、进出口标准《进出口食品绿脓杆菌检测方法》以及农业部标准《牛支原体PCR检测方法》中所描述的试验方法进行检测。
2 试验结果
2.1 单一PCR检测方法的建立
分别以6种细菌的核酸为模板进行单一PCR扩增后,牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌分别在相应位置扩增出与目的条带大小相符的特异性条带,ddH2O阴性对照无扩增条带。
2.2 多重PCR反应条件的优化
以1.2.4中的条件进行6重PCR优化,结果显示最佳退火温度为58.3°C(图1)、引物终浓度为金黄色葡萄球菌为和停乳链球菌0.6μmol/L、无乳链球菌和绿脓杆菌为0.2μmol/L、致病性大肠杆菌和牛支原体为1μmol/L(图2)、酶浓度为2.5 U、Mg2+浓度3 mmol/L。反应条件(50μL):核酸混合液1μL,各病原上下游引物各1μL,Taq酶1μL,10×Perfect-StartTMTaq Buffer 5μL,dNTPs(2.5 mmol/L)4μL,ddH2O补至50μL。PCR扩增程序:94℃预变性3 min;94℃变性30 s,58.3℃退火30 s,72℃延伸90 s,共35个循环;72℃终延伸5 min。

图1 6重PCR退火温度优化
2.3 单一PCR检测方法特异性试验
单一PCR检测方法均可扩增出特异性的目的片段,对于杀性巴氏杆菌、鼠伤寒沙门氏菌、粪肠球菌、白色念珠球菌的核酸和ddH2O作为模板均未扩增出条带,表明建立的单一PCR检测方法具有较好的特异性。
2.4 多重PCR检测方法特异性试验
所建立的6重PCR检测方法针对牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌能扩增出特异性的目的片段,其他参考细菌都没有扩增出条带(图2),表明该6重PCR检测方法具有较好的特异性。

图2 多重PCR特异性试验
2.5 单一PCR检测方法敏感性试验
使用微孔板分光光度计分别测定6种细菌的核酸浓度分别为130.6、115.0、166.9、96.4、80.24、150.41 ng/μL,将各细菌核酸浓度统一稀释到10 ng/μL,再对每种病原菌的核酸进行梯度稀释,根据相关公式换算为拷贝数。结果显示,单一PCR检测方法对牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌的最低检测限分别为6.6×103、8.5×105、1×103、1.8×105、2.3×103和4.38×104拷贝/μL。结果表明这6种PCR检测方法有较好的敏感性。
2.6 多重PCR检测方法敏感性试验
将各细菌核酸浓度统一稀释到10 ng/μL,再对6种核酸等体积混合液进行梯度稀释,根据相关公式将6种核酸等体积混合液换算为拷贝数。结果显示,多重PCR检测方法最低检测限分别为1.1×105、1.41×106、1.6×103、3×105、3.8×104和7.3×103拷贝/μL。结果表明该方法敏感性较高。
2.7 多重PCR重复性试验
用建立的多重PCR检测方法,每隔1周分别对提取好的6种细菌的核酸等体积混合液进行检测,结果表明:4次重复试验结果一致,都能扩增出相应特异性片段(图3)。表明此方法具有较好的重复性。
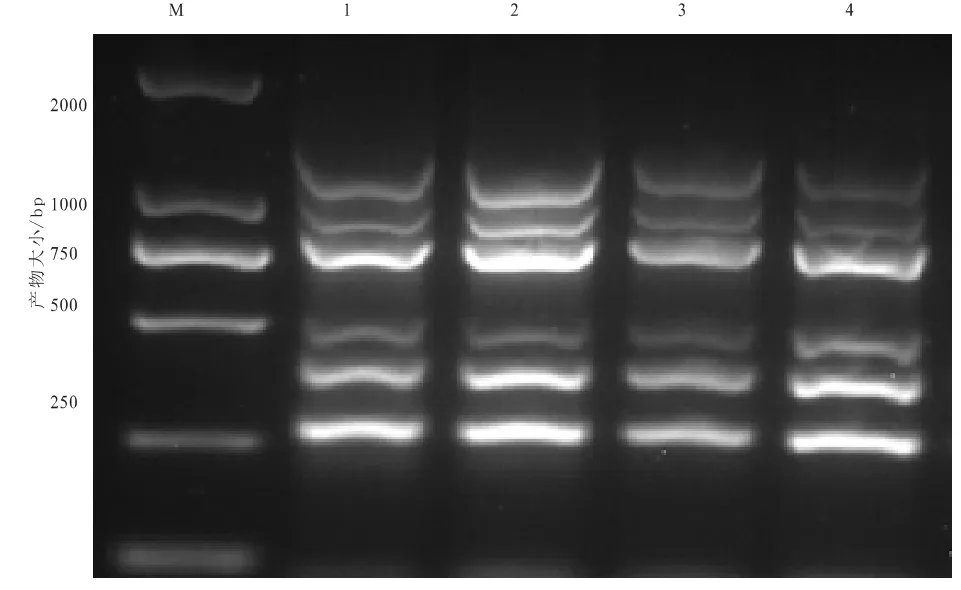
图3 多重PCR的重复性试验
2.8 多重PCR临床检测试验
用建立的多重PCR检测方法对98份临床乳房炎乳样进行检测。其中多重检测牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌的检出率分别为10.2%(10/98)、14.2%(14/98)、14.2%(14/98)、12.2%(12/98)、18.3%(18/98)、18.3%(18/98)。其中有20份样品检测出1种病原菌感染(检出率为20.4%),16份样品检测出2种病原菌感染(检出率为16.3%),6份样品检测出3种病原菌感染(检出率为6.1%),4份样品检测出4种病原菌感染(检出率为4%)。与单一PCR结果进行对比符合率分别为100%、100%、92%、91.6%、88%、94%(表2)。此外经典试验方法对多重PCR结果阳性样品的检测结果与多重PCR结果一致。

表2 样品检测结果
3 讨论
奶牛乳房炎是世界奶业最常见和最具有挑战性的奶牛疾病之一。其病因是易感动物、病原微生物、环境因素共同作用的结果。长久以来,奶牛乳房炎给奶牛养殖业造成巨大损失,世界各国都力图找到有效控制乳房炎的方法和措施。Oliveira[7-8]等人利用分子印迹技术检测乳房炎中的葡萄球菌、致病性大肠杆菌、链球菌等致病菌。由于奶牛乳房炎病因复杂,传统的细菌分离方法可获得当地流行菌株,并且具有高稳定性、成本低和可重复性强等特点[9]。但乳房病原菌种类繁多,分离培养过程繁琐、周期性长,通常需要数周时间才能确诊,并不适用于临床快速诊断。相比之下,使用PCR诊断可确保快速获得结果,并提高灵敏度,是公认的可以有效检测临床奶牛乳房炎中无乳链球菌、乳房链球菌、金黄色葡萄球菌和停乳链球菌等病原菌的方法之一[10]。有研究指出乳房炎病例的早期发现可提高60%的治愈率[11]。
本研究建立的多重PCR检测方法可以准确鉴定出乳房炎病牛牛奶中的这6种病原菌。在特异性方面,采用该方法检测乳房炎中多杀性巴氏杆菌、鼠伤寒沙门氏菌、粪肠球菌、白色念珠球菌,结果呈阴性。证明该多重PCR方法具有较好的特异性。在敏感性方面,牛支原体、致病性大肠杆菌、停乳链球菌、绿脓杆菌、无乳链球菌、金黄色葡萄球菌在单一PCR敏感性试验中,最低终浓度分别为6.6×103、8.5×105、1×103、1.8×105、2.3×103和4.38×104拷贝/μL,在多重PCR敏感性试验中最低终浓度分别为1.1×105、1.41×106、1.6×103、3×105、3.8×104和7.3×103拷贝/μL。与夏颖[12]建立的金黄色葡萄球菌、无乳链球菌、绿脓杆菌的三重PCR和陈亚明[13]建立的大肠杆菌、金黄色葡萄球菌、蜡样芽孢杆菌的三重PCR的诊断方法相比,本研究所建立的方法检测的细菌种类更多,在敏感性方面比夏颖建立的多重PCR最低模板终浓度10-3mg/L略低;与陈亚明多重PCR最低模板终浓度10 pg/μL相比,敏感性基本一致。Ashraf等人[14]建立了9种乳房炎病原菌的多重PCR方法,该方法虽然特异性强,敏感性达到50 pg/μL,但操作难度高且不易推广。多重PCR敏感性相比于单一PCR有所下降,这可能是多重PCR引物之间形成了二聚体,影响了模板DNA与引物的有效结合,导致多重PCR扩增效率下降。
本研究建立的多重PCR临床检测结果显示,98份临床样品中有46份乳样检测到病原菌,其中多重感染的乳样为26份,占临床样品的56.5%,表明宁夏地区奶牛乳房炎感染病例中多重感染占大多数,证明了该方法具有临床应用意义。该方法为奶牛乳房炎主要病原菌的诊断提供了有力技术支撑,对奶牛乳房炎的综合防治产生积极作用。
