外源酚酸对生防细菌拮抗尖孢镰刀菌西瓜专化型的影响
2022-05-04孙小涵黄凯悦田彦梅
孙小涵,马 钰,黄凯悦,田彦梅,顾 欣
(宁夏大学 农学院,宁夏 银川 750021)
西瓜连作可导致土壤物理、化学和生物性质发生变化,生产性能降低,还会引起土壤真菌化,尤其引起病原真菌数量增加,致使西瓜开花坐果后易发生枯萎病,造成西瓜产量、品质下降,甚至绝收,产生严重的连作障碍[1],而且枯萎病发病率有随连作年限增长而增加的趋势[2]。西瓜枯萎病的主要致病菌为尖孢镰刀菌西瓜专化型(Fusarium oxysporumf.sp.niveum,FON),尤以温室栽培和大棚种植环境易发病。
连作可导致作物根系分泌物在土壤中积累,分泌物达到一定浓度后会对植株产生毒害作用,这是引起连作障碍的主要因素之一[3—4]。其中,酚酸类物质作为重要的化感物质,一方面会降低土壤中某些养分的含量[5],影响土壤中多种酶的活性[6];另一方面会改变土壤微生物区系[7]。有研究表明,土壤酚酸的种类、浓度及无机养分与土壤微生物类群分布存在一定关系[8]。土壤中酚酸的累积可直接影响土壤的理化性质,从而使土壤微生物多样性、群落结构、生物量和活性发生改变,某些种类的微生物在数量及活性上显著增加或趋于增长,同时另一些微生物则呈下降趋势[9—10]。西瓜根系分泌物及其中的酚酸物质对FON产孢、萌发及生长往往具有“低浓度促进,高浓度抑制”的作用规律,而水稻根系分泌物及其中的酚酸物质则抑制FON产孢及萌发[11]。有研究表明,连作土壤中并存着多种酚酸类物质,且酚酸类物质之间存在互作效应[12]。如不同浓度水平的水杨酸分别对对羟基苯甲酸表现增效和拮抗作用。因此,连作环境中由酚酸物质导致的化感作用是多种酚酸物质共同作用的结果[13]。
将生防微生物引入综合防控系统是重要且有效的方法之一[14]。目前,已获得若干拮抗FON的菌株,并经室内试验证明其对病原菌具有不同程度的拮抗作用[15—16],部分菌株在田间的试验也表现出较好的防效[17]。然而,笔者在应用菌剂中遇到了二个问题,一是某些生防菌株在室内对峙培养试验中具有较高抑菌率,而田间防效却不尽如人意;二是相同生防菌剂在不同土壤环境中使用,防效具有差异。土壤微生物的生存及活性极易受环境因子的影响[18]。连作土壤中的酚酸类物质与植株健康生长和土壤病原菌数量变化存在一定关系,但其对病原菌的拮抗菌及其功能的影响至今未见报道。本试验在添加不同浓度邻苯二甲酸、对羟基苯甲酸、阿魏酸、肉桂酸和混合酚酸的条件下,比较FON和生防细菌菌落生长的情况,并通过对峙培养,研究不同外源酚酸对生防细菌拮抗FON性能的影响,以期为生防菌剂的应用研究提供依据。
1 材料与方法
1.1 试验材料
1.1.1供试病原菌 西瓜专化型尖孢镰刀菌(Fusarium oxysporumf.sp.niveum,FON)菌株由宁夏大学农业资源与环境教研室提供。
1.1.2供试拮抗菌 供试拮抗菌为商品菌剂,购自当地农资市场。含单一细菌-解淀粉芽孢杆菌(Bacillus amyloliquefaciens),有效活菌数500×108CFU/mL。
1.1.3培养基 PDA培养基用于病原菌的培养和对峙试验。
1.1.4试剂 供试邻苯二甲酸由国药集团化学试剂有限公司提供,对羟基苯甲酸和肉桂酸由北京索莱宝科技有限公司提供,阿魏酸由北京博奥拓达科技有限公司提供。
1.2 试验方法
1.2.1病原菌活化与菌碟制备 在直径为9.0 cm的PDA平板中央点接少量FON斜面培养物,28℃、相对湿度60%,倒置培养5~6 d,待菌落基本长满平皿,于距平皿中心2.0 cm处用无菌打孔器打取直径0.5 cm、菌丝生长状态一致的菌碟备用。
1.2.2拮抗细菌对FON菌落生长的影响 以无菌水制备菌剂10倍、50倍和100倍稀释液,室温下摇床振荡混匀30 min,制成菌悬液。在PDA平板中央放置1个FON菌碟,以菌碟为中心距其边缘2.0 cm处以十字对称方式放置4个无菌牛津杯,每个杯中注入同一稀释倍数菌悬液120μL,28℃恒温培养24 h。此时菌悬液中大部分水分已蒸发,取走牛津杯,持续培养并于48、72和96 h时观察菌落生长情况,使用游标卡尺测量FON菌落直径并记录数据。在牛津杯内注入120μL无菌水作为空白对照。每处理设5次重复。抑菌率计算公式:抑菌率(%)=(对照菌落直径-处理后菌落直径)/对照菌落直径×100。
1.2.3不同酚酸对FON菌落生长的影响 用无菌水制备质量浓度为10、30和50 mg/L的邻苯二甲酸、对羟基苯甲酸、阿魏酸、肉桂酸和混合酚酸试剂,混合酚酸试剂中邻苯二甲酸、对羟基苯甲酸、阿魏酸和肉桂酸的质量分数各占1/4。取酚酸试剂0.1 mL置于PDA培养基表面,用无菌三角棒均匀涂抹,静置2~3 min,待其渗入培养基,制成酚酸平板。于酚酸平板中央放置1个FON菌碟,28℃恒温条件下倒置培养,分别于48、72和96 h时观察菌落生长情况,测量FON菌落直径并记录数据。以培养基表面加0.1 mL无菌水代替酚酸试剂为空白对照(CK1)。每处理设5次重复。
1.2.4不同酚酸对拮抗细菌菌落生长的影响 在酚酸平板中央区放置2个无菌牛津杯,二者相距4.0 cm,每个杯中注入同种菌剂的100倍稀释液120μL,28℃恒温培养,至24 h取走牛津杯,分别于48、72和96 h时观察菌落生长情况,测量菌落直径并记录数据。以培养基上加0.1 mL无菌水代替酚酸试剂为空白对照(CK2)。每处理设5次重复。
1.2.5不同酚酸对生防细菌拮抗FON的影响 用30 mg/L的5种酚酸试剂制备相应的酚酸平板,方法同1.2.3。于酚酸平板中央放置1个FON菌碟,以菌碟为中心距其2.0 cm处以十字对称方式分别放置4个无菌牛津杯,每个杯中注入同一稀释倍数的菌悬液120μL,28℃恒温培养,至24 h取走牛津杯,分别于48、72和96 h时观察菌落生长情况,测量FON菌落直径并记录数据,以无菌水代替酚酸和菌剂为绝对对照,计算抑菌率。以培养基表面加0.1 mL无菌水代替酚酸试剂为空白对照(CK3)。每处理设5次重复。
1.3 数据统计与分析
本试验数据采用microsoft excel 2010处理及制作图表;方差分析采用SPSS;利用LSD法在P<0.05水平上进行差异显著性检验。
2 结果与分析
2.1 拮抗细菌对FON菌落生长的影响
由图1可知,供试菌剂对FON具有拮抗作用,抑菌率随着菌剂稀释倍数的增大而降低。培养48、72和96 h时,与10倍稀释液的抑菌率比较,菌剂50倍稀释液的抑菌率分别降低3.62%、2.98%和1.02%,100倍稀释液的抑菌率分别降低6.72%、3.64%和1.28%。这说明菌剂对病原菌的抑制率随稀释倍数增加而减小,稀释10倍处理的抑菌率显著高于稀释100倍处理;随着培养时间的增长,各稀释倍数处理间抑菌率的差异呈降低趋势。

图1 不同稀释倍数的拮抗菌剂对FON的抑菌率
2.2 不同酚酸对FON菌落生长的影响
由表1可知,在试验的质量浓度范围内,不同酚酸处理均对FON菌落生长具有促进作用,且该作用随酚酸质量浓度增加而增强。随着培养时间的增长,不同酚酸对FON菌落直径的促进作用发生了变化。50 mg/L不同酚酸处理对FON菌落生长的促进作用如下:培养48 h时由强到弱依次为邻苯二甲酸、对羟基苯甲酸、混合酚酸、阿魏酸、肉桂酸,菌落直径较CK分别增加了3.74%、3.54%、2.77%、2.36%和2.21%;培养72 h时强弱依次为混合酚酸、阿魏酸、肉桂酸、对羟基苯甲酸、邻苯二甲酸;培养96 h时强弱依次为肉桂酸、混合酚酸、对羟基苯甲酸、邻苯二甲酸、阿魏酸。培养48 h,同一酚酸组中50 mg/L处理对菌落直径的促进作用显著高于10 mg/L处理,邻苯二甲酸、对羟基苯甲酸、混合酚酸、阿魏酸和肉桂酸的增幅分别为2.95%、2.18%、1.88%、1.79%和0.81%。随着培养时间的增长,该差异逐渐缩小,至96 h时差异无显著性。

表1 不同酚酸对FON菌落直径的影响
2.3 不同酚酸对生防细菌菌落生长的影响
拮抗菌株是生防菌剂的核心成分,作为微生物活体,其生长受到不同酚酸的影响。如表2所示,不同酚酸对生防细菌菌落的生长具有显著抑制作用,抑制强度因酚酸种类而不同,并随着酚酸质量浓度增加而增强。50 mg/L不同外源酚酸对生防细菌菌落生长的抑制作用如下:培养48 h时由强到弱依次为邻苯二甲酸、混合酚酸、阿魏酸、对羟基苯甲酸、肉桂酸,菌落直径较CK分别减少了18.82%、18.68%、17.24%、16.71%和15.13%;培养72和96 h时强弱依次为混合酚酸、邻苯二甲酸、对羟基苯甲酸、肉桂酸、阿魏酸。培养初期,50 mg/L邻苯二甲酸、肉桂酸和混合酚酸对生防细菌菌落直径的抑制作用显著高于10 mg/L相应酚酸处理,培养时间至72、96 h差异幅度缩减至无显著性。50 mg/L混合酚酸处理的菌落直径均为各组最低水平,48、72和96 h菌落直径与CK相比降幅为18.68%、14.64%和14.64%。

表2 不同酚酸对生防细菌菌落直径的影响
2.4 不同酚酸对生防细菌拮抗FON的影响
由图2可知,在外源酚酸环境中,生防细菌仍对FON表现出拮抗性,抑菌率随着菌剂稀释倍数的增加而降低。添加不同酚酸显著降低菌剂对FON的抑菌率,48 h时与CK比较,不同酚酸处理下菌剂的10、50和100倍稀释液的抑菌率分别下降16.94%~21.23%、18.27%~25.32%和23.79%~28.19%。30 mg/L酚酸处理下,肉桂酸对菌剂100倍稀释液拮抗性的影响最大,抑菌率仅为19.23%,较CK降低了28.19%;混合酚酸对菌剂10倍稀释液拮抗性的影响最小,抑菌率为23.85%,较CK降低了16.94%(图2-a)。如图2-b和2-c所示,随着培养时间的增长,各处理的抑菌率进一步提高,但相同时间内的增幅逐渐减小,抑菌率与CK的差距缩小。至96 h时,除CK和阿魏酸,各菌剂不同稀释倍数处理间的抑菌率差异不显著。CK3组10倍稀释液的抑菌率始终显著高于50和100倍稀释液。阿魏酸组10倍稀释液的抑菌率始终显著高于100倍稀释液。
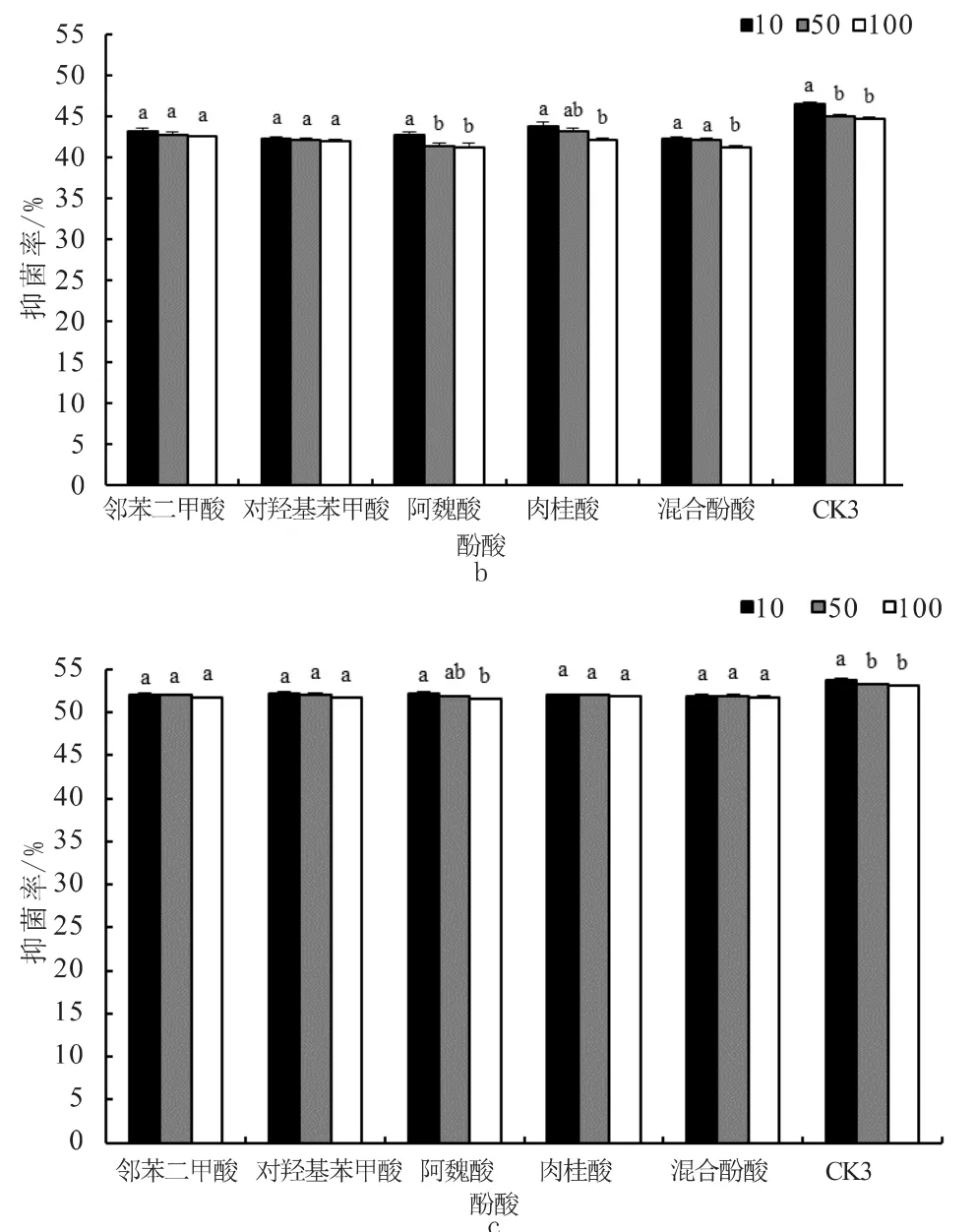
图2 不同酚酸处理下不同稀释倍数菌剂对FON的抑制率
3 结论与讨论
3.1 不同酚酸对FON菌落生长的影响不同
土壤中的酚酸类物质多源于植物的根系代谢分泌和植株残体分解,其中多种酚酸处于一定浓度范围可促进FON的菌丝生长及产孢[11],同时考虑到耕作层土壤中单一酚酸浓度多处于较低水平,故本试验采用的酚酸质量浓度为10~50 mg/L。郝文雅等[11]研究酚酸类物质对FON的影响,认为阿魏酸、对羟基苯甲酸、邻苯二甲酸对FON孢子萌发、产孢具有促进作用,且阿魏酸的促进作用较为突出。本试验结果表明,10~50 mg/L的邻苯二甲酸、对羟基苯甲酸、阿魏酸、肉桂酸及4种酚酸的混合物对FON菌落的生长均具有促进作用。培养初期50 mg/L酚酸处理的菌落直径显著大于低质量浓度处理,且阿魏酸对FON菌落的促生长作用显著低于其他酚酸。随着培养时间的增长,酚酸类物质作为有机营养物可被微生物所消耗[19],培养至96 h时,该试验环境中部分酚酸可能已被降解,各处理的FON菌落直径无显著差异。
3.2 不同酚酸对拮抗菌菌落生长的影响不同
试验采用细菌型生防菌剂。由于细菌的最适pH值范围一般为弱碱性,故外源添加酚酸造成环境pH值降低,不利于细菌的生长。试验结果表明,邻苯二甲酸、对羟基苯甲酸、阿魏酸、肉桂酸及4种酚酸的混合物对生防细菌生长均具有抑制作用,至72、96 h时已无显著差异。培养至96 h,阿魏酸对生防细菌生长的抑制作用最低。值得注意的是,较高质量浓度的混合酚酸对生防细菌菌落生长的抑制作用处于最高水平(除邻苯二甲酸对菌剂10倍稀释液处理外),这说明混合酚酸较相同质量浓度的单一酚酸对生防细菌生长的抑制作用更强。土壤中共存多种酚酸类物质,且连作土壤的酚酸含量高于非连作土壤[20],因此连作土壤中酚酸的积累必然影响生防细菌的生物活性。
3.3 不同酚酸对菌剂拮抗FON能力的影响不同
生防菌剂中拮抗菌的数量与稀释倍数成反比,因此无论环境中是否有酚酸,抑菌率均随着稀释倍数的增加而减小。外源添加一定质量浓度的酚酸类物质,对FON和生防细菌菌落的生长分别具有显著促进作用和抑制作用,导致生防菌剂对FON的抑菌率显著降低。在培养初期(48 h),环境中的酚酸含量较高,抑菌率显著下降,最高降幅达28.19%。随着培养时间的增长,可能由于环境中的酚酸逐渐被菌体消耗,质量浓度下降,其对抑菌率的影响也逐渐减小,直到与CK无显著性差异。至培养后期(96 h),阿魏酸对FON的促生长作用及其对生防菌生长的抑制作用均为最弱,故不同稀释倍数菌剂的抑菌率差异较大,与CK相似。一般而言,有机酸分子量越大,越不易被降解。阿魏酸是试验中分子量最大的酚酸,可能由此导致其对微生物的作用较弱。值得关注的是,混合酚酸对生防细菌生长的抑制作用最强,但在生防细菌与FON对峙培养的初期,虽然显著降低了生防细菌的抑菌率,但对其影响的强度却不及其他酚酸处理。可能是由于不同酚酸之间的互作效应不同[13],以及微生物对各种酚酸的敏感度和代谢差异导致了该结果。
邻苯二甲酸、对羟基苯甲酸、阿魏酸、肉桂酸及4种酚酸的混合物对FON的生长具有促进作用,对其生防细菌的生物活性具有抑制作用,从而导致酚酸环境中生防细菌对FON的拮抗性下降,且菌剂稀释倍数越大,受酚酸影响越严重,下降幅度越大。混合酚酸对生防细菌的抑制作用较相同质量浓度的单一酚酸更强。因此,在酚酸积累的环境如连作土壤或基质中施用细菌型生防菌剂,应适当降低菌剂的稀释倍数,有利于生防菌株对病原菌的拮抗性保持在较高水平。
