三维显微体视解剖技术联合二维高尔基染色断层切片研究兔丘脑-皮层层次结构关系
2022-05-03吴京展秦坤明廖声潮唐纯海阮玉山
吴京展 秦坤明 廖声潮 唐纯海 阮玉山
[摘要]目的丘腦-皮层的结构和功能关系对神经科学有重要的意义,是理解认知和意识的核心问题。本研究拟采用三维显微体视解剖方法联合高尔基断层切片染色的方法呈现兔丘脑-皮层结构的三维层次关系。方法用福尔马林固定两周以上的幼兔头两只在连续变倍体视显微镜下解剖,寻找到展示丘脑-皮层关系的较佳剖面角度,然后利用该剖面作指导,在对侧半球镜像位置进行同样的断层切片和高尔基染色,以标注切片研究图片的正确结构。结果三维显微体视解剖技术可以像在人类神经外科临床解剖研究中所展现的那样,显示出强大的三维结构观察功能。该技术联合传统的脑断层切片染色技术,可以帮助正确展示脑结构的剖面,避免单纯切片研究中产生的某些对大脑三维结构的误解。结论三维显微体视解剖技术联合二维高尔基断层切片技术能很好地显示兔端脑的丘脑-皮层的层级三维关系和详细的切片染色细节。 [关键词]显微体视解剖;显微解剖;脑三维结构;断层切片;丘脑-皮层结构;新西兰兔;脊椎动物
[中图分类号] R602 [文献标识码] A [文章编号]2095-0616(2022)07-0025-06
Study on the thalamocortical hierarchical organization in rabbits by three-dimensional stereoscopic microanatomy combined with two-dimensional sectioning and Golgi staining
WU Jingzhan QIN Kunming LIAO Shengchao TANG Chunhai RUAN Yushan
Department of Neurosurgery, the Second Affiliated Hospital of Guangxi Medical University, Guangxi, Nanning 530000,China
[Abstract] Objective The structural and functional relationship between thalamus and cortex is of great significance to neuroscience and is the core for understanding cognition and consciousness. In this study, three- dimensional stereoscopic microanatomy combined with sectioning and Golgi staining was used to present the three-dimensional hierarchical relationship of rabbit thalamocortical structure. Methods Two young rabbit heads fixed with formalin for more than two weeks were dissected under a zoom stereo microscope to find a better profile angle to show the relationship between thalamus and cortex. Then under the guidance of this profile, the same cross-sectional sectioning and Golgi staining were performed at the mirror position of the contralateral hemisphere to mark the correct structure on the picture for the sectioning study. Results The three-dimensional stereoscopic microanatomy could demonstrate a powerful three-dimensional structure observation function as shown in the clinical anatomy of human neurosurgery. This technique combined with the traditional brain sectioning and staining technique could help to correctly display the profile of brain structure and avoid some misunderstandings about the three-dimensional structure of brain in the simple sectioning study. Conclusion Three-dimensional stereoscopic microanatomy combined with two-dimensional sectioning and Golgi staining can well display the hierarchical three-dimensional relationship between thalamus and cortex in rabbit telencephalon and sectioning and staining details.
[Key words] Stereoscopic microanatomy; Microanatomy; Three-dimensional structure of brain; Cross-sectional sectioning; Thalamocortical structure; New Zealand rabbit; Vertebrate
目前除人类大脑外,其他脊椎动物的脑结构研究还没有应用显微体视解剖的方法,仍然主要使用二维切片染色技术[1]。切片染色固然对显微解剖(microanatomy)结构的显示十分清楚,但是对宏观结构的三维关系有时会产生误解,有研究[2]运用断层解剖制作图谱的时候由于缺乏三维体视显微图谱的参考就误解了侧脑室和三脑室的范围和丘脑-半球间隙。研究[3]已经证明三维显微体视解剖在说明新西兰兔丘脑-皮层结构关系中的重要参考作用。现拟采用三维显微体视解剖的方法联合传统的二维高尔基断层切片染色呈现新西兰兔丘脑-皮层的三维结构关系。本研究的图谱主要呈现两个方法结合对生物脑的详尽展示作用,以及对断层切片的指导作用,为以后的脊椎动物的丘脑-皮层网络功能的阐述提供参考。
1材料与方法
1.1 标本制作和处理
1.1.1 标本制作使用两只40日龄新西兰幼兔(实验动物生产许可证号: SCXK 桂2014-0002)。参考已有研究[4],用过量的戊巴比妥(100 mg/kg)处死动物。剖取兔头并完全去除头部皮毛,泡入10%中性缓冲福尔马林固定液(广州维格斯生物科技有限公司)并于常温下避光固定两周以上待用。
固定处理后的兔头标本在直视下,用咬骨钳和组织剪分离去除颅骨表面的大块软组织。而后在三目体视显微镜观察下用显微剪、显微持针器、显微镊分离去除颅骨表面肌肉、筋膜、唾液腺及眶内组织,各颅神经于出颅骨处切断。
1.1.2 显微体视解剖标本的制作经上述处理的兔颅标本取仰卧位,于体视显微镜(WSOPTICS 上饶市微视时代光学仪器有限公司,目镜高眼点广角20×,物镜0.3×, XPZ 连续变倍机头0.6×~5×可调,0.5×摄像机接筒)3.6~15倍条件下,用显微持针器充当显微咬骨钳,及使用显微镊及显微剪分离解剖去除颅骨。颅骨解剖顺序从腹侧的枕骨大孔处开始,逐渐向周围去除脑的腹侧骨质,然后兔颅再左右侧卧以去除颅盖骨质。
去除完骨质的兔大脑标本外包裹硬脑膜及附属的静脉窦、穿行的颈内动脉、三叉神经的硬脑膜鞘、垂体的硬脑膜鞘。在体视显微镜下继续将硬脑膜及其附属结构去除,得到完整的脑结构(包括大脑结构、中脑、脑桥、延髓、小脑及两侧绒球小结叶)。在体视显微镜下继续解剖,切开一侧半球的侧脑室顶部神经层,寻找到能正确显示丘脑-皮层的延伸和卷曲层叠关系的剖面角度,将该剖面扩展至整个半球和丘脑,从而形成拟做高尔基染色的切片的指导剖面。
1.2 切片染色的制作
1.2.1 高尔基染色在显微体视解剖已做好剖面侧的大脑半球参考下,于对侧半球将兔脑组织切出2~3 mm 厚的组织块。组织块用生理盐水轻轻清洗数遍后,置于45 ml EP 管中,加入高尔基染液(servicebio, G1069)将组织完全浸没,放置阴凉通风处避光处理14 d(浸泡48 h 后换一次新染液,之后每隔3 d 换一次新染液)。
1.2.2 脱水将组织块取出,置于15%蔗糖溶液中4℃避光脱水1 d。而后取出组织,置于30%蔗糖溶液中4℃避光脫水2 d。
1.2.3 显影定影取出组织块用蒸馏水洗1 min,然后浸入浓氨水(国药)处理45 min,蒸馏水洗1 min,最后浸入酸性坚膜定影液处理45 min,蒸馏水洗1 min。
1.2.4 脱水冰冻切片组织块置于30%蔗糖溶液中4℃避光脱水2~3 d,脑组织 OCT(SAKURA,4583)包埋,冰冻切片100μm(明胶玻片贴片),常温避光保存过夜,取出切片浸入纯水20 s,滤纸擦干组织周围多余的水分后,甘油明胶封片(servicebio, G1402)。
1.3 标本分析
所有标本显微体视解剖照片均使用三目显微解剖显微镜的摄像机拍摄,光源除显微镜自带物镜的环形光源外,另加外置辅助20 cm 直径环形补光源。照片的光学及数码放大倍数在5×~20×,背景为深蓝色照相纸。切片染色照片用数字切片扫描仪(3D HISTECH,Pannoramic 250)全景扫描。
2结果
两个兔脑,一个同既往的兔脑大体解剖,展示背侧、腹侧、外侧、内侧、喙侧、尾侧大体观的基本视角,但拍摄的显微彩色照片较其他研究的黑白大体观照片有明显的进步。该标本还进一步用于剖开侧脑室顶,观察丘脑-皮层间脉络裂的结构关系,以帮助第二个兔脑标本确定剖面的制作角度。第二个兔脑标本在第一个标本提供的指导下,选择合适角度进一步剖开脑室顶并逐步解剖形成丘脑-皮层剖面。这个过程中,显微体视解剖技术展示了良好的显微结构展示功能。第二个标本的对侧完整半球在已解剖侧半球的指导下,进行切片包埋后染色制作染色片。在显微体视解剖辅助下,制作的二维切片图片的结构关系简洁明了,不会产生单纯断层切片解剖研究中三维解剖结构混淆的问题。
2.1 端脑基本视角的重作
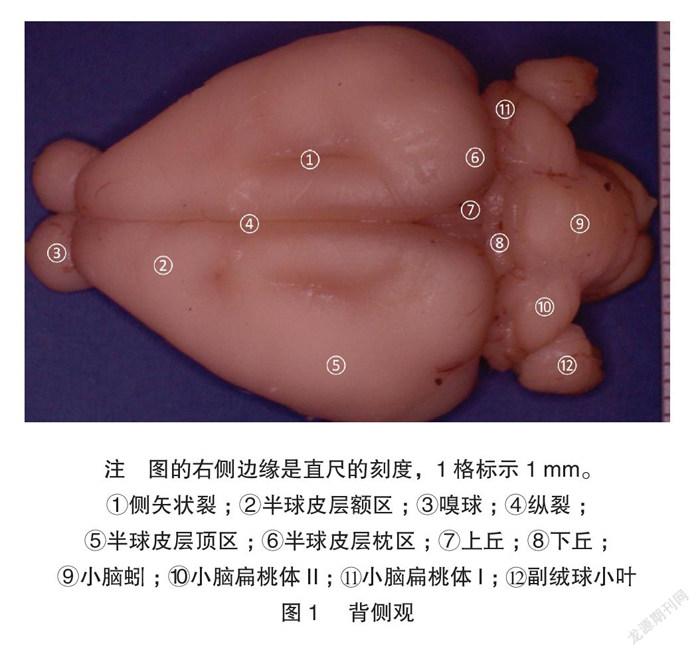
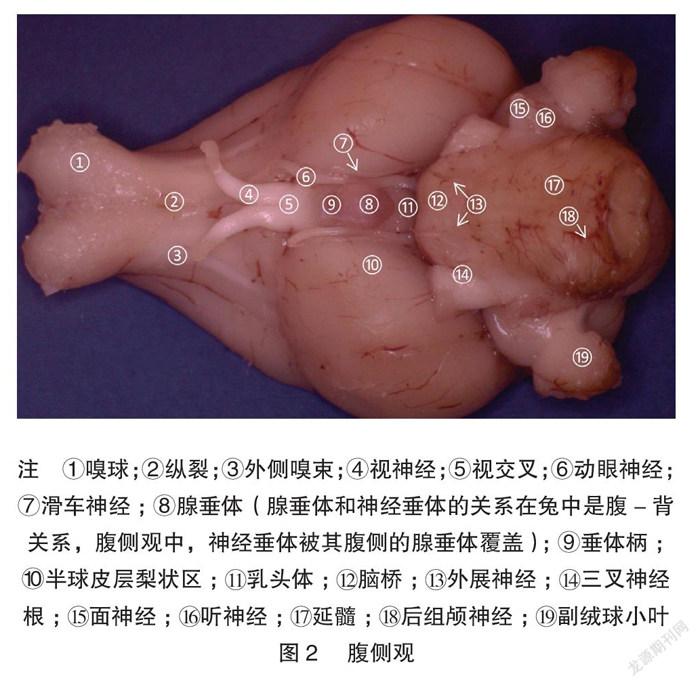
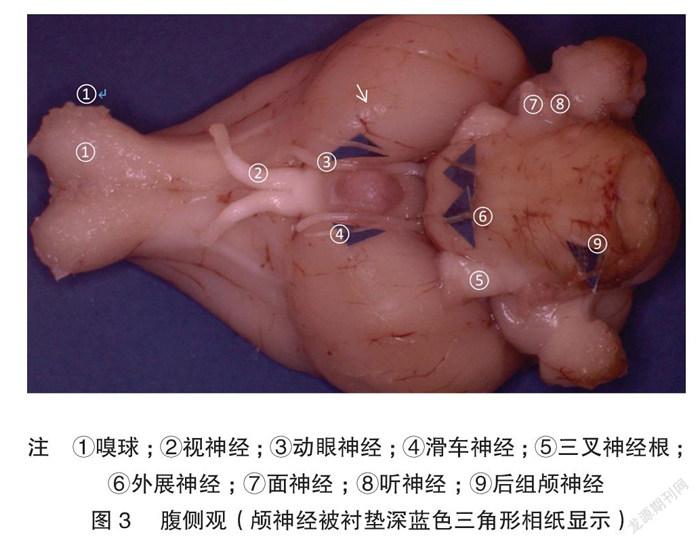
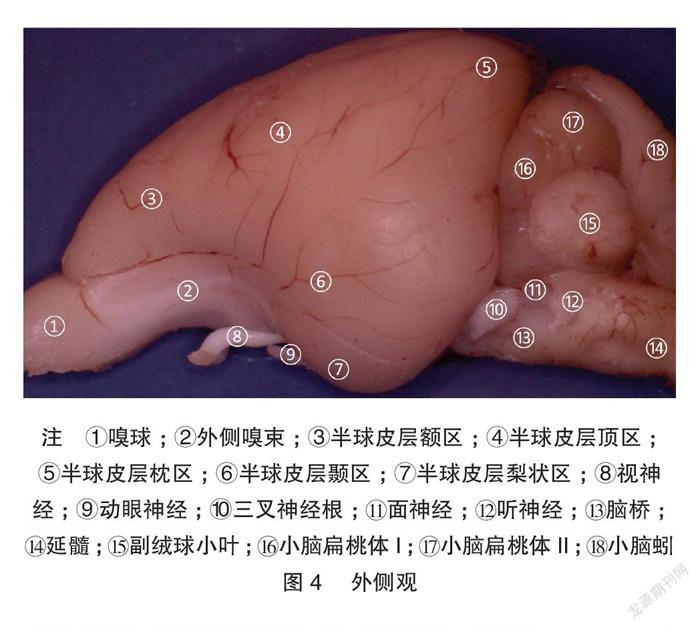
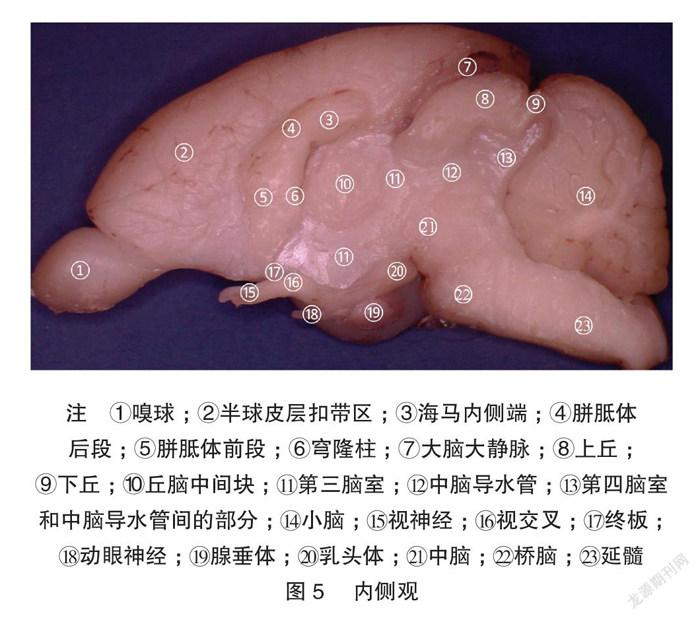
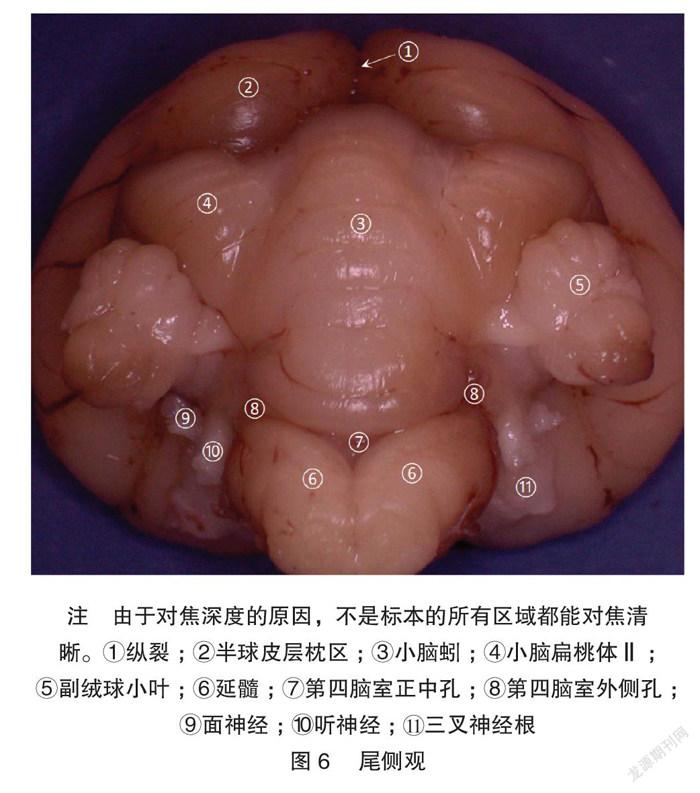
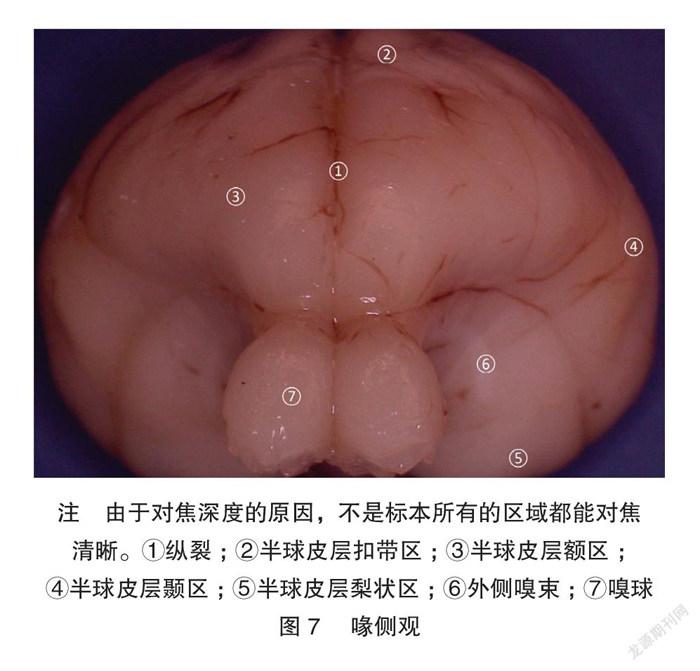
显微体视解剖制作的标本显微细节清晰可见。兔脑背、腹、外、内、尾、喙视图各种脑表面细节展示非常清楚,特别是腹侧视野,能清晰展示Shek等[5] 用普通解剖技术及黑白大体解剖照片所不能解剖展示的垂体、垂体柄、各对颅神经。内侧观展示了既往大体解剖所不能展示的丘脑间结构:清晰的三脑室结构和丘脑中间块。见图1~7。
2.2 半球的显微解剖
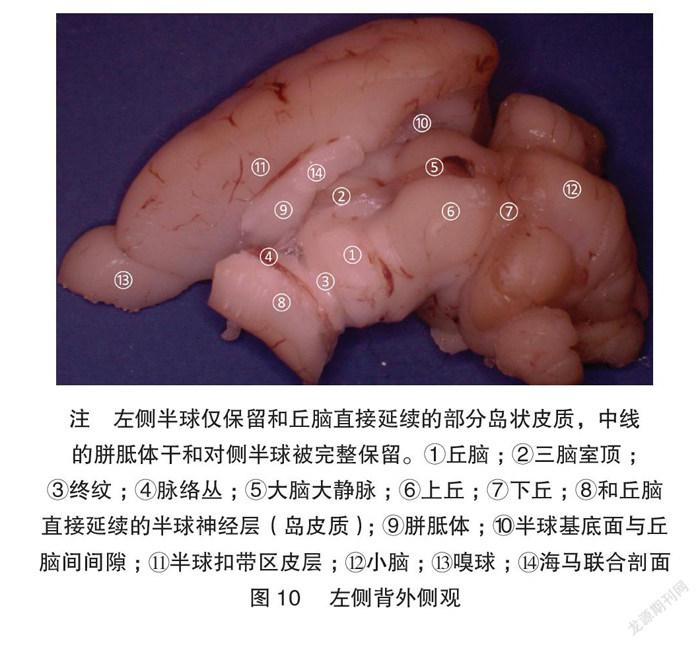
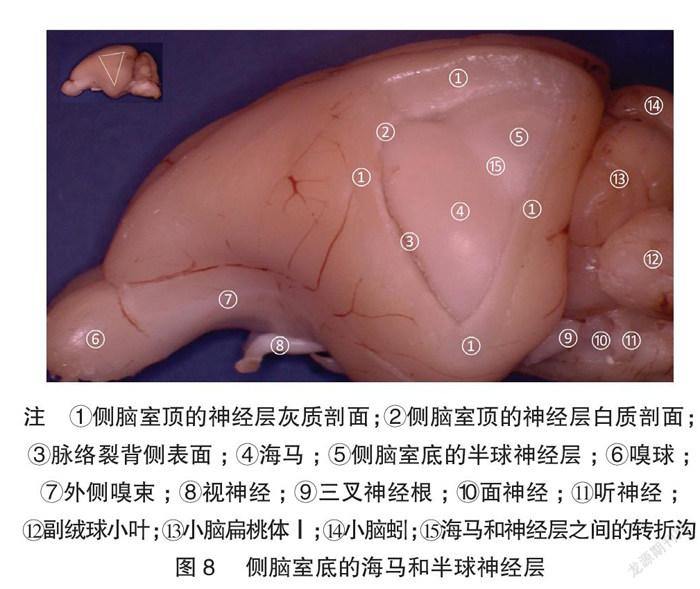
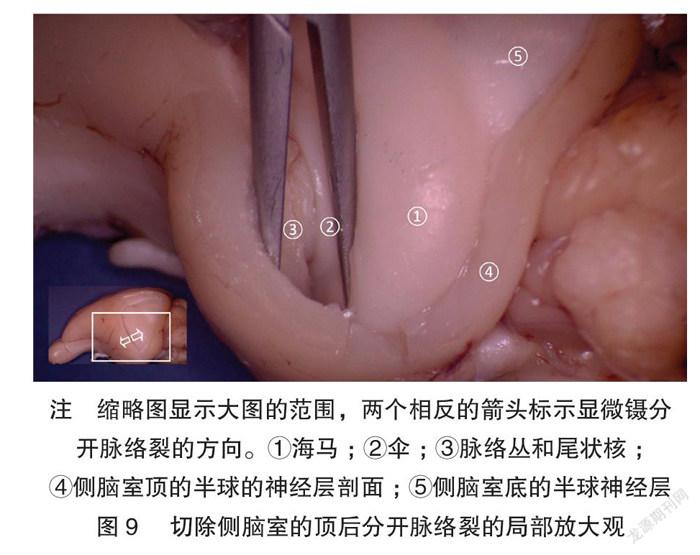
图8~9展示逐步打开侧脑室的顶-半球背外侧的神经层,以展示丘脑-皮层延伸卷曲的层级关系。图10展示了左侧丘脑直接延伸出岛状皮质,而对侧的完整半球对照展示了半球与丘脑的层叠关系。他们之间的胼胝体被浮雕状保留,显示了两侧半球间的联络纤维与丘脑的位置关系。
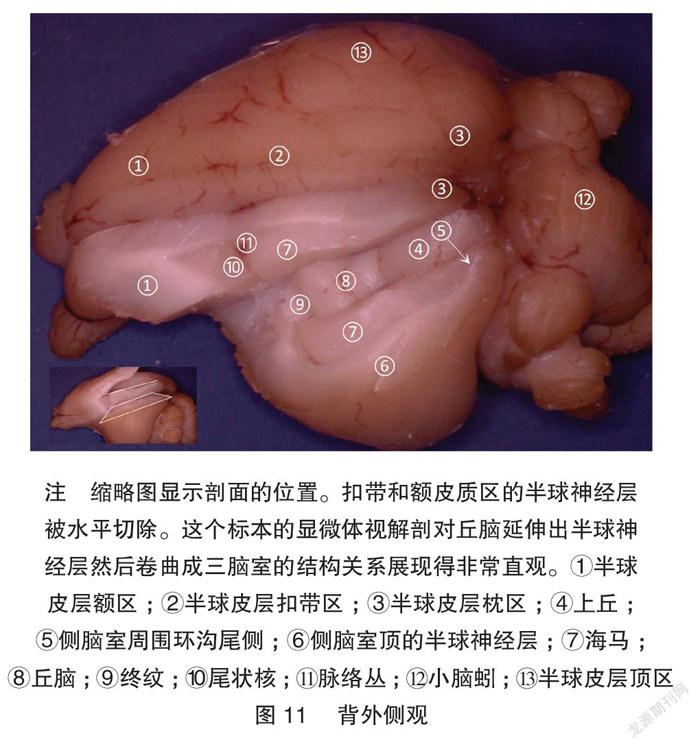
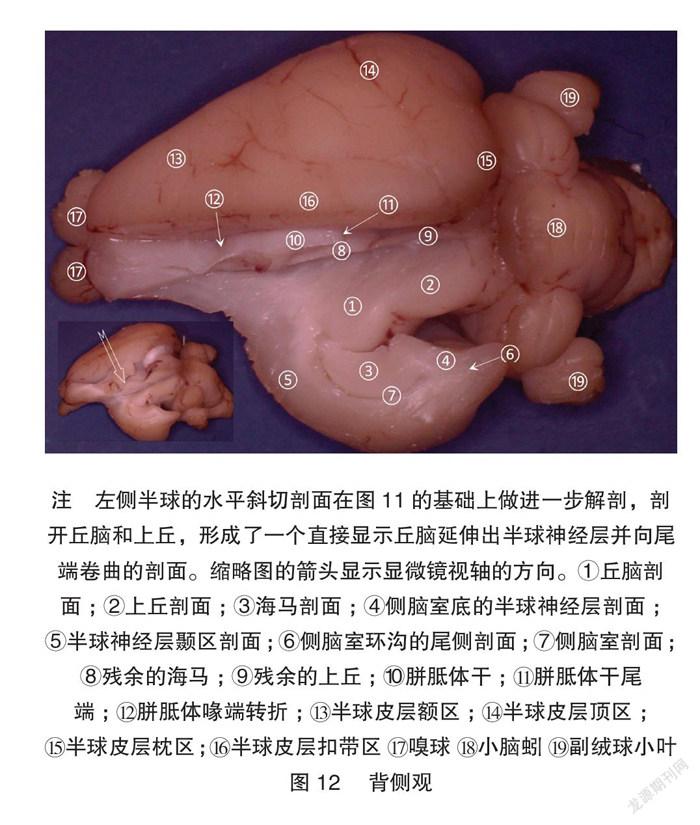
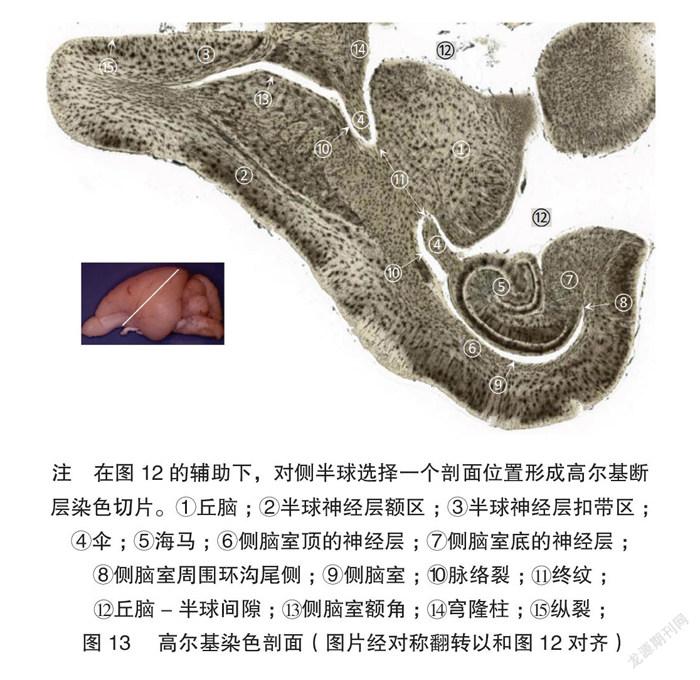
2.3 丘腦-半球剖面的制作
在前面显微体视解剖的观察的参照下,另外一个兔脑被解剖到图11的剖面,进而选择这个剖面制作图12的剖面。该剖面可以完全展示丘脑和皮层的直接延伸关系和他们之间卷曲形成的侧脑室和脑表面间隙,很好地纠正了单纯断层切片对一些三维结构的误解[2]。以这个被选择的剖面做左右对称的镜像指导,在对侧半球进行了组织块切片,进而做高尔基染色。该切片照片很好展示了丘脑-皮层的延伸关系。高尔基染色照片显示,皮层边缘延续为海马和伞,皮层卷曲形成侧脑室,伞分隔了侧脑室和脑表面。见图13。这些单纯切片研究容易误解的结构在显微体视解剖和切片染色的联合展示下得到很好的说明。
3讨论
丘脑-皮层的结构和功能关系[6-8]对神经科学有重要的意义,是理解认知和意识的核心问题[9-19]。正确认识这个结构的三维关系和跨物种演变是脑切片研究神经网络[20-25]机制的基础。然而在临床工作中,那些仅观察脑断层解剖的研究人员,如影像医生,由于较少接触脑三维显微标本,往往会出现对脑三维解剖结构不熟悉或误解的问题。这个问题在其他脊椎动物的切片研究中也普遍存在。目前神经科学各学科已经在迅速融合,如何在各个神经科学亚学科间搭建起桥梁以促进整个大学科的发展从而帮助研究者彻底地理解大脑神经网络?显而易见技术融合的方法是非常行之有效的解决途径。预计丘脑-皮层网络[26]在今后的脑认知和意识机制研究[27-28]中将会占据越来越重要的位置,本研究用显微体视解剖技术联合高尔基切片染色的方法成功制作了一个高尔基切片染色的照片。在这个剖面中,染色是同一次生成的,整个显微染色照片具有非常高的整体性,而且染色片可以进一步局部放大以观察各局部的神经元细节。当然,本研究也有缺陷,如显微体视解剖拍摄对震动要求非常高,体视显微镜摇臂的固有轻微震动稍微影响了显微体视解剖照片的质量。另外切片还可以用除高尔基染色以外的其他染色的方法进行染色,如结晶染色、尼氏染色等,这将会让神经结构更加清楚。
综上所述,显微体视解剖观察是目前较好的脑三维结构观察方法,充分利用显微体视解剖可以制作精美的脑标本并展示三维结构[29-33]。因此,利用三维显微体视解剖技术可以帮助寻找到切片研究所需要的剖面并进行切片染色。在三维显微体视解剖的帮助下,切片显微解剖能在正确理解三维结构的基础上展示神经结构。
[参考文献]
[1] Shibata H,Honda Y.Thalamocortical projections of theanterodorsal thalamic nucleus in the rabbit[J].J Comp Neurol,2012,520(12):2647-2656.
[2] Schneider NY,Datiche F,Coureaud G. Brain anatomyof the 4-day-old European rabbit[J].J Anat,2018,232(5):747-767.
[3] Jzw A,Mmz B,Kmq A,et al.Microscopic anatomicalatlas study on the lateral ventricles of the rabbit cerebrum and its related structures[J].Translational Research in Anatomy,2021:25.
[4] Singh S,Sharma S,BasuS.Rabbit models of dry eyedisease: Current understanding and future needs for translational approaches[J].Experimental Eye Research,2021,206(4):108538.
[5] Shek JW,Wen GY,Wisniewski HM.Atlas of the RabbitBrain and Spinal Cord[M].New York: Karger,1986:2-9.
[6] Butler AB.Evolution of the thalamus: a morphological andfunctional review[J].Thalamus and Related Systems,2008,4(1):35-58.
[7] Penfield W.Mystery of the Mind: A Critical Study ofConsciousness and the Human Brain[M].Princeton,NewJersey:Princeton University Press,1975:15,38.
[8] James WC.心理学原理[M].田平,译.北京:中国城市出版社,2012:16-49.
[9] Min BK.A thalamic reticular networking model ofconsciousness[J].Theoretical Biology and MedicalModelling,2010,7(1):10.
[10] Lorenz,K.DieangeborenenFormenmöglicherErfahrung[J].Ethology,2010,5(2):235-409.
[11] Rust NC ,M ehrpourV.Underst a ndi ng Ima g eMemorability[J].Trends in Cognitive Sciences,2020,24(7):557-568.
[12] Yu Q,Teng C,PostleBR.Different states of priorityrecruit different neural representations in visual workingmemory[J].PLOS Biology,2020,18(6):e3000769.
[13] Thakral PP,Madore KP,Kalinowski SE,et al.Modulation of hippocampal brain networks produces changesin episodic simulation and divergent thinking[J].Proc NatlAcad Sci USA,2020,117(23):12729-12740.
[14] Urgolites ZJ,Wixted JT,Goldinger SD,et al.Spikingactivity in the human hippocampus prior to encodingpredicts subsequent memory[J].Proc Natl Acad SciUSA,2020,117(24):13767-13770.
[15] Eichenlaub JB,Jarosiewicz B,Saab J,et al.Replay ofLearned Neural Firing Sequences during Rest in HumanMotor Cortex[J].Cell Reports,2020,31(5):107581.
[16] Gui P,Jiang Y,Zang D,et al.Assessing the depthof language processing in patients with disorders ofconsciousness[J].Nature Neuroscience,2020,23(6):761-770.
[17] Gazzaniga MS,Ivry RB,Mangun GR.認知神经科学[M].周晓林,高定国,译.北京:中国轻工业出版社,2011:1-14.
[18] Deng J,Zhou H,Lin JK,et al.The ParabrachialNucleus Directly Channels Spinal Nociceptive Signalsto the Intralaminar Thalamic Nuclei, but Not theAmygdala[J].Neuron,2020,107(5):909-923.
[19] Ge Y,Zhou H,Qian C,et al.Adaptation to feedbackrepresentation of illusory orientation produced from flashgrab effect[J].Nature Communications,2020,11(1):1-12.
[20] Lu J,Luo L,Wang Q,et al.Cue-triggered activityreplay in human early visual cortex[J].Science China:Life Sciences,2021,64:144-151.
[21] Chi Z,Kai Q,Wang L,et al.Constraint-Free NaturalImage Reconstruction From fMRI Signals Based onConvolutional Neural Network[J].Frontiers in HumanNeuroscience,2018,12:242.
[22] Moses DA,Leonard MK,Makin JG,et al.Real-timedecoding of question-and-answer speech dialogue usinghuman cortical activity[J].Nature Communications,2019,10(1):3096.
[23] Moses DA,Mesgarani N,Leonard MK, et al.Neuralspeech recognition: continuous phoneme decodingusing spatiotemporal representations of human corticalactivity[J].Journal of Neural Engineering,2016,13(5):56004.
[24] Nishimoto.Decoding human visual cortical activityevoked by continuous time-varying movies[J].Journal ofVision,2010,9(8):667.
[25] Breedlove JL,St-Yves G,Olman CA.et al.GenerativeFeedback Explains Distinct Brain Activity Codes forSeen and Mental Images[J].Current Biology,2020,30(12):2211-2224.
[26] Bao P,She L,Mcgill M,et al.A map of object spacein primate inferotemporal cortex[J].Nature,2020,583:103-108.
[27] Ward LM.The thalamic dynamic core theory of consciousexperience[J].Consciousness and Cognition,2011,20(2):464-486.
[28] Wu JZ,Zhou MM.Neural matrix and its role inpreoperative evaluation of partial epilepsy[J].TranslNeurosci Clin,2017,3(4):246-256.
[29] Ribas EC,Yağmurlu K,de Oliveira E,et al.Microsurgical anatomy of the central core of the brain[J].J Neurosurg,2017,129(3):752-769.
[30] Kaan Y,Vlasak AL,RhotonAL.Three-dimensionaltopographic fiber tract anatomy of the cerebrum[J].Neurosurgery,2015(2):274-305.
[31] Campero A,Ajler P,Emmerich J,et al.Brain sulci andgyri: A practical anatomical review[J].Journal of ClinicalNeuroscience,2014,21(12):2219-2225.
[32] Tanriover N,Rhoton AL Jr,Kawashima M, et al.Microsurgical anatomy of the insula and the sylvianfissure[J].J Neurosurg,2004,100(5):891-922.
[33] Wen HT,Rhoton AL,EvandroDO.Transchoroidalapproach to the third ventricle: an anatomic study ofthe choroidal fissure and its clinical application[J].Neurosurgery,1998,42(6):1205-1217.
(收稿日期:2021-10-09)
