以a7nAChR为靶点治疗急性呼吸窘迫综合征及相关机制
2022-05-02李孟秦王飞杨秋燕黄丹曹小平
李孟秦,王飞,杨秋燕,黄丹,曹小平
(1.川北医学院附属医院急诊医学科;2.南充市第五人民医院骨科,四川 南充 637000)
急性呼吸窘迫综合征(acute Respiratory disease syndrome,ARDS)是由于各种肺内外因素导致的肺毛细血管内皮细胞和肺泡上皮细胞损伤。典型病理改变为弥漫性肺间质和肺泡水肿、肺实变,顽固性低氧血症是典型临床表现[1]。ARDS的发病机制复杂,炎症介导的损伤对其发生发展有重要作用。因此,通过调节炎症反应治疗ARDS一直是临床及基础研究的方向之一,但目前尚无确切有效的药物治疗方法[2]。Th17 细胞是继Th1、Th2 细胞之后适应性免疫应答的又一效应细胞,是典型的促炎因子[3],可诱导IL-6 和TNF-α表达。越来越多的研究[4]发现,胆碱能抗炎途径(CAIP)在肺损伤的调控中发挥重要作用。CAIP是基于迷走神经递质ACh 与免疫细胞的烟碱乙酰胆碱受体(a7nAChR)结合,从而抑制促炎细胞因子的释放[5]。正向调控a7nAChR 可强有力抑制炎症,有应用于治疗炎症性疾病治疗的前景,如炎症性肠病、关节炎、哮喘[6]。胆碱酯酶抑制剂导致的胆碱能神经兴奋能减少链脲霉致糖尿病小鼠脾脏炎症因子合成及Th17 分化[7]。拟胆碱药物α7nACHR 激动剂是否能抑制Th17 反应性,从而减轻ARDS目前尚未见报道。本研究通过临床研究及动物实验探讨a7nAChR激动剂的肺保护作用及可能的机制。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 选取2019年9月至2021年9月川北医学院附属医院急诊医学科收治的44例ARDS患者为研究对象,依据吸烟史分为吸烟组(n=30)和非吸烟组(n=14),两组患者年龄比较差异无统计学意义(P<0.05);依据ARDS基础病因分为肺内-ARDS组(n=31)与肺外-ARDS组(n=13),两组患者在吸烟组与非吸烟组的比例比较,差异无统计学意义(P<0.05)。见表1。纳入标准:依据2012柏林定义诊断为ARDS的男性患者,年龄20~70岁。排除标准:(1)合并免疫缺陷的患者;(2)肺结核活动期、肺癌、COPD等慢性肺部疾病导致急性呼吸衰竭的患者。

表1 患者临床资料比较
1.1.2 实验动物 清洁级6~8周龄C57BL/6J雄性小鼠,体重约20 g。购自川北医学院动物实验中心。
1.1.3 药物、试剂及主要仪器 LPS(索莱宝);SYBR RT-PCR 试剂盒(宝生物工程有限公司);ELISA试剂盒(上海碧云天生物科技有限公司);β-actin 抗体(武汉三鹰生物技术有限公司,中国);兔抗RORγt(Abcam 公司,英国);GTS-21(MCE公司,美国);MLA(MCE公司,美国);choline(Fisher Scientific,美国);α-bungarotoxin(sigma,美国)。YS100 光学显微镜(日本尼康株式会社);JYSCZ2 SDS-PAGE 蛋白电泳仪(北京君意东方电泳设备有限公司);ChemiDocTM XRS凝胶成像系统(BIO-RAD,美国)。
1.2 方法
1.2.1 患者血浆白介素16及17(IL-6、IL-17)、肿瘤坏死因子α(TNF-α)浓度检测 患者入院后24 h内抽取患者外周血,采用 ELISA法检测,操作严格试剂盒说明书进行。
1.2.2 实验动物分组、造模及标本收集 24只小鼠随机分对照组、LPS组、LPS+a7nAChR激动剂组、LPS+a7nAChR抑制剂组,每组各6只。4%水合氯醛(约0.1 mL/10 g)小鼠麻醉后建立ARDS小鼠模型:建立人工气道后,通过气管导管对照组给予等体积 PBS溶液,其余3组小鼠给予缓慢推注 50 μL无菌 LPS 溶液(浓度 1 μg/μL,总量 5 mg/kg)。建立ARDS模型前1 h,LPS+a7nAChR激动剂组小鼠予以腹腔注射choline (10 mg/kg)、LPS+a7nAChR抑制剂组小鼠予以腹腔注射α-bungarotoxin (1 μg/kg),其余两组小鼠给予腹腔注射等体积PBS溶液。在建立ARDS模型后48h水合氯醛麻醉后颈椎脱位法处死小鼠,行支气管肺泡灌洗,收集支气管肺泡灌洗液(BALF)。打开胸腔,剪取肺组织。
1.2.3 肺组织HE染色 分离左上肺组织,10%多聚甲醛固定过夜、包埋、切片、HE 染色。随机选取5个视野观察,并依据美国胸科协会提出的肺损伤评分标准进行评分。
1.2.4 肺湿/干比重检测 取右肺组织,放置于事先称重的EP管中称量肺湿重,再将样本置于 80 ℃ 烤箱 48 h 至恒重后称其干重。然后计算肺湿/干比重。
1.2.5 小鼠炎症因子水平检测 将BALF离心,收集上清液,用ELISA法检测BALF 中IL-17、IL-6、TNF-α水平。
1.2.6 RT-PCR检测 提取左下肺组织RNA,反转录后根据 RT-PCR 试剂盒说明书进行RT-PCR 实验。采用2- ΔΔ Ct法来测定RORγt基因相对表达量,内参为β-actin,重复3次,取平均值。
1.2.7 Western blot检测 提取左下肺组织总蛋白。根据Western blot 试剂盒说明书进行电泳、转膜、封闭,采用抗 anti-RORγt(1∶500)。二抗孵育后成像,计算灰度值。
1.3 统计学分析

2 结果
2.1 吸烟对ARDS患者血浆中IL-17水平的影响
吸烟组ARDS患者血浆中IL-17水平低于非吸烟组,差异有统计学意义(P<0.05)。见图1。

2.2 吸烟对ARDS患者血浆中TNF-α水平的影响
吸烟组ARDS患者血浆中TNF-α水平低于非吸烟组,差异有统计学意义(P<0.05)。见图2。

2.3 吸烟对ARDS患者血浆中IL-6水平的影响
吸烟组ARDS患者血浆中IL-6水平低于非吸烟组,差异有统计学意义(P<0.05)。见图3。

2.4 a7nAChR激动剂减轻LPS导致的小鼠急性肺损伤
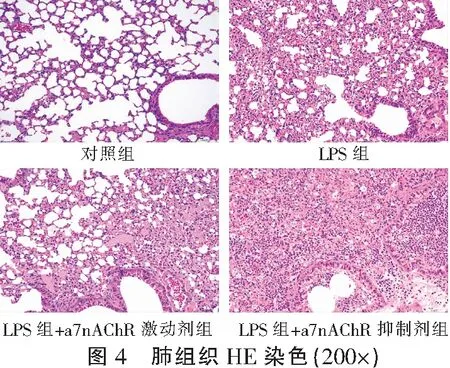
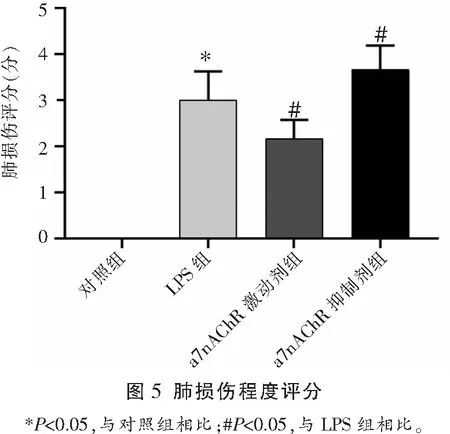
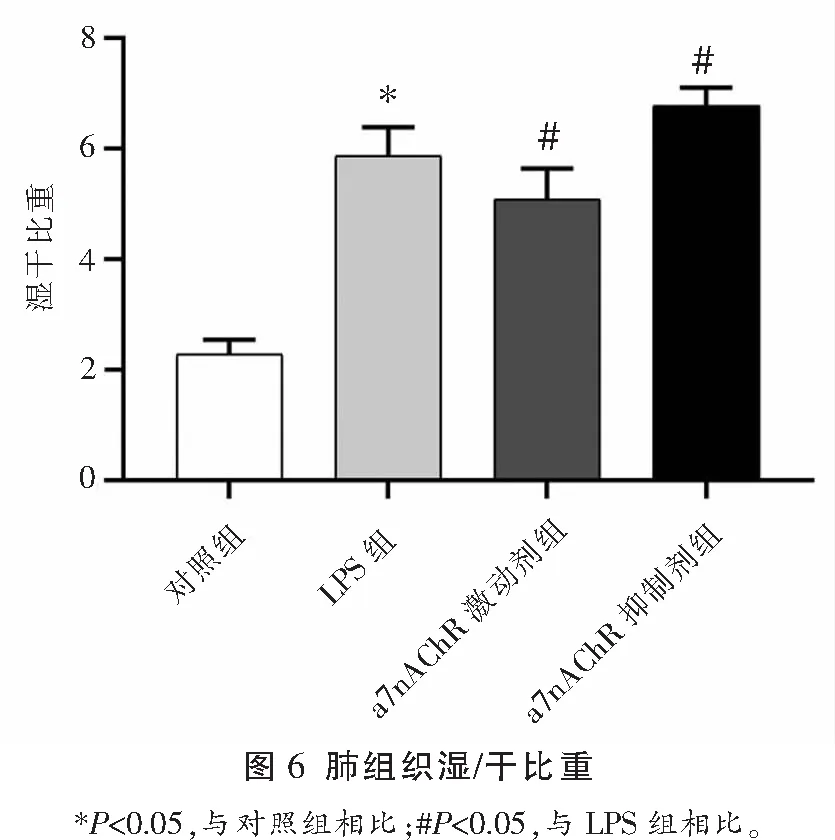
与对照组相比,所有肺损伤小鼠均出现典型的急性肺损伤表现,包括肺泡水肿、肺泡间隔增厚及炎细胞浸润。对照组肺损伤评分低于其余3组(P<0.05),LPS+a7nAChR激动剂组肺损伤评分低于LPS组(P<0.05),LPS+a7nAChR阻断剂组肺损伤评分高于LPS组(P<0.05)。对照组肺组织湿/干比低于其余3组(P<0.05),LPS+a7nAChR激动剂组肺组织湿/干比低于LPS组(P<0.05),LPS+a7nAChR阻断剂组肺组织湿/干比高于LPS组(P<0.05)。见图4、图5及图6。
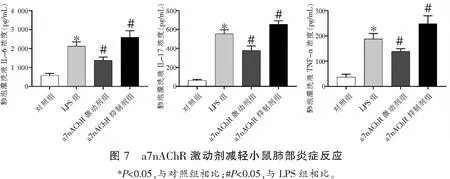
2.5 a7nAChR激动剂减轻小鼠肺部炎症反应
以小鼠支气管肺泡灌洗液(BALF)中炎症因子IL-17、IL-6、TNF-α浓度评价肺部炎症反应水平,结果显示,对照组小鼠BALF中IL-17、IL-6、TNF-α浓度低于其余三组(P<0.05),LPS+a7nAChR激动剂组小鼠BALF中IL-17、IL-6、TNF-α浓度低于LPS组(P<0.05),LPS+a7nAChR阻断剂组小鼠BALF中IL-17、IL-6、TNF-α浓度高于LPS组(P<0.05)。见图7。
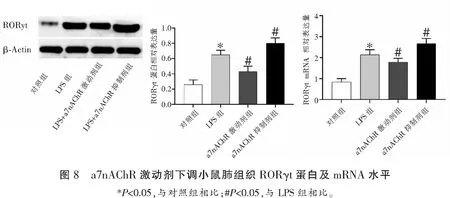
2.6 a7nAChR激动剂下调小鼠肺组织RORγt蛋白及mRNA水平
对照组小鼠肺组织RORγt蛋白及mRNA水平低于其余三组(P<0.05),LPS+a7nAChR激动剂组小鼠肺组织蛋白及mRNA水平低于LPS组(P<0.05),LPS+a7nAChR阻断剂组小鼠肺组织RORγt蛋白及mRNA水平高于LPS组(P<0.05)。见图8。
3 讨论
本研究发现,在男性ARDS患者中,吸烟者与非吸烟者相比,外周血中IL-17、IL-6、TNF-α水平低于非吸烟者(P<0.05)。类似的研究还有炎性肠病患者结肠黏膜中吸烟者比非吸烟者细胞因子水平显著降低[8],Guslandi M发现尼古丁可有效治疗部分炎性肠病患者[9],表明ARDS患者外周血中IL-17、IL-6、TNF-α水平降低可能与烟碱受体兴奋有关。
动物实验研究[10]发现,a7nAChR激动剂可减轻LPS导致的小鼠肺损伤评分及肺组织湿/干比重(P<0.05),而抑制a7nAChR使小鼠肺损伤评分及组织湿/干比重增加(P<0.05),与Ravikumar A.Sitapara等报道一致,提示a7nAChR可能是干预ARDS的重要靶点。炎症反应已被证实在ARDS的发展中有重要作用[11],IL-17、IL-6、TNF-α均为重要的炎症因子。本研究发现,LPS诱导的肺损伤小鼠BALF中炎症因子IL-17、IL-6、TNF-α水平升高(P<0.05),a7nAChR激动剂使其降低(P<0.05),而a7nAChR抑制剂使其升高(P<0.05),与脓毒症的相关研究[12]一致,说明a7nAChR激动剂可能通过下调炎症反应发挥肺保护作用。
Th17细胞已被证实可促进中性粒细胞的募集,发挥强大的促炎作用[13]。IL-17是Th17细胞关键的效应分子之一,是典型的可诱导IL-6和TNF-α表达的促炎细胞因子[14]。抑制Th17可减轻肺部炎症反应[15],而RORγt是调控Th17细胞分化的重要转录因子[16-18]。本研究发现,与对照组相比,肺损伤小鼠肺组织RORγt蛋白及mRNA水平均升高(P<0.05),a7nAChR激动剂可下调肺损伤小鼠肺组织RORγt蛋白及mRNA水(P<0.05),而a7nAChR抑制剂进一步促进其表达(P<0.05),提示兴奋a7nAChR可能通过在转录及翻译水平抑制RORγt表达,从而抑制Th17分化。
综上所述,a7nAChR可能是治疗ARDS的潜在靶点,兴奋a7nAChR可能通过抑制RORγt表达,降低Th17细胞反应性,减轻炎症反应,从而发挥肺保护作用。
