桦树皮中桦木醇重结晶纯化工艺优化
2022-05-01李镕基郑克炜陈海燕
李镕基 郑克炜 陈海燕
(1. 吉林农业大学食品科学与工程学院,吉林 长春 130000;2. 浙江海洋大学食品与药学学院,浙江 舟山 316000;3. 长春科技学院生命科学学院,吉林 长春 130000)
白桦(Betulapubescens.)为耐寒落叶乔木,分布于北亚、北美、北欧的寒带、寒温带地区,在中国东北、华北、西北、西南等地均有生长[1-2]。桦树皮中含有三萜类、挥发油类、鞣质类、甾体类化合物等多种化学成分[3-4],具有清热利湿、镇咳祛痰等功效[5-7],可用于治疗烧烫伤、炎症、疥疮、黄疸、乳痈等疾病,且在降血脂、抗氧化、抗肿瘤、抗病毒等方面表现出了较强的生理活性[8-9]。桦木醇(Betulin)属于羽扇豆烷型的五环烯类化合物,又名白桦脂醇,是一种生物活性因子,在白桦树皮中含量尤为丰富,为白色晶体粉末,熔点256 ℃,难溶于水,易溶于甲醇、乙醇、乙酸乙酯和氯仿等有机溶剂。
李志兴等[10]研究表明,桦木醇对机体体力疲劳具有缓解作用。Chen等[11]研究发现,桦木醇具有较高的抗氧化效果,针对FRAP、DPPH、ABTS等自由基均表现出清除能力。刚小青等[12]通过皮下注射宫颈癌细胞系c4-1建立异种移植瘤模型,经白桦脂醇治疗后发现,桦木醇可提高存活率是因为抑制了裸鼠体内c4-1移植瘤体积的增长。Rzeski等[13]利用体外培养评价桦木醇在人类肿瘤细胞系和原代培养的肿瘤细胞中的抗癌活性,证明了桦木醇在肿瘤细胞培养中具有显著的抗增殖作用。
目前桦木醇的提取方法主要有超临界萃取法、溶剂回流提取法、超声提取法、连续提取法等。丁为民等[14]采用超临界CO2法萃取桦树皮中的桦木醇,当萃取温度为32 ℃、萃取压力为8 MPa、萃取时间为1 h、CO2流量为20 kg/h时,桦木醇得率为16.96%,含量可达74.88%。易金娥等[15]采用甲醇作为溶剂,通过加热回流法,并用碱溶液处理提取物体系,再经减压蒸干,乙醇溶解,过滤后留上层液体,最后经减压浓缩制取样品。殷涌光等[16]采用超声波技术对桦褐孔菌中的桦木醇进行优化提取,当采用丙酮作溶剂时,桦木醇的提取质量比最高为9.868 g/kg。马博玉等[17]采用液泛提取设备对白桦树皮中的桦木醇进行连续提取,从而优化了液泛连续提取桦木醇的工艺条件。肖涵[18]曾采用超声提取法提取桦木醇,提取率为92.6%,而采用索氏提取法可以显著提高桦木醇提取率。
研究拟以长白山地区的白桦树皮为原料,经不同体积分数的乙醇浸提后采用索式提取及无水乙醇重结晶法联合纯化桦木醇,并分析其体外抗氧化活性,旨在为后期桦木醇的研究及相关产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
白桦树皮:经长春科技学院生药教研室鉴定为桦木科桦木属白桦种落叶乔木(Betulapubescens.)的干燥树皮,市售;
大孔吸附树脂:AB-8型,山东东鸿化工有限公司;
甲醇、乙腈:色谱纯,天津市富宇精细化工有限公司;
桦木醇标准品、1,1-二苯基-2-三硝基苯肼、乙醇、香草醛、冰乙酸、抗坏血酸、硫酸亚铁、铁氰化钾:分析纯,上海源叶生物科技有限公司。
1.1.2 主要仪器设备
电子天平:JJ50型,常熟市双杰测试仪器厂;
循环水真空泵:SHZ-D(III)型,邦西仪器科技(上海)有限公司;
电热恒温鼓风干燥箱:GZX-9140MBE型,上海博迅实业有限公司医疗设备厂;
数显恒温水浴锅:HHS-21-6型,上海博迅实业有限公司医疗设备厂;
紫外可见分光光度计:UVmini-1280型,岛津仪器(苏州)有限公司;
超高效液相色谱—电喷雾四级杆串联质谱连用仪:Waters UPLC-Quattro Premier XE型,美国 AquityTM Waters 公司。
1.2 试验方法
1.2.1 桦木醇粗品得率、纯度及综合收率计算 分别按式(1)~式(3)进行计算。
(1)
式中:
P——桦木醇得率,%;
m0——桦树皮粉末重量,g;
m1——容器重量,g;
m2——干燥后桦木醇和容器的重量,g。
(2)
式中:
S——桦木醇纯度;
Sq——桦木醇峰面积;
b——标准曲线截距;
K——标准曲线斜率;
C——配液浓度。
Y=P×50%+S×50%,
(3)
式中:
Y——综合收率,%。
1.2.2 桦木醇提取单因素试验
(1) 乙醇体积分数:固定料液比(m白桦树皮∶V乙醇)1∶30 (g/mL)、提取时间1.5 h、提取温度95 ℃,考察乙醇体积分数(70%,75%,80%,85%)对桦木醇提取率的影响。
(2) 料液比:固定提取时间1.5 h、乙醇体积分数80%、提取温度95 ℃,考察料液比[m白桦树皮∶V乙醇分别为1∶25,1∶30,1∶35,1∶40 (g/mL)]对桦木醇提取率的影响。
(3) 提取温度:固定料液比(m白桦树皮∶V乙醇)1∶30 (g/mL)、乙醇体积分数80%、提取时间1.5 h、考察提取温度(90,95,100 ℃)对桦木醇提取率的影响。
(4) 提取时间:固定料液比(m白桦树皮∶V乙醇)1∶30 (g/mL)、乙醇体积分数80%、提取温度95 ℃,考察提取时间(1.0,1.5,2.0,2.5,3.0 h)对桦木醇提取率的影响。
1.2.3 桦木醇提取工艺响应面法优化试验设计 在单因素试验基础上,根据 Box-Behnken中心组合设计原理[19-21],以桦木醇提取率为响应值,以乙醇体积分数、料液比、提取温度和提取时间为响应因素,进行四因素三水平响应面分析试验。
1.2.4 桦木醇结晶得率计算 将抽滤所得桦木醇结晶于50 ℃干燥5 h,按式(4)计算桦木醇结晶得率。
(4)
式中:
P——桦木醇结晶得率,%;
m0——结晶前桦木醇质量,g;
m1——结晶出的桦木醇质量,g。
1.2.5 桦木醇纯化试验方案 根据1.2.3所得优化提取方案,选择将 15 g干燥的白桦树皮剪成近似1 cm2的方形碎片,用95%乙醇溶液,液固比为50∶1 (mL/g)浸泡120 h,过滤,50 ℃加热回流5 h,减压蒸馏,将液体转移到坩埚中继续蒸干,得初提物,待重结晶备用。
(1) 甲醇—氯仿重结晶法:参照文献[22]的方法并修改。取0.50 g初提物,将提取液减压蒸馏后用乙醇重结晶3次,再用甲醇/氯仿(V甲醇∶V氯仿为1∶1),按V甲醇—氯仿溶液∶m固体=40∶1 (mL/g)进行重结晶,静置过夜,抽滤,得白色针状的桦木醇固体。
(2) 无水乙醇重结晶法:参照文献[23]的方法并修改。取0.50 g初提物,以70 mL乙酸乙酯为溶剂,加热回流90 min,趁热过滤。于坩埚中50 ℃浓缩至干。以无水乙醇为溶剂进行重结晶,V无水乙醇∶m固体=30∶1 (mL/g),-20 ℃重结晶,室温过滤,50 ℃烘干。
(3) 吸附层析法:参照文献[23]的方法并修改。取0.50 g 初提物,用AB-8型大孔吸附树脂吸附层析,使用乙酸乙酯洗脱,洗脱液回收乙酸乙酯至干,加入15倍无水乙醇加热溶解,0 ℃以下冷沉,过滤,干燥。
1.2.6 桦木醇含量测定 采用香草醛—冰乙酸显色法[18]。
1.2.7 桦木醇LC-MS检测
(1) 液相条件:色谱柱为Acquity BEH C18,1.7 μm,2.1 mm×50 mm;流动相A为0.01%甲酸溶液,流动相B为甲醇;柱温45 ℃;流速0.25 mL/min。
(2) 质谱条件:Quattro Premier XE;ESI正离子检测方式;离子对443.7/191.1;脱溶剂温度380 ℃、源温110 ℃、毛细管电压3.00 kV、锥气孔大小80 L/Hr、脱溶剂气大小600 L/Hr。
1.2.8 桦木醇的抗氧化试验
(1) DPPH自由基清除能力:参照金建等[24]的方法。
(2) 羟基自由基清除能力:参照杨艳等[25]的方法。
(3) 总还原力:参照毛跟年等[26]的方法。
1.2.9 数据处理 采用SPSS 17.0软件对试验数据进行分析,采用Origin 8.0 软件对分析后的试验数据进行作图。
2 结果与分析
2.1 桦木醇提取单因素试验
由图1(a)可知,当乙醇体积分数为80%时,桦木醇提取率最高,继续增大乙醇体积分数,桦木醇提取率降低,故选择80%为乙醇最佳体积分数。由图1(b)可知,当料液比为1∶30 (g/mL)时,桦木醇提取率最高,继续增大料液比,桦木醇提取率降低,故选择1∶30 (g/mL)为最佳提取料液比。由图1(c)可知,在试验范围内提取温度对提取率的影响不明显,可能是由于90~100 ℃皆高于乙醇的沸点,乙醇溶液的蒸发速率相差不大,考虑节约能源成本和提取效果,选择95 ℃为最佳提取温度。由图1(d)可知,当索氏提取时间为1.5 h时,桦木醇的提取率最高,时间过长可能会导致除目标物以外的其他成分也会被提取出来,因此最佳提取时间设定为1.5 h。

图1 各因素对桦木醇提取率的影响Figure 1 The influence of various factors on the extraction rate of betulin
2.2 响应面法优化桦木醇提取工艺
2.2.1 试验设计与结果 在单因素试验基础上,以乙醇体积分数、料液比、提取温度和提取时间为影响因素,以桦木醇提取率为响应值,利用Design-Expert 10软件进行响应面回归分析,优化桦木醇提取工艺。试验因素水平设计见表1,试验设计与结果见表2,方差分析见表3。
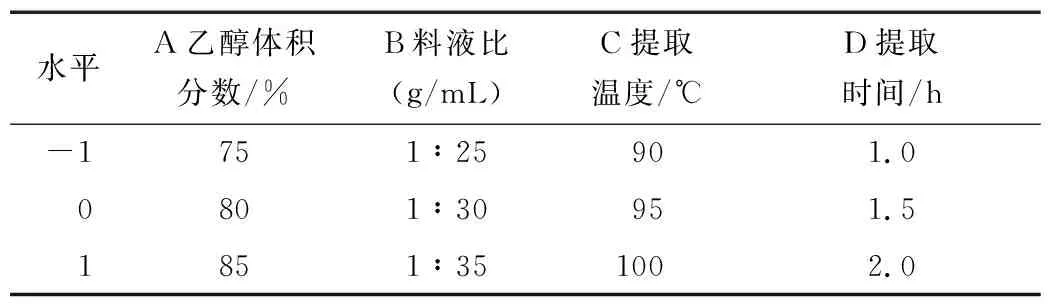
表1 响应面试验因素水平表Table 1 Response surface test factor level table

表2 桦木醇提取响应面试验设计及结果Table 2 Response surface test design and results of betulin extraction scheme

表3 回归模型方差分析†Table 3 Analysis of variance of regression model
应用Box-Behnken试验设计原理对表2数据进行处理,得二次多元回归方程:
Y=66.02+1.38A-0.061B+2.14C+1.04D+2.50E-0.03AB-0.90AC+0.83AD-1.53BC+0.024BD-0.40CD-3.37A2-2.81B2-4.27C2-5.40D2。
(5)

2.2.2 响应曲面分析 由图2可知,各因素交互作用对桦木醇提取率均有一定影响,其中以提取温度和料液比的交互作用所形成的曲面相对陡峭,表明其对试验结果的影响最为显著,与方差分析结果一致。
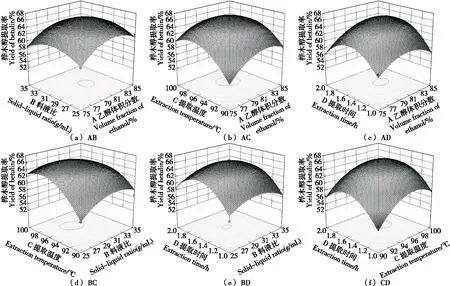
图2 各因素相互作用对桦木醇提取率的影响Figure 2 The influence of various factors on the extraction rate of betulin
2.2.3 验证实验 经响应面分析优化的最佳工艺参数为乙醇体积分数80.928%、料液比1∶29.621 (g/mL)、提取温度96.199 ℃、提取时间1.551 h,此时桦木醇提取率为66.455%。考虑实际操作的可行性,将工艺参数修正为乙醇体积分数80%、料液比1∶30 (g/mL)、提取温度95 ℃、提取时间1.5 h,实测桦木醇提取率为66.21%,与预测值较接近,证明此优化方案可行,在实际应用中具有可操作性。
2.3 桦木醇的重结晶方法比较
由表4可知,甲醇—氯仿重结晶法得到的白色针状固体为0.04 g,重结晶率为 8%。大孔吸附树脂层析法得到的奶白色固体粉末为0.19 g,重结晶率为38%。无水乙醇重结晶法得到的白色粉末状固体为0.40 g。重结晶率为80%。

表4 桦木醇初提物重结晶的产量及产率Table 4 Yield and yield of recrystallization of the initial extract of betulin
2.4 样品中桦木醇鉴定
采用LC-MS方法对所提取的桦木醇样品进行检测,结果见图3。
由图3可知,桦木醇样品色谱出峰时间为6.12 min,峰面积为749,与其他成分所形成的峰完全分离,通过与桦木醇标品对比可知,样品中含有目标物桦木醇。

图3 桦木醇样品LC-MS检测图Figure 3 LC-MS detection of betulin samples
2.5 桦木醇的抗氧化活性
2.5.1 DPPH自由基清除能力 由图4可知,当桦木醇溶液质量浓度为0.2~0.6 mg/mL时,其对DPPH自由基的清除率逐渐增加,当桦木醇溶液质量浓度>0.6 mg/mL时,其对DPPH自由基的清除效果不再显著提升。与维生素C对DPPH自由基的清除能力相比而言,桦木醇溶液同样也表现出了较强的清除效果。

图4 桦木醇对DPPH自由基的清除作用Figure 4 DPPH radical scavenging effect of betulin
2.5.2 羟基自由基清除能力 由图5可知,当桦木醇溶液质量浓度为0.2 mg/mL时,其对羟基自由基无清除效果,但随着桦木醇质量浓度的增大,其对羟基自由基的清除作用逐渐增强。桦木醇的抗氧化性可能是桦木醇与自由基相结合,阻止了自由基的链式氧化反应。

图5 桦木醇对羟基自由基的清除作用Figure 5 Hydroxyl radical scavenging effect of betulin
2.5.3 总还原力 由图6可知,随着桦木醇质量浓度的增加,溶液的吸光度值逐渐上升,但上升趋势较为缓慢。在试验质量浓度范围内,维生素C的总还原能力强于桦木醇。

图6 桦木醇的总还原力Figure 6 Results of total reducing power of betulin
3 结论
白桦树皮中桦木醇的最佳提取工艺为乙醇体积分数80%、料液比1∶30 (g/mL)、提取温度95 ℃、提取时间1.5 h,在此条件下桦木醇提取率为66.21%。以无水乙醇为溶剂进行重结晶,V无水乙醇∶m固体=30∶1 (mL/g),-20 ℃重结晶,重结晶产率可达80.00%,最高纯度达99.81%。抗氧化试验表明,桦木醇具有较强的总抗氧化活性,但总还原能力及对羟基自由基、DPPH自由基清除能力均低于维生素C。后续可进一步探究混合溶剂重结晶对桦木醇纯度的影响,同时从生物活性角度,探究其体内抗氧化活性及抗衰老能力,并对其作用机制进行深入研究。
