红茶菌菌相分析及优势菌的分离与鉴定
2022-05-01徐素云李佳佳王艳萍耿伟涛
徐素云 李佳佳 方 伟 王艳萍 耿伟涛
(天津科技大学食品工程与生物技术学院,天津 300457)
红茶菌是一种历史悠久的民间传统发酵茶饮料,是以糖、茶、水为原料,经醋酸菌、酵母菌和乳酸菌等多种微生物共同自然发酵而成,口感宜人,富含茶多酚、有机酸等多种活性功能成分,营养丰富[1]。目前红茶菌发酵多使用天然混菌体系家庭式发酵,其菌相组成复杂,菌种差异较大,导致发酵后的红茶菌品质不稳定[2],发酵菌种的确定是关键因素。在菌相学分析方面,红茶菌中可能出现的优势菌主要包括三大类:醋酸菌、酵母菌及乳酸菌[3]。其中又以醋酸菌和酵母菌更为常见,且不同产地来源的红茶菌其菌相组成有所不同,代谢产物也不一样,因此想要实现工业化生产,还需进一步对菌种进行基础研究。
研究拟以河南济源地区民间流传的红茶菌为原料,采用传统分离培养技术,对红茶菌发酵液中可培养微生物进行分离鉴定,同时,采用高通量测序技术对红茶菌菌相进行测序和菌相组成分析,一方面可系统了解红茶菌中微生物多样性及菌相结构,另一方面可为丰富微生物菌种资源库及实现红茶菌的工业化生产提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原辅材料与试剂
绿茶:杭州明杭茶叶有限公司;
蔗糖:河南金润食品添加剂有限公司;
DNA Marker Taq酶、dNTP、引物、琼脂糖、细菌基因组DNA提取试剂盒、酵母基因组DNA提取试剂盒:天根生化科技(北京)有限公司。
1.1.2 菌种及培养基
红茶菌母液菌种:河南中沃实业有限公司;
MRS培养基、Elliker培养基、YPD培养基:天津市江天化工技术有限公司;
溴甲酚紫显色培养基:天津市博迪化工有限公司。
1.2 仪器与设备
恒温培养箱:HT-400B型,上海赫田科学仪器有限公司;
台式高速冷冻离心机:Sorvall ST 8R型, 美国Thermo fisher Scientific公司;
凝胶成像采集分析系统:Gel Doc XR+型,美国伯乐BIO-RAD公司;
扩增仪:ETC 811 PCR型,上海珂准仪器有限公司;
显微镜:YS100型,日本 Nikon 公司;
超净工作台烘箱:HF safe 900型,杭州旭众机械设备有限公司;
酶标仪:Multiskan GO型,美国Thermo公司;
电泳仪:DYY-6D型,北京市六一仪器厂。
1.3 试验方法
1.3.1 红茶菌发酵液制备 将10 g绿茶放入刚煮沸的开水中浸泡10 min,用纱布过滤后加入80 g蔗糖,用蒸馏水定容至1 000 mL,分装于食品级玻璃瓶中,90 ℃水浴10 min。冷却后按体积分数8%接种量将红茶菌母液接种于茶汤中,常温发酵12 d,得到pH值为2.3~2.9的红茶菌发酵液。
1.3.2 采用16S rDNA和ITS高通量分析红茶菌中微生物组成 选择红茶菌发酵液作为样品进行微生物菌相探究,试验分为细菌16S rDNA和真菌ITS测序,由广州基迪奥生物科技有限公司完成。
(1) DNA 提取及扩增:采用基因组提取试剂盒提取总DNA。以20~30 ng DNA为模板,细菌选择V4~V5 区通用扩增引物 341F 和806 R 的16S rDNA 基因进行扩增[4];真菌选择引物 ITS1F和ITS2的ITS 区进行PCR扩增试验[5-7],引物设计见表1。
(2) 生物信息学分析:
① 序列处理与优化:通过 Illumina Miseq 高通量测序平台整理原始数据,采用QIIME软件检查及剔除嵌合体序列[8]。
② Alpha多样性分析:根据最低的测序深度,随机重复提取OTU丰度矩阵中的所有样本,并使用QIIME软件计算每个样本的生物多样性,主要包括Shanno、Simpson、Chao1、Ace指数等[9]。
③ 分类信息分析:通过RDP classifier软件对各样品中OTU依次进行门、纲、目、科、属水平的分类统计。
1.3.3 红茶菌中醋酸菌、乳酸菌、酵母菌的筛选与鉴定
(1) 菌株初筛:参照王洁琛等[10-11]的方法略作修改。将红茶菌发酵液依次稀释为10-5,10-6,10-7浓度的样品,涂布至不同分离培养基上,观察菌落特征及菌株个体形态,初步区分菌种的差异和类别。在溴甲酚紫显色培养基上挑选有明显菌落形态、革兰氏染色阴性和过氧化氢酶试验阳性的菌株,初步视为醋酸菌;在MRS及Elliker培养基上挑选有明显菌落形态、革兰氏染色阳性和过氧化氢酶试验阴性菌株,初视为乳酸菌;在YPD培养基上挑选具有明显菌落形态特征,镜检个体较大的菌株,初步视为酵母菌。
(2) 分子生物学鉴定:参照陈宠等[12]的方法,并将PCR扩增产物送至广州基迪奥生物有限责任公司进行测序,其测序结果上传NCBI数据库进行BLAST在线比对分析。
1.3.4 数据统计分析 采用 SPSS 16.0 和 Origin 8.5 软件分析和处理数据。
2 结果与讨论
2.1 红茶菌中细菌和真菌群落多样性及其组成
2.1.1 细菌及真菌Alpha多样性 由表2可知,红茶菌中细菌及真菌的Coverage值均达到99.9%以上,表明样本测序结果可以反映样品的真实情况,即此次取样是合理的。此外,红茶菌中细菌的Shannon、Simpson、ACE、Chao1指数和OTU数量均极显著大于真菌(P<0.01),表明细菌群落丰富度与多样性大于真菌,与徐伟等[4]的结果一致。

表2 Alpha多样性†Table 2 Alpha diversity
2.1.2 细菌的微生物组成 由图1(a)可知,在门水平下,从红茶菌发酵液中共鉴定出5个细菌门,其中变形菌门(Proteobacteria)相对含量占绝对优势,相对丰度高达99.20%,其次为厚壁菌门(Firmicutes),相对丰度为0.54%,其他菌门总体丰度为0.07%左右。因此,在门水平下,可以确定变形菌门为优势菌。由图1(b)可知,在纲水平下,共鉴定出5个细菌纲,其中丰度最高的是α-变形菌(Alphaproteobacteria),相对丰度为99.20%左右,其次为芽孢杆菌纲(Bacilli),相对丰度为0.50%,其他菌纲总体丰度在0.07%左右,表明α-变形菌纲为优势菌。由图1(c)可知,在目水平下,共鉴定出5个细菌目,丰度最高的是醋酸菌目(Acetobacteralesc),相对丰度为99.20%,其次是乳杆菌目(Lactobacillales),含量占0.48%,还有少量的拟杆菌目(Bacteroidales)、梭杆菌目(Fusobacterium)和栖热菌目(Thermales)(共占0.07%左右),表明目水平下醋酸菌目及乳杆菌目为优势菌。由图1(d)可知,在科水平下,共鉴定出6个细菌科,丰度最高的是醋酸菌科(Acetobacteraceae)占92.20%,其次是乳杆菌科(Lactobacillaceae)、明串珠菌科(Leuconostocaceae),分别占0.45%,0.03%,还有少量的拟杆菌科(Bacteroidaceae)、梭杆菌科(Fusobacteriaceae)、栖热菌科(Thermaceae)(共占0.05%左右),表明科水平下醋酸菌科和乳杆菌科为优势菌。由图1(e)可知,在属水平下,共鉴定出7个细菌属,丰度最高的是驹形氏杆菌(Komagataeibacter)占97.85%,其次是醋酸杆菌属(Acetobacter)、乳杆菌属(Lactobacillus)分别占1.23%,0.43%,还有少量的明串株菌属(Leuconostoc)、拟杆菌属(Bacteroides)、鲸杆菌属(Cetobacterium)、亚栖热菌属(Meiothermus)(总体丰度为0.08%左右),表明驹形氏杆菌属、醋酸杆菌属和乳酸杆菌属为优势菌,与Xia等[2]结果相似。驹形氏杆菌多为专性好氧菌,可产生细菌纤维素,且产酸能力强,在工业上常用于生产醋酸[13]。醋酸杆菌对有机酸及挥发性风味物质的形成至关重要。乳酸杆菌属是红茶菌发酵液中常见的优势菌属,能使红茶菌口感更柔和饱满,促进挥发物质酯类、酸类、醇类等物质的产生[14]。因此,将红茶菌细菌群落在门、纲、目、科、属水平下的组成关系绘制成图(见图2)。
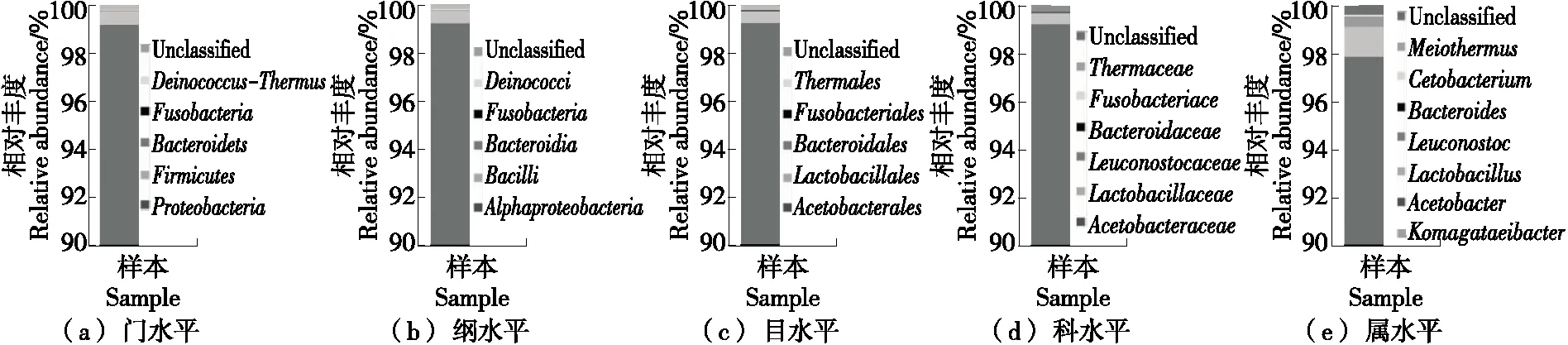
图1 各水平下细菌群落的相对百分含量Figure 1 Relative percentage of bacterial community at each level
由图2可知,红茶菌发酵液的细菌菌落组成中,主要为驹形氏菌属(97.85%)、醋酸菌属(1.23%)和乳酸菌属(0.43%),其中驹形氏菌属和醋酸菌属均属于变形菌门,并且是变形菌门的两大主要菌属;乳杆菌属属于厚壁菌门,在厚壁菌门中所占相对比例达79.6%。
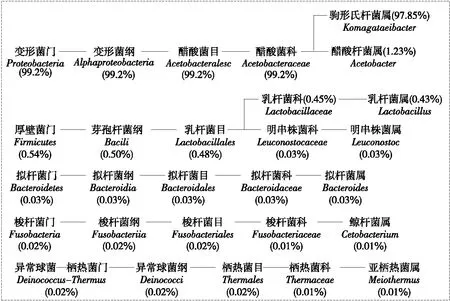
图2 细菌群落组成关系Figure 2 Microbial community composition of bacteria
2.1.3 真菌的微生物组成 由图3可知,在门水平下,子囊菌门(Ascomycota)的丰度最高,占92.87%,为门水平下的优势菌。子囊菌门是真菌中最大的一个门,相对于其他真菌而言,子囊菌门结构复杂,因此称为高等真菌;在纲水平下,酵母纲(Saccharomycetes)的丰度最高,占92.04%,其次为粪壳菌纲(Sordariomycetes),占0.001%,表明酵母纲为优势菌;在目水平下,酵母目(Saccharomycetales)的丰度最高,占92.04%,其次为粪壳菌(Sordariales)占0.001%,可认为酵母目为目水平下的优势菌。粪壳菌目多含有各种腐败菌,可能是传统自然发酵红茶菌中不良的杂菌,可对风味产生不良影响,与王春龙[15]结果相似;在科水平下,丰度最高的是酵母科(Saccharomycetaceae),占71.5%,其他未鉴定菌科总体丰度为20.55%左右;在属水平上,丰度最高的是德克酵母属(Dekkera)占42.1%,其次是接合酵母属(Zygosacchaormyces)占29.42%,其他未识别的属占20.74%,可认为德克酵母属、接合酵母属为优势菌。酿酒酵母和接合酵母是传统发酵制品中最常用的菌种,也是产生酒精及各种挥发性风味物质的主要菌种,在发酵过程中,两种酵母均能够产生酯类、高级醇类和酸类等挥发性化合物[16]。因此,将红茶菌真菌群落在门、纲、目、科、属水平下的组成关系绘制成图(见图4)。

图3 各水平下真菌群落的相对百分含量Figure 3 The relative percentage of microorganisms at the various level
由图4可知,传统红茶菌发酵液的真菌菌落构成中,德克酵母属和接合酵母属为主要优势菌属,且均属于酵母菌纲。

图4 真菌群落组成关系Figure 4 Microbial community composition of fungus
2.2 红茶菌中优势菌的分离与鉴定
2.2.1 醋酸菌的筛选与鉴定 通过溴甲酚紫平板筛选试验、过氧化氢酶试验、革兰氏染色试验及菌落个体形态观察,初步筛选出7株具有典型形态的菌株,其菌落特征和镜检形态观察如图5所示,特征描述见表3。
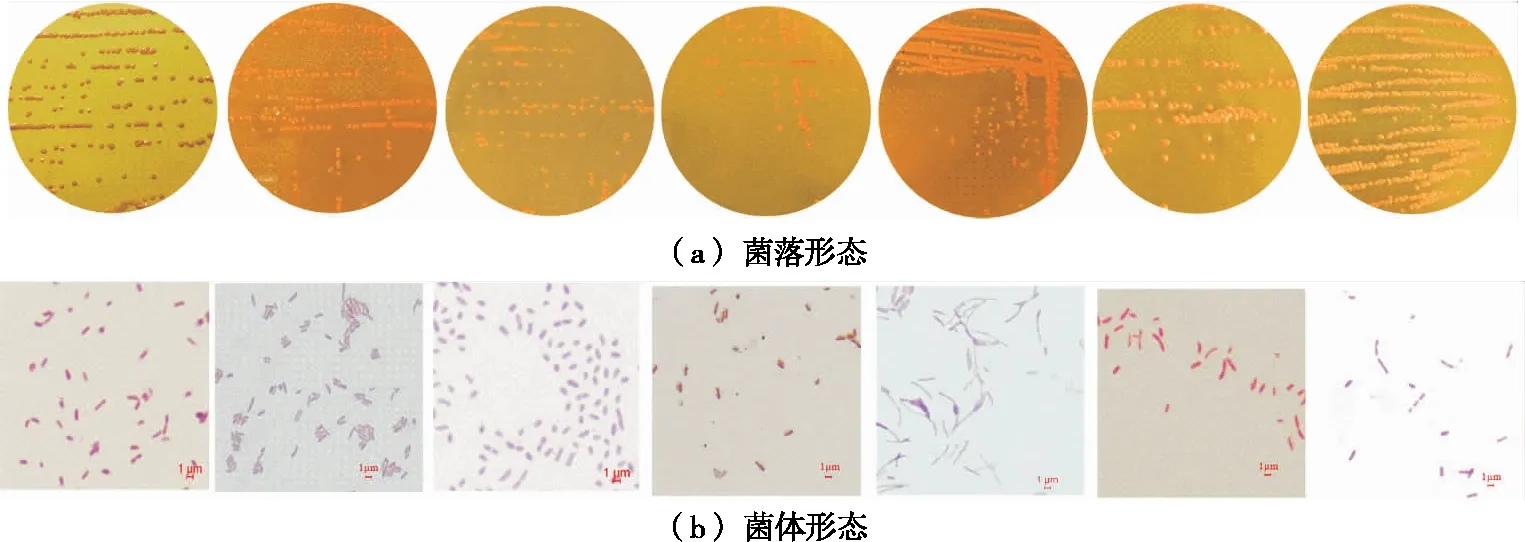
从左至右依次编号为1478,1480,1506,1508,1510,1512,1514图5 各菌株的菌落及菌体形态Figure 5 Bacterial colonies and individual morphology of each strain

表3 醋酸菌的菌落形态和镜检形态的特征描述Table 3 The described of colony morphology and microscopic morphology of acetic acid bacteria
由图6可知,扩增产物电泳带均明亮单一,其片段长度均为1 500 bp左右。将7株菌株的测序结果上传NCBI数据库进行BLAST 在线比对发现,菌株1478与食糖驹形氏杆菌(Komagataeibactersaccharivorans)比对相似度为98%,菌株1480与腐烂苹果醋酸杆菌(Acetobactermalorum)比对相似度为99%,菌株1506/1508/1512/1514与木驹形氏菌(Komagataeibacterxylinus)比对相似度均为100%,菌株1510与醋酸杆菌属(Acetobacter)比对相似度为100%。结合醋酸菌落形态、个体形态分析,参考细菌鉴定手册,可以鉴定菌株1478为食糖驹形氏杆菌、1480为腐烂苹果醋酸杆菌、1506/1508/1512/1514为木驹形氏菌醋酸菌、1510为醋酸杆菌属。7株菌大致分为4个种2个属,与高通量研究结果吻合,表明试验分离出的菌株为优势菌株,其中1506/1508/1512/1514木驹形氏菌的产酸能力、产膜能力较强,1478食糖驹形氏杆菌的代谢糖能力强且能产生很多风味物质,1510醋酸杆菌经常被用来酿造食醋[17-18]。
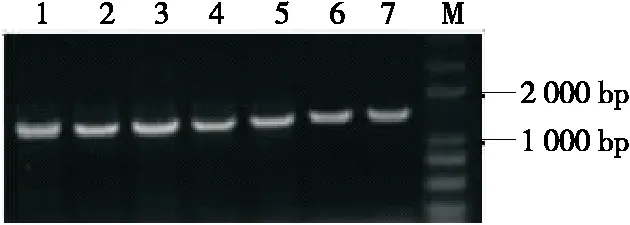
M为DNA Marker;1~8依次为菌株1478、1480、1506、1508、1510、1512和1514的扩增产物图6 PCR产物电泳图Figure 6 Electrophoresis of PCR products
2.2.2 酵母菌的筛选与鉴定 通过对红茶菌发酵液中真菌的分离筛选,挑选出3株疑似酵母菌株,其菌落特征和镜检形态观察如图7所示,特征描述见表4。
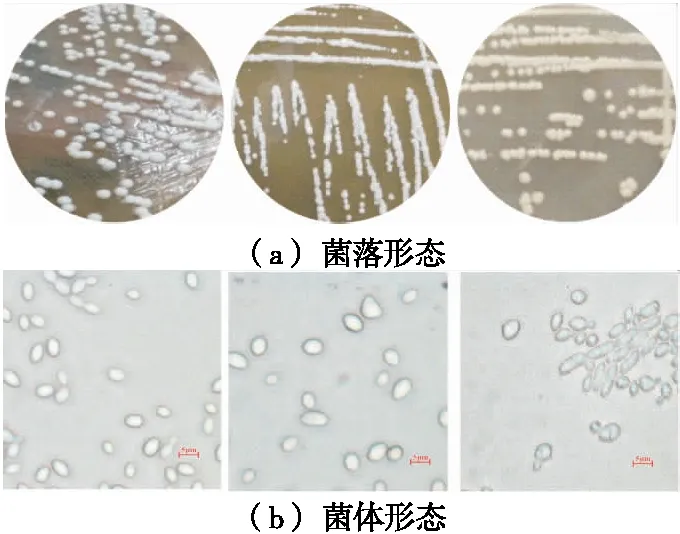
从左至右依次编号为1482,1484,1486图7 各菌株的菌落及菌体形态Figure 7 Bacterial colonies and individual morphology of each strain

表4 酵母菌落形态和镜检形态的特征描述Table 4 Cellular and colonial morphology of yeast
由图8可知,扩增产物电泳带均明亮单一,其片段长度均为600 bp左右。将3株菌株的测序结果上传NCBI数据库进行BLAST 在线比对发现, 菌株1482、1484与拜耳接合酵母(Zygosaccharomycesbailii)比对相似度均为100%,菌株1486与布鲁塞尔德克酒香酵母(Dekkerabruxellensis)比对相似度为98%。结合酵母菌落形态、个体形态分析,参考真菌鉴定手册,可以鉴定筛选的目的酵母菌1482及1484为拜耳接合酵母、1486为布鲁塞尔德克酒香酵母。分离出的3株菌大致分为接合酵母属和德克酵母属2个属,与高通量研究结果相吻合,再一次证明了分离出的菌株为优势菌株,其中菌株1482及1484为拜耳接合酵母,被应用于各种发酵制品如酒类、醋类,其代谢能力强,菌株风味好[19];菌株1486酿酒酵母因代谢乙醇能力强,常被用作酿酒菌种[20]。
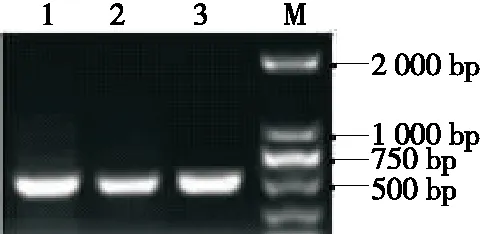
M为DNA Marker;1~3依次为菌株1482、1484和1486的扩增产物图8 PCR产物电泳图Figure 8 Electrophoresis of PCR products
2.2.3 乳酸菌的筛选与鉴定 从MRS及Elliker培养基中筛选能使溴甲酚紫—乳粉培养基变黄,革兰氏阳性,过氧化氢接触酶阴性的菌株,初步筛选出一株菌落干燥,较小,圆形,边缘整齐,低凸起,白色,镜检为短杆的菌株,其菌落特征和镜检形态观察如图9所示。
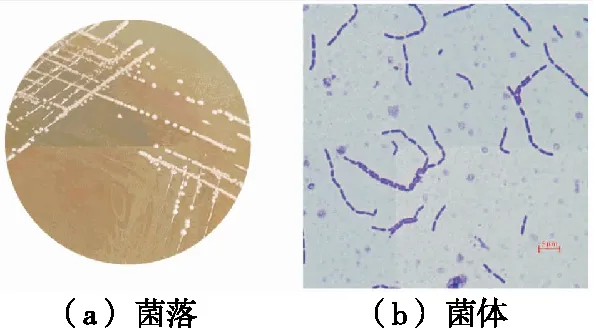
图9 菌株1298的菌落、菌体形态图Figure 9 Morphology of bacterial colonies and bacteria of strain 1298
由图10可知,扩增产物电泳带均明亮单一,其片段长度均为1 500 bp左右。将菌株的测序结果上传NCBI数据库进行BLAST 在线比对发现,菌株1298与植物乳杆菌(Lactobacillus.plantarum)的同源性为99%。结合乳酸菌落形态、个体形态分析,参考细菌鉴定手册,可以鉴定筛选的目的乳酸菌1298为植物乳杆菌,与高通量研究结果相吻合,表明分离出的菌株为优势菌株。植物乳杆菌是红茶菌发酵液常见优势菌株,具有产乳酸、丁酸等特性[21-22]。
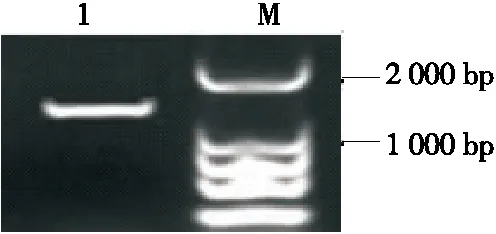
M为DNA Marker;1为菌株1298扩增产物图10 PCR产物电泳图Figure 10 Electrophoresis of PCR products
3 结论
采用16S rDNA和ITS高通量分析了红茶菌发酵液中微生物组成。高通量测序结果表明:细菌群落丰富度与多样性大于真菌。细菌中驹形氏杆菌(Komagataeibacter)、醋酸杆菌属(Acetobacter)和乳杆菌属(Lactobacillus)为优势菌株;真菌中德克酵母属(Dekkera)和接合酵母属(Zygosacchaormyces)为优势菌株。通过传统平板分离法得到醋酸菌7株,分别为食糖驹形氏杆菌1478(Komagataeibactersaccharivorans1478)、腐烂苹果醋酸杆菌1480(Acetobactermalorum1480)、木驹形氏菌1506/1508/1512/1514(Komagataeibacterxylinus1506/1508/1512/1514)、醋酸杆菌属1510(Acetobacter1510);酵母菌3株,分别为拜耳接合酵母1482/1484 (Zygosaccharomycesbailii1482/1484)和布鲁塞尔德克酒香酵母1486(Dekkerabruxellensis1486);乳酸菌1株,为植物乳杆菌1298(Lactobacillus.plantarum1298)。后续需对优势菌株性能进行深入研究。
