小檗碱对佐剂诱导型类风湿性关节炎大鼠OPG-RANKL 的作用研究
2022-04-30臧金鹏
韩 丹,臧金鹏
(1.三亚市中医院中药房,海南 三亚 572000;2.三亚市中医院特色诊疗部,海南 三亚 572000)
类风湿关节炎(RA)是一种自身免疫性疾病,表现为滑膜增生异常、细胞侵袭以及软骨和骨骼的逐步破坏,会导致关节破坏、僵硬、畸形和致残。非甾体类抗炎药、糖皮质激素和缓解疾病的抗风湿药等传统疗法可以减轻类风湿关节炎症状,但长期使用这些药物会导致许多不良反应,如肝肾功能不全、胃肠反应等[1-2]。
骨保护素(OPG)/核因子κB 配体(RANKL)和核因子-κB(NF-κB)信号通路与类风湿关节炎的病理发展密切相关[3]。OPG/RANKL 信号调节系统在骨骼代谢和破骨细胞形成中起着至关重要的作用[4]。NF-κB 是调节炎症和免疫反应的重要转录因子,对类风湿关节炎至关重要,研究发现通过抑制NF-κB 信号传导途径,可以改善类风湿关节炎患者和实验动物的炎症反应、滑膜细胞增殖和关节损伤[5]。小檗碱是一种异喹啉类生物碱,是多种草药的主要生物活性成分之一,具有抗炎、抗氧化、抗动脉粥样硬化、抗微生物、抗糖尿病、抗肿瘤和神经保护作用[6-7]。研究发现小檗碱可通过抑制TNF-α、IL-6和MCP-1 的产生,下调环氧合酶2(COX-2)的表达,减少PGE2 的生成抑制炎症,另外通过核因子-kB(NF-κB)和有丝分裂原激活的蛋白激酶(MAPK)信号级联反应抑制MMP-2 和MMP-9 的表达[8-9]。本研究探究了小檗碱对实验性类风湿关节炎大鼠的作用,并探究了相关机制。
1 材料与方法
1.1 试剂 小檗碱(B832574,纯度 ≥97%)购自上海麦克林生化科技有限公司(中国);白介素(IL,Interleukin)-1β、IL-6 和肿瘤坏死因子(Tumor necrosis factor,TNF)-α 大鼠ELISA 试剂盒购自达科为生物技术有限公司(中国);p-IκBα 和p-p65 购自Santa 生物公司(美国);RANKL、OPG 和GAPDH 一抗均购自CST 生物公司(美国)。
1.2 动物 Sprague Dawley 大鼠,SPF 级,25 只,雄性,购自海南医学院实验动物中心,饲养于12 h 光照/12 h黑暗更替的SPF 级动物房,适应1 周,自由饮食和饮水,所用动物试验均经过我院伦理委员会的批准和同意。
1.3 佐剂诱导型关节炎(adjuvant-induced arthritis,AIA)大鼠模型 根据之前文献描述建立AIA 大鼠模型[10],向SD 大鼠的左后爪足垫注射100 μL 含有10 mg/mL 结核分枝杆菌完全弗氏佐剂(complete Freund’s adjuvant,CFA)。对照组大鼠注射100 μL 生理盐水,然后将大鼠随机分为5 组(每组n=5):对照组(生理盐水的正常大鼠),模型组(生理盐水的AIA 大鼠),低剂量组(20 mg/kg小檗碱的AIA大鼠),中剂量组(40 mg/kg 小檗碱的AIA 大鼠),高剂量组(60 mg/kg 小檗碱的AIA 大鼠)。从首次造模开始,灌胃给予小檗碱或生理盐水,每天1 次,连续28 d。
1.4 足肿胀、关节炎评分 从首次造模开始,每4 d利用排水法测量左后爪体积,即足肿胀,直至第28 d。根据之前文献报道[10],从第12 d 开始,每4 d 进行一次关节炎评分,评分标准如下:0 表示无红斑或肿胀迹象;1 表示脚趾红斑或肿胀;2 表示爪子肿胀发红;3 表示严重的红肿和踝关节肿胀;4 表示所有脚指和整个腿部严重肿胀,无能力承受体重,每只大鼠的总分是4 只爪子评分的综合,最大值16。
1.5 酶联免疫吸附试验(ELISA)第28 天,从眼眶后静脉穿刺收集血液样品,并在4 ℃以5 000 r/min 离心20 min 分离血清。根据制造商操作说明采用商用ELISA 试剂盒测定血清IL-6、TNF-α 和IL-1β 的含量。将50 μL 样品稀释液和50 μL 待测血清添加到ELISA包被的板中,然后将100 μL 酶试剂添加到上述混合溶液中,并在37 ℃下孵育60 min。洗涤板后,将50 μL 显影剂A 和50 μL 显影剂B 混合加入板中,将板在37℃黑暗中孵育15 min,用酶标仪在450 nm 下测量吸光度。根据标准曲线,计算IL-6、TNF-α 和IL-1β 的浓度。
1.6 组织病理检测 大鼠处死后,收集后爪关节并立即固定于多聚甲醛(4%)溶液24 h,然后置于10%乙二胺四乙酸(EDTA)脱钙,每周更换1 次,连续4 周,脱钙后,乙醇梯度脱水,二甲苯洗涤,并包埋于石蜡中。最后,切成5 μm 薄片,用苏木精-伊红染色,并用光学显微镜观察拍照。关节组织评分标准[11]:0 表示关节周围无炎性细胞浸润;1 表示炎性细胞浸润最小;2表示轻微浸润;3 表示中度浸润;4 表示重度浸润。
1.7 蛋白印迹(Western blot,WB)分离大鼠的滑膜组织,加入蛋白裂解液,并在4 ℃下以15 000 g 离心15 min 分离上清液,然后通过BCA 对其进行定量。通过应用6%~10% SDS 聚丙烯酰胺凝胶电泳分离蛋白质,然后转移到聚偏二氟乙烯(PVDF)膜,用脱脂奶粉室温封闭90 min。随后,p-IκBα、p-p65、RANKL、OPG和GAPDH一抗(按1:1 000稀释)于4 ℃孵育过夜。然后,与HRP 标记的二抗于室温孵育90 min,用ECL试剂盒检测蛋白条带,并使用图像分析软件image lab 5.1 分析。
1.8 统计学分析 使用GraphPad Prism 7.0 软件进行统计分析,计量数据以均数±标准差()表示,采用单向方差分析(ANOVA)进行多组间统计学分析。
2 结果
2.1 小檗碱对AIA 大鼠足肿胀和关节炎评分的影响 足肿胀结果表明,与对照组比较,模型组大鼠的足体积从第4 d 开始明显增加,第12 d 有所缓解,但依然大于对照组,持续至试验结束;较模型组,给予小檗碱治疗后,AIA 大鼠的足肿胀明显缓解,并且具有剂量依赖性,数据详见图1A。关节炎评分结果表明,与对照组比较,从第12 d 开始,模型组大鼠的关节炎评分明显升高,第20 d 达到最大,持续至试验结束;较模型组,给予小檗碱治疗后,AIA 大鼠的关节炎评分明显下降,并具有剂量依赖性,数据详见图1B。
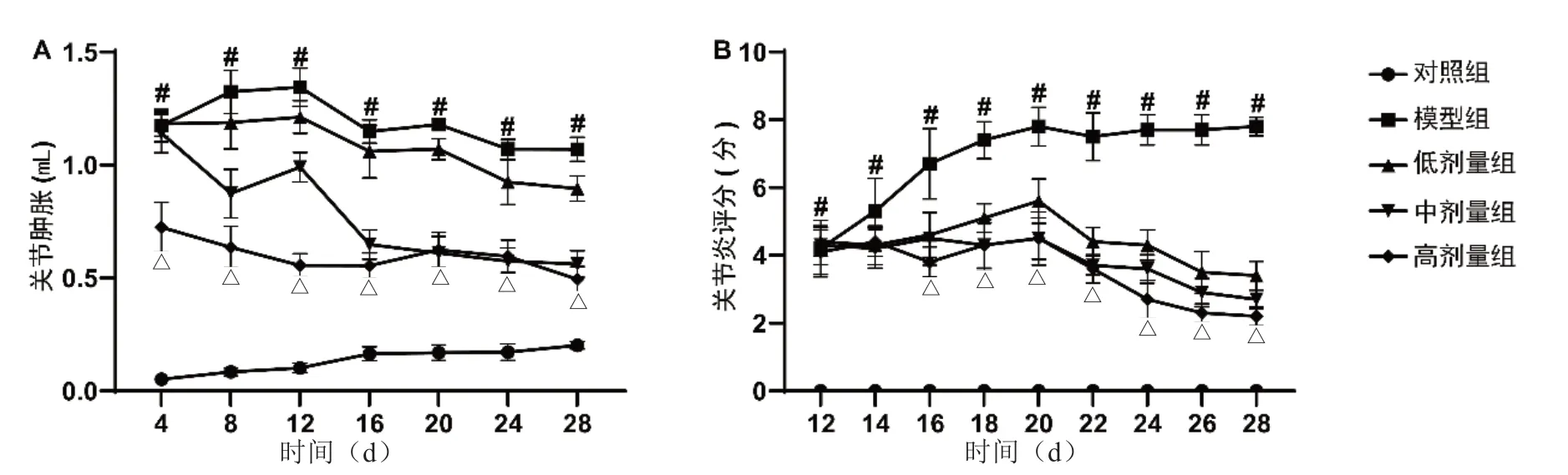
图1 小檗碱对AIA 大鼠足肿胀和关节炎评分的影响
2.2 小檗碱对AIA 大鼠血清中炎症因子的影响 如图2 显示,与对照组比较,模型组大鼠血清中炎症因子IL-1β、IL-6 和TNF-α 的含量显著升高,差异有统计学意义;但较模型组,小檗碱治疗后,AIA 大鼠血清中IL-1β、IL-6 和TNF-α 的含量显著降低,呈剂量依赖性,差异有统计学意义,详见图2。
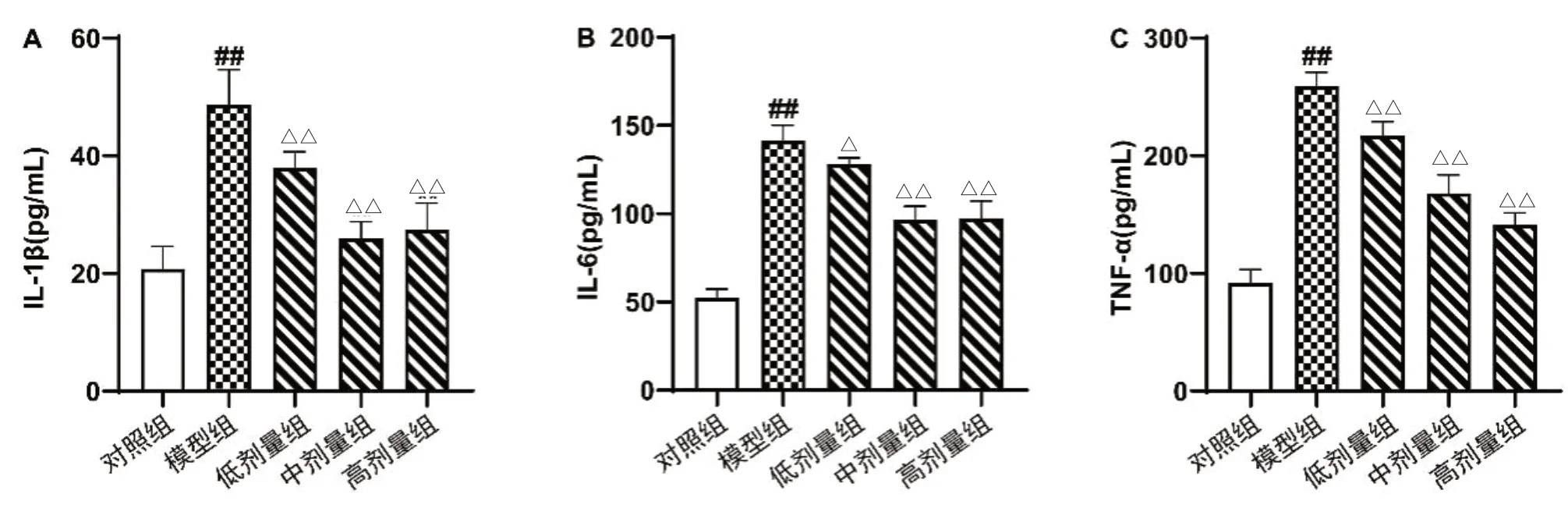
图2 小檗碱对AIA 大鼠血清中炎症因子的影响
2.3 小檗碱对AIA 大鼠踝关节病理损伤的影响 如图3 显示,对照组大鼠踝关节病理显微照片,关节腔清晰可见,无异常;模型组大鼠出现大量的炎性细胞浸润、滑膜组织增生、关节腔狭窄和血管痉挛;给予小檗碱治疗后,AIA 大鼠的病理明显改善,尤其是高剂量组可明显改善炎性细胞浸润和滑膜增生。
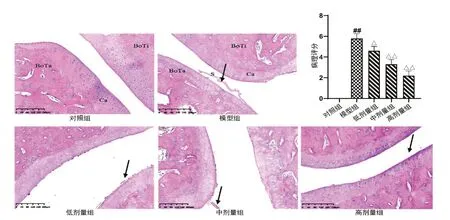
图3 小檗碱对AIA 大鼠踝关节病理损伤的影响
2.4 小檗碱对AIA 大鼠OPG/RANKL/NF-κB 信号的影响 如图4 所示,与对照组比较,模型组大鼠组织中p-IκBα、p-p65 和RANKL 的蛋白表达显著升高,但OPG 表达下降;较模型组,小檗碱治疗后,AIA 大鼠组织中p-IκBα、p-p65 和RANKL 的蛋白表达显著降低,OPG 表达升高,呈剂量依赖性,详见图4。
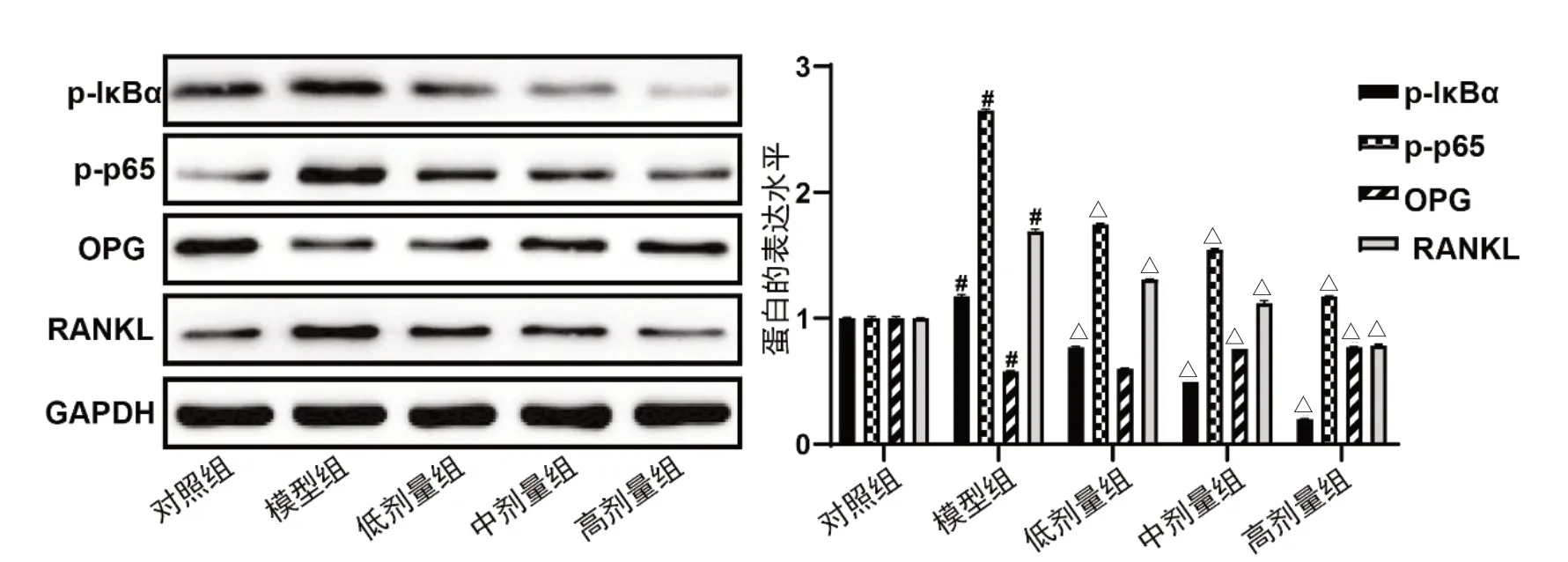
图4 小檗碱对AIA 大鼠OPG/RANKL/NF-κB 信号的影响
3 讨论
小檗碱是一种异喹啉生物碱,广泛存在于多种植物中,包括黄连、黄芦木、黄柏等,具有抗炎、抗氧化、抗动脉粥样硬化等多种生物学活性。AIA 大鼠模型广泛应用于评估抗风湿药和类风湿关节炎的研究,是最常见的动物模型之一,其临床和组织学特征与人类类风湿关节炎相似。因此,本研究首先建立了AIA 大鼠模型,发现与对照组比较,模型组大鼠表现为关节肿胀和关节炎评分明显升高,血清炎症因子IL-1β、IL-6和TNF-α 升高,这些说明本研究成功建立了AIA 大鼠模型。
临床上,类风湿关节炎患者主要表现为关节肿胀及运动障碍,AIA 大鼠表现关节肿胀,但给予小檗碱治疗后,AIA大鼠的关节肿胀和关节炎评分明显缓解。X 线和关节炎指数是判断类风湿关节炎患者严重程度的重要参考[11],本研究也发现AIA 大鼠的关节炎评分增加,类风湿关节炎患者表现为滑膜组织炎性细胞浸润、滑膜细胞增殖等,本研究也发现AIA 大鼠表现了炎性细胞浸润、滑膜组织增生、关节腔狭窄和血管痉挛等类风湿关节炎特征,小檗碱治疗后,AIA 大鼠的上述变化均出现缓解。
机体免疫紊乱与类风湿关节炎的病理发展密切相关,促炎性细胞因子由免疫细胞产生,可以引起持续的慢性炎症并驱动类风湿关节炎的发展[12-13]。TNF-α由单核细胞、T 细胞和巨噬细胞产生,通过激活白细胞、滑膜成纤维细胞、破骨细胞、内皮细胞并抑制调节性T 细胞的功能,导致炎症和骨侵蚀,TNF-α 在炎症反应中具有重要作用[14]。IL-6 也是由多种免疫细胞产生的,可以激活白细胞、破骨细胞和内皮细胞,促进滑膜成纤维细胞的增殖,并且在某些方面类似于TNF-α。IL-1β 有助于T 细胞的分化,也可以激活软骨细胞和破骨细胞,其活化和产生主要与NLRP3 炎性小体介导的信号有关[15]。本研究发现AIA 大鼠血清中炎症因子IL-1β、IL-6 和TNF-α 明显升高,说明机体出现了免疫紊乱和炎症反应,但给予小檗碱治疗后,炎症因子含量明显下降。另外,有研究发现小檗碱对Treg/Th17 平衡的改善作用,这表明小檗碱可以调节AIA 大鼠脾脏T 细胞的分化[16]。这些说明了小檗碱对AIA 大鼠的关节炎症状改善与调节免疫稳态和炎症反应有关。
NF-κB 转录因子在调节炎症和免疫反应中具有重要作用。据报道,动物模型和类风湿关节炎患者的滑膜组织出现了NF-κB 激活和产生[17]。在正常生理条件下,NF-κB 与NF-κB 抑制剂蛋白IκB 结合形成无活性复合物,位于细胞质中。病理条件下,IκB 激酶的抑制剂(IKKa/IKKβ)通过RANKL 与RANK 结合而被激活,随后IκB 被磷酸化,然后降解并与NF-κB 分离。然后,NF-κB 转录因子被激活并转移到细胞核,其靶基因被激活以表达许多炎症介质和细胞因子,如IL-10,IL-1β,TNF-α,IL-6,IFN-γ 和IL-17 等[18]。另外,NF-κB 激活也是一种炎症介质正反馈的结果,这种反馈机制引起了类风湿关节炎炎症的维持和进展以及结构破坏[19]。本研究发现AIA 大鼠的NF-κB 信号激活,但小檗碱抑制了AIA 大鼠NF-κB 信号。此外,NF-κB转录因子在破骨细胞生成和RANKL 诱导的骨吸收中起关键作用[20],这表明小檗碱对骨组织代谢也具有调节作用。
OPG/RANKL/RANK 是骨组织代谢的重要信号调节系统,并在骨吸收和破骨细胞的分化和成熟中起关键作用[21]。RANKL 是受体RANK 或OPG 的配体,主要表达于成骨细胞/基质细胞表面。在成熟的破骨细胞或前体破骨细胞中,RANKL 与RANK 结合可促进破骨细胞的生成和骨吸收[22]。OPG 由成骨细胞/基质细胞产生,通过与RANKL 结合并随后抑制RANKRANKL 相互作用,强烈阻止破骨细胞的分化和骨吸收。因此,认为OPG/RANKL 是类风湿关节炎治疗的标志物。临床发现类风湿关节炎患者OPG/RANKL 比率低与骨骼吸收增强有关[23]。本研究发现小檗碱降低了AIA 大鼠RANKL 的表达,增加OPG 的产生,并增加OPG/RANKL 的比例,这说明小檗碱的抗类风湿关节炎活性与OPG/RANKL/RANK 介导的骨稳态有关。
综上所述,本研究首先建立了AIA 大鼠模型,为后续小檗碱的干预研究提供了基础。进一步发现,小檗碱可以缓解AIA 大鼠的关节炎症状,并且与NF-κB介导的免疫稳态和OPG/RANKL/RANK 介导的骨稳态有关。但小檗碱对NF-κB 和OPG/RANKL/RANK 信号的调节是否是直接作用,仍需进一步探究。
