肠黏膜通透性改变与肝硬化患者Child-Pugh分级及预后的关系分析
2022-04-29黄茂辉
黄茂辉
(上饶市人民医院感染科,江西 上饶 334000)
肝硬化是临床上高发的一种慢性进行性肝病,该病是由一种或多种病因长期或反复作用诱发形成。肝硬化患者常伴有乏力腹胀、肝脾大、蜘蛛痣等症状,若病情未得到有效控制,病情进展至晚期,将显著增加上消化道出血、感染肝炎、自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)等并发症的发生风险[1]。其中SBP在肝硬化晚期患者中最常见,易导致患者发生肝性脑病、肝肾综合征等危重病症,在短期内增加患者病死率。肠黏膜通透性(intestinal permeability,IP)改变是导致SBP 发生的主要因素,因此,IP 改变可能与肝硬化患者Child-Pugh 分级及预后存在一定的关联性。但目前临床上关于IP 改变与肝硬化患者Child-Pugh 分级及预后关系的研究较少[2]。基于此,本研究回顾性分析2019 年7 月至2020 年7 月本院收治并完成随访的60 例肝硬化患者的临床资料,旨在分析IP改变与肝硬化患者Child-Pugh 分级及预后的关系,以指导临床预测肝硬化病情进展和患者预后情况,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2019 年7 月至2020 年7月本院收治并完成随访的60例肝硬化患者的临床资料,其中男39例,女21例;年龄48~75岁,平均年龄(61.77±5.29)岁;体重指数(body mass index,BMI)16.5~25.5 kg/m2,平均BMI(21.08±2.11)kg/m2;文化程度:初中及以下18 例,高中或中专25 例,大专及以上17 例。本研究已通过本院伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:肝硬化判定标准参照《内科学》[3]制定,且经肝穿刺活检证实;临床资料完整;精神正常、认知功能正常、有自主意识;患者知情同意并签署知情同意书。排除标准:心、肺、肾等主要脏器功能不全或发生病变;恶性肿瘤;慢性肝炎、血液病、血吸虫病;合并中重度感染或传染性疾病;重度高血压、糖尿病、贫血。
1.3 方法
1.3.1 IP 改变的相关血清指标测定 所有患者均于入院后次日清晨空腹时采集外周静脉血5 ml,全血抗凝,应用上海市聚慕医疗器械有限公司,型号Min1524 的离心机进行离心处理,10 000 r/min 离心10 min,分离上清液并移至无菌冻存管内,置于-76 ℃环境中冷冻备用。应用安徽安昌生物技术有限公司提供的肠道屏障功能生物化学指标分析系统及试剂盒测定血清二胺氧化酶(diamine oxidase,DAO)、D-乳酸、内毒素水平,测定方法为酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)。
1.3.2 肝硬化Child-Pugh分级方法 回顾性分析所有肝硬化患者的临床资料,并根据肝硬化患者的血清胆红素、肝性脑病、血清清蛋白水平、腹水、凝血酶原时间(prothrombin time,PT)进行Child-Pugh分级,将上述指标的不同状态分为3 个层次并依次计1分、2分、3 分,将5 项指标计分相加,分值5~15 分,将患者的肝脏储备功能依据Child-Pugh 评分结果分为A 级、B 级、C 级3 个等级,其中A 级为5~6 分,手术危险度低,预后最佳,1~2 年存活率为85%~100%;B 级为7~9 分,手术危险度中等,1~2 年存活率为60%~80%;C 级为10~15 分,手术危险度较高,预后最差,1~2 年存活率为35%~45%[4]。
1.3.3 预后不良判定 肝硬化患者临床症状、肝功能损伤及腹水情况加重,且相关并发症增加或恶化。
1.4 统计学方法 采用SPSS 25.0软件进行数据处理,计量资料均经Shapiro-Wilk正态性检验,符合正态分布的计量资料以“±s”表示,3组间比较采用单因素F分析,两两比较采用SNK-q检验;采用一般线性双变量Pearson直线相关性检验IP改变与肝硬化患者Child-Pugh分级的相关性,采用Logistic回归分析检验IP 改变对肝硬化患者预后的影响,以P<0.05为差异具有统计学意义。
2 结果
2.1 肝硬化患者Child-Pugh分级情况 60例肝硬化患者中A 级占比60.00%(36/60),B 级占比30.00%(18/60),C级占比10.00%(6/60)。
2.2 不同Child-Pugh 分级肝硬化患者IP 相关指标比较 C 级患者血清DAO、D-乳酸、内毒素水平及Child-Pugh 评分均高于B 级、A 级,B 级患者血清DAO、D-乳酸、内毒素水平、Child-Pugh 评分均高于A级,差异有统计学意义(P<0.05),见表1。
表1 不同Child-Pugh分级肝硬化患者IP相关指标比较(±s)Table 1 Comparison of IP-related indexes in patients with cirrhosis of different Child-Pugh grades(±s)
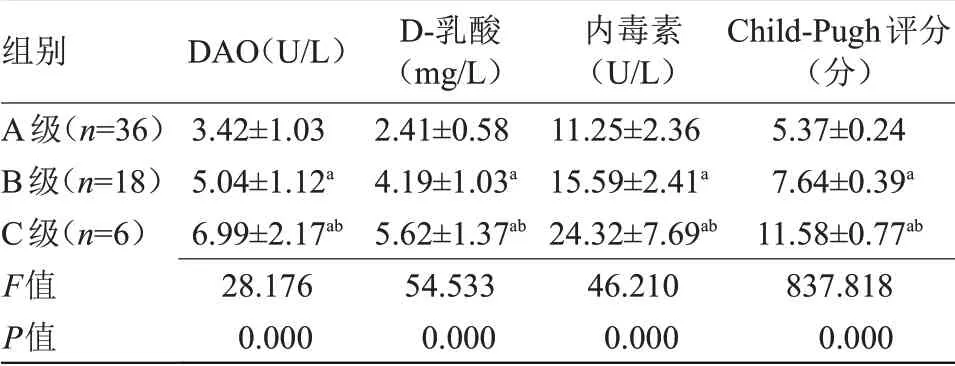
表1 不同Child-Pugh分级肝硬化患者IP相关指标比较(±s)Table 1 Comparison of IP-related indexes in patients with cirrhosis of different Child-Pugh grades(±s)
注:DAO,二胺氧化酶。与A级比较,aP<0.05;与B级比较,bP<0.05
组别A级(n=36)B级(n=18)C级(n=6)F值P值DAO(U/L)3.42±1.03 5.04±1.12a 6.99±2.17ab 28.176 0.000 D-乳酸(mg/L)2.41±0.58 4.19±1.03a 5.62±1.37ab 54.533 0.000内毒素(U/L)11.25±2.36 15.59±2.41a 24.32±7.69ab 46.210 0.000 Child-Pugh评分(分)5.37±0.24 7.64±0.39a 11.58±0.77ab 837.818 0.000
2.3 IP 改变相关指标与肝硬化患者Child-Pugh 分级的相关性 血清D-乳酸、DAO、内毒素水平与肝硬化患者Child-Pugh 分级呈正相关(r>0,P<0.05),见表2。
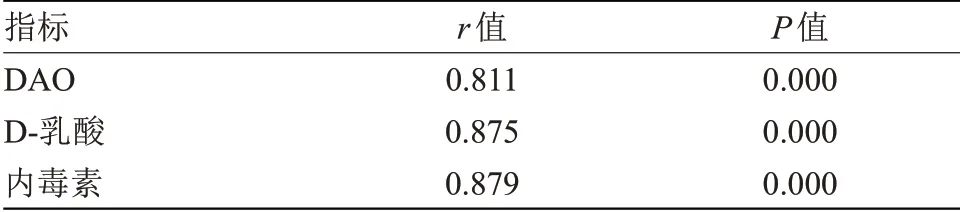
表2 IP改变相关指标与肝硬化患者Child-Pugh分级的相关性Table 2 Correlation of IP change-related indexes and Child-Pugh classification in patients with liver cirrhosis
2.4 肝硬化患者预后不良发生情况 60 例肝硬化患者中预后不良12例,占比20.00%。
2.5 不同预后肝硬化患者IP 相关指标比较 预后不良肝硬化患者血清DAO、D-乳酸、内毒素水平均高于预后良好患者,差异有统计学意义(P<0.05),见表3。
表3 不同预后肝硬化患者IP相关指标比较(±s)Table 3 Comparison of IP-related indicators in patients with liver cirrhosis with different prognosis(±s)
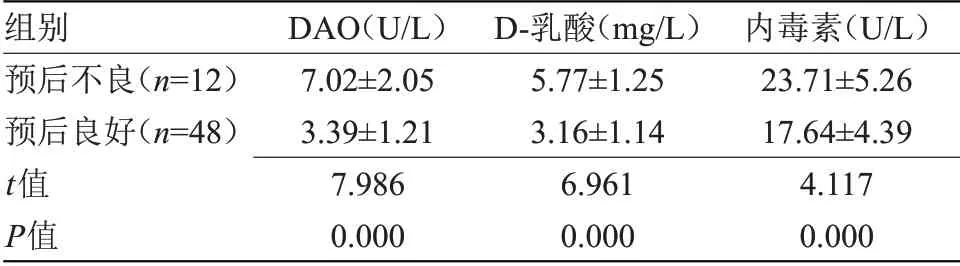
表3 不同预后肝硬化患者IP相关指标比较(±s)Table 3 Comparison of IP-related indicators in patients with liver cirrhosis with different prognosis(±s)
注:DAO,二胺氧化酶
组别预后不良(n=12)预后良好(n=48)t值P值DAO(U/L)7.02±2.05 3.39±1.21 7.986 0.000 D-乳酸(mg/L)5.77±1.25 3.16±1.14 6.961 0.000内毒素(U/L)23.71±5.26 17.64±4.39 4.117 0.000
2.6 IP 改变对肝硬化患者预后的影响 将肝硬化患者预后情况作为因变量(1=预后不良,0=预后良好),血清DAO、D-乳酸、内毒素水平作为自变量,经Logistic 回归分析证实,血清DAO、D-乳酸、内毒素水平升高是肝硬化患者预后不良的危险因素(OR>1,P<0.05),见表4。
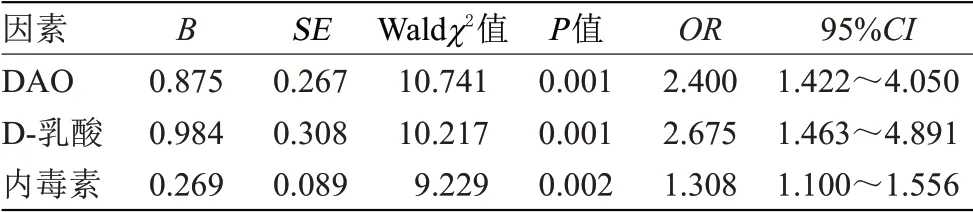
表4 IP改变对肝硬化患者预后的影响Table 4 Effects of IP changes on the prognosis of patients with liver cirrhosis
3 讨论
肝硬化的诱发病因和发病机制与病毒性肝炎、循环障碍、酒精中毒、营养障碍等因素密切相关。肝硬化发病较为隐匿且病程进展缓慢,大部分患者早期并无明显症状,易被患者忽略,致使病情延误,进展至失代偿期,易增加患者各种并发症发生风险,其中肠黏膜屏障系统损伤为临床上最常见的一种并发症。肝硬化患者常伴有不同程度的门静脉高压,致使患者的肠道循环系统功能出现障碍,肠黏膜也出现水肿、充血、糜烂情况,显著降低肠黏膜修复能力,提高肠黏膜通透性,致使肠道内细菌移位,增加SBP、肠源性内毒素血症等并发症的发生风险,而此类并发症又会加重肠黏膜损伤及细菌移位,对肝脏造成持续损害,加速肝硬化病情进展,形成恶性循环,影响肝硬化患者病情严重程度及预后,致使机体多脏器功能出现障碍或衰竭,严重影响肝硬化患者的生存质量[5]。
本研究结果显示,60 例肝硬化患者中A 级36例,B级18例,C级6例;C级患者血清D-乳酸、DAO、内毒素水平、Child-Pugh评分均高于B级、A级,B级患者血清D-乳酸、DAO、内毒素水平、Child-Pugh评分均高于A级患者(P<0.05);经Pearson检验,血清D-乳酸、DAO、内毒素水平与肝硬化患者Child-Pugh 分级呈正相关(r>0,P<0.05);60 例肝硬化患者中预后不良12 例,占比20.00%;预后不良的肝硬化患者血清DAO、D-乳酸、内毒素水平高于预后良好患者;且经Logistic 回归分析证实,血清D-乳酸、DAO、内毒素水平升高是肝硬化患者预后不良的危险因素(OR>1,P<0.05)。分析原因为,①位于机体小肠黏膜上层绒毛中的DAO 是一种高度活性细胞内酶,在多种代谢中均具有重要作用,黏膜细胞的核酸、蛋白质合成与DAO活性密切相关。正常情况下,DAO 在机体血清中仅有少量表达,但肝硬化患者存在肠黏膜细胞受损情况,致使DAO从肠黏膜细胞内释放至血液中(或随脱落的肠黏膜细胞进入肠腔),增加血清中DAO 浓度,因此,其水平变化可有效反映机体肠道机械屏障完整性、损伤程度;同时,当IP 改变时,血清DAO 水平增加,而其水平越高表明肠黏膜损伤程度越重,患者的Child-Pugh 分级越高,预后越差[6]。②D-乳酸是胃肠道细菌的代谢产物,正常情况下,D-乳酸已被血液中的D-乳酸脱氢酶吸收且被吸收后代谢较慢,因此,血清中D-乳酸水平较低;而当IP改变时,黏膜屏障损伤,致使D-乳酸进入血液,提高血清中D-乳酸水平,其水平浓度变化可有效反映肝硬化患者肠黏膜损伤情况,D-乳酸水平越高,患者肠黏膜损伤程度越重,其Child-Pugh分级越高,预后越差[7]。③内毒素对肝细胞具有直接损伤作用,或通过激活单核巨噬细胞系统对肝脏组织造成继发损害,且内毒素对肝巨噬细胞具有激活作用,其可促进肝巨噬细胞分泌、释放中性粒细胞及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),并粘附于肝窦内皮细胞,刺激其产生及释放氧自由基,对肝星状细胞(hepatic stellate cells,HSC)具有直接刺激性,进而诱发胶原生成,导致IP改变,损伤肠黏膜屏障功能。而肠黏膜屏障功能可抵抗致病菌侵袭机体,分隔肠腔内物质。肝硬化患者的肠道菌群存在不同程度的失调或紊乱情况,致使肠道黏膜屏障功能出现损伤,增加IP改变;细菌或内毒素发生移位,致使肠道内的细菌或内毒素释放至血液中,增加患者血清中内毒素水平,而患者的内毒素水平长期维持在较高水平,会促进肝病发展,提高肝硬化相关并发症的发生风险,进而加重肝硬化患者病情程度,致使肝硬化患者Child-Pugh分级加重,影响预后效果[8]。
综上所述,IP 改变与肝硬化患者Child-Pugh 分级及预后密切相关,临床上可通过监测肝硬化患者IP相关指标(DAO、D-乳酸、内毒素)水平,评估肠黏膜损伤情况,且肠黏膜损伤程度越重,患者Child-Pugh分级越高,预后越差。
