基于ITS2 序列及二级结构对紫苏与其变种、紫苏子与其混伪品的鉴别
2022-04-29郑梦迪贺紫涵汪兴军
郑梦迪, 贺紫涵, 张 春, 汪兴军
(西安医学院 药学院,陕西 西安 710021)
紫苏Perilla frutescens(L.) Britt.为唇形科紫苏属植物,是一种常见的药食两用植物资源[1],据2015版《中国药典》记载,紫苏干燥成熟的果实入药称为紫苏子,具有降气化痰、止咳平喘、润肠通便的作用;其干燥叶(或带嫩枝)为紫苏叶入药,具有解表散寒、行气和胃的功效[2]。 由于紫苏属下变种较多,历代本草文献中对于紫苏及其变种用途及分类的记载混乱,其植物命名和分类争议存在已久[3-4]。 魏晋时期《名医别录》最早记载紫苏入药,分为“苏”和“荏”,“苏”即现代所使用的紫苏,“荏”即指白苏[3]。南宋王介编绘的《履巉岩本草》中记载了野苏,经考证为紫苏的近似种。 《本草纲目》中除对紫苏和白苏的记载, 另外还收录了一种花紫苏,“其叶细齿,纽如剪成之状, 色香茎子并无异者, 人称回回苏”[3]。《中国植物志》对紫苏属划分为紫苏P. frutescens(原变种)、白苏P. frutescens var. frutescens、回回苏P. frutescens var. crispa(Thunb.) Hand.-Mazz.、耳齿紫苏P. frutescens var. auriculato-dentata C. Y. Wu.et Hsuan 和野生紫苏P. frutescens var. purpurascens(Hayata) H. W. Li[1]。然而由于紫苏属植物在我国广泛人工栽培,属下不同变种植物的表型特征非常相似,并且表型往往受到植物自身生长周期和外界环境因素的影响, 从而造成传统鉴定方法易产生混淆,进而危及用药安全。 另一方面,紫苏子在加工食品、功能性饮品、保健品及化妆品等领域的应用逐渐增多, 但产量低不能满足增长的市场需求量;种苗错误种植、混合种植、混合收购、人为掺入等现象屡见不鲜,再加之药用紫苏子经过炮制后外观特征丢失,常有急性子、沙苑子、白芥子、油菜子和菟丝子等种子混入, 从而造成传统方法对紫苏子与其混伪品的鉴别困难[5-6]。
DNA 条形码(DNA barcoding)技术是利用生物基因组上一段具有足够变异, 且易于PCR 扩增的片段,可用来区分不同物种的分子生物学技术,是对传统物种鉴定方法的有效补充[7]。 其中ITS2(Internal transcribed spacer 2)条形码在植物分类鉴别中的稳定性和适用性已得到广泛验证[8-11]。 ITS2片段位于5.8S 和28S 核rDNA 基因之间。 rDNA 转录形成rRNA,RNA 的一级结构是指A、U、C、G 4 种核苷酸的排列组合;RNA 的二级结构是指其自身回折形成茎环结构,不配对碱基构成环区,茎干区由配对碱基构成[12-13];而在茎干区,有时可发生补偿性碱基替换(Compensatory base changes,简称CBC),即为了维持配对结构,一侧碱基发生突变会引起另一侧碱基的响应配对性突变,如C-G 配对中,胞嘧啶C 突变为腺嘌呤A, 原配对中的G 相应突变为U,即由C-G 变化为A-U,从而维持二级结构的稳定性。 研究表明,发生CBC 的两个个体之间存在生殖隔离,CBC 与杂交不亲和有很强的相关性,即ITS2 二级结构中的CBC 是一种对真核生物进行分类的有效方法[14-15]。
近年来对紫苏与其变种的分子鉴别仅停留在核酸序列层面[16],并且尚无对紫苏子与其混伪品的DNA 条形码鉴别研究。 因此作者拟采用ITS2 序列结合二级结构,对紫苏与其变种、紫苏子与其混伪品进行分析,为中药材紫苏叶与紫苏子在分子水平上的鉴别提供科学依据,保障临床用药的合理性和有效性。
1 材料与方法
1.1 材料
本研究收集紫苏植物材料3 份,分别来自浙江衢州、陕西西安、桂林全州;白苏植物1 份,来源于江西赣州; 于GenBank 获得ITS 序列, 包括紫苏3条、白苏10 条、野生紫苏2 条、回回苏3 条、耳齿紫苏3 条、3 个日本紫苏品种 (文中记为日本紫苏I、II、III)各1 条、外类群枸骨5 条;共33 份样本信息见表1。 另外,紫苏子与其混伪品样本信息见表2,包括紫苏子基源植物样本2 份,分别来源于浙江衢州和陕西西安; 菟丝子和油菜子基源植物样本各1份, 分别来自广东茂名和陕西西安;GenBank 下载ITS 序列包括紫苏子3 条、 急性子4 条、 白芥子5条、沙苑子3 条、菟丝子3 条、油菜子2 条;共24 份样本。 所有植物材料经西安医学院药学院生药教研室汪兴军老师鉴定,并保存于-80 ℃冰箱。

表1 紫苏与其变种的材料种类和来源的详细资料Table 1 Detailed information of materials types and sources of P. frutescens and its varieties

表2 紫苏子与其混伪品的材料种类和来源的详细资料Table 2 Samples of Perillae fructus and its adulterants
1.2 方法
1.2.1 DNA 提取 用体积分数75%乙醇擦拭新鲜植物样本叶或茎的表面, 取约150 mg 组织于1.5 mL 灭菌离心管中,迅速放入液氮中冷冻。 在液氮环境下,用灭菌小木棒研磨植物组织至粉末状。 再按照DP305 植物基因组DNA 提取试剂盒说明书操作提取DNA。
1.2.2 PCR 扩增、 测序和校正 选择ITS2 通用引物进行序列扩增[17],ITS2F(5′-ATGCGATACTTGGT GTGAAT-3′)和ITS2R(5′-GACGCTTCTCCAGACT ACAAT-3′)。RCR 反应条件:94 ℃5 min,94 ℃30 s、56 ℃30 s、72 ℃45 s,循环40 次,72 ℃2 min。PCR反应体系:DNA 模板1 μL, 引物ITS2F 和ITS2R 各1 μL,DNA 聚合酶2×Taqmix 12.5 μL,ddH2O 补充至25 μL。 PCR 产物由北京擎科泽西生物科技有限公司完成Sanger 测序,每个样本重复3 次测序。 通过Contig Express 软件去除每条序列的两端引物区,检查测序峰图并进行人工校正,最终得到全部序列。
1.2.3 GenBank 序列下载及ITS2 注释 通过GenBank(https://www.ncbi.nlm.nih.gov/)分别下载紫苏与其变种、紫苏子与其各混伪品的ITS 序列,并通过BLAST 相似性搜索排除可疑序列。将所得序列连同测序序列,基于隐马尔可夫模型HMM[18]除去位于两端的5.8S 和28S 序列, 得到所有样本的ITS2 序列。 使用Clustal omega 在线软件对所有收集到的序列进行比对和矫正。
1.2.4 序列分析、 遗传距离计算及NJ 树构建MEGA7.0 软件比对序列矩阵,统计GC 含量、保守位点和变异位点等信息; 基于Kimura 2-parameter(K2P)模型计算各物种种内和种间遗传距离,采用邻接法(Neighbor joining,NJ)构建系统发育树,设置参数Bootstrap 自展支持率1000 次重复检验各分支。
1.2.5 ITS2 二级结构预测及PNJ 树构建 利用ITS2 Database (http://its2.bioapps.biozentrum.uni -wuerzburg.de/)中Predict 功能预测各物种ITS2 的二级结构。 下载各样本的核酸序列和二级结构联合矩阵,通过4Sale 软件比对联合矩阵,进行序列和二级结构的比对。比对完成后对ITS2 一级序列和二级结构系统发育树进行构建,4Sale[19]导出的比对结果输入ProfDistS[20]软件,基于距离法利用剖面邻接Profile neighbor-joining (PNJ) 构建系统发育树,并自展分析1000 次来评价分支系统发育关系的可靠性。
2 结果与分析
2.1 紫苏与其变种ITS2 变异位点分析
紫苏与其变种的ITS2 序列长度相近, 集中在231 bp 和233 bp。 3 个日本紫苏品种的ITS2 序列GC 含量较高在81.20%~82.00%, 而紫苏与其他变种的序列GC 含量为64.20%~65.40%(见表3)。 紫苏I(序列号KC011247)在123 bp 处有T→G 一个变异位点,即紫苏种内存在2 种单倍型;回回苏和耳齿紫苏分别在222 bp 和22 bp 处各有一个变异位点。野生紫苏在22、103 bp 处发生变异,共两个变异位点。白苏无变异位点。3 个日本紫苏与其他变种间序列变异较大。 变异位点信息如表4 所示。

表3 紫苏与其变种的ITS2 序列差异分析Table 3 ITS2 sequence analysis of P. frutescens and its varieties

表4 紫苏与其变种的变异位点分析Table 4 Variation sites of P. frutescens and its varieties
2.2 紫苏与其变种遗传距离分析
基于K2P 模型计算的遗传距离显示(见表5),紫苏的平均种内遗传距离为0.002, 其余各变种的种内遗传距离均为0.000。 白苏与紫苏的种间遗传距离为0.001, 紫苏的种内遗传距离大于紫苏与白苏种间遗传距离, 因此不能将白苏和紫苏区分开。白苏、 紫苏与其他变种种间的遗传距离为0.005~0.033,大于各物种的种内遗传距离0.000~0.002;即白苏、紫苏分别与其他变种及其他各物种(不含构骨)的种间最小遗传距离大于各物种种内最大遗传距离。 因此,从遗传距离水平,ITS2 序列可将紫苏、白苏与其他变种区分开。
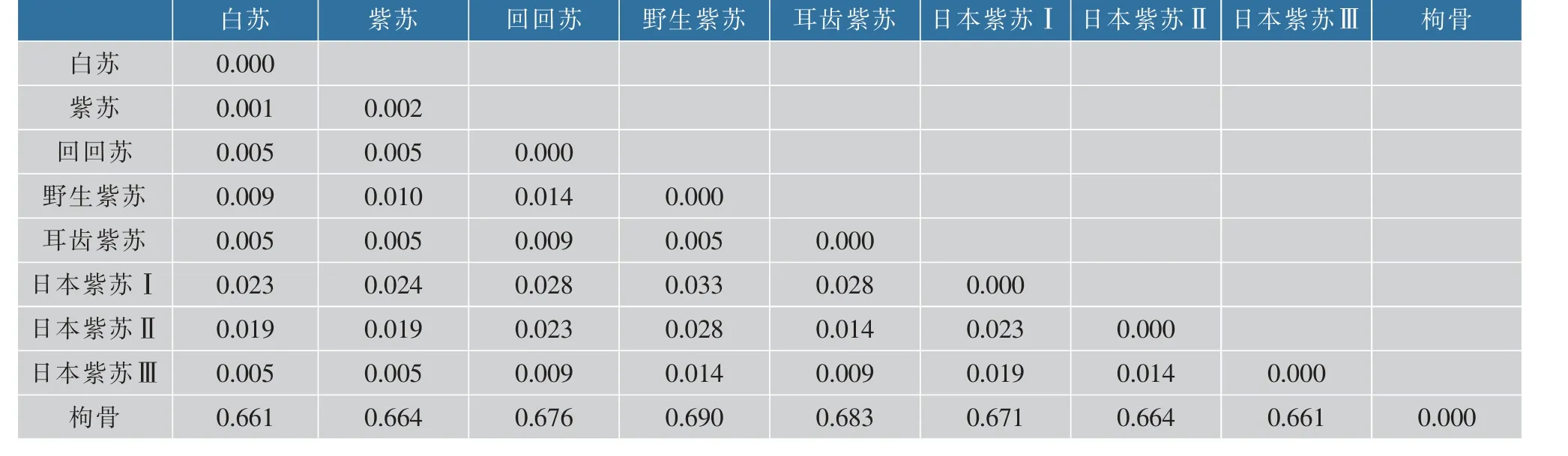
表5 紫苏与其变种的遗传距离Table 5 Genetic distance table of P. frutescens and its varieties
2.3 紫苏与其变种二级结构及CBC 模型分析
紫苏与其变种的ITS2 二级结构均由一环 (主环)四臂(螺旋区)组成(见图1),并且中心环和茎臂的夹角在不同物种间较为相近。 其中紫苏包含3 个内环和4 个发夹环,与白苏、耳齿紫苏和回回苏相比在臂IV 上区少了2 个内环,与野生紫苏、日本紫苏I 相比在臂III 和臂IV 区上各少2 个内环, 与日本紫苏II 相比,臂IV 区少了2 个内环。 白苏包含有4 个发夹环和5 个内环,白苏比野生紫苏在臂III 区少1 个内环, 白苏和耳齿紫苏的臂IV 区的内环的位置也不同。 在臂IV 区处回回苏的第1 个内环比耳齿紫苏更靠近中心环。 回回苏相比野生紫苏在臂III 上少1 个内环, 并且臂IV 区的第1 个内环更靠近中心环。 即紫苏与白苏及其他变种之间,ITS2 二级结构在内环的数量和位置均存在差异。CBC(补偿性碱基替换)模型的统计结果显示,回回苏分别与白苏、耳齿紫苏、野生紫苏在臂Ⅳ区具有1 个CBC(203/222 T-A→G-C)和1 个hCBC(204/221 T-A→T-G)(见图2),基于CBC 模型显示回回苏分别与白苏、耳齿紫苏、野生紫苏符合杂交不亲和现象。 综上所述,ITS2 二级结构对于紫苏与其变种的鉴别具有指导意义。

图1 紫苏与其变种的ITS2 二级结构图Fig. 1 ITS2 secondary structure prediction diagram of P. frutescens and its varieties

图2 紫苏与其变种的ITS2 二级结构CBC 模型Fig. 2 CBC of ITS2 secondary structure of P. frutescens and its varieties
2.4 紫苏与其变种NJ 树分析
由ITS2 序列构建的NJ 树可以看出,日本紫苏与我国产紫苏与其变种明显区分开(见图3)。 从分支情况和支持率可见,紫苏和白苏样本不能有效的区分开,共聚为一个大分支,二者亲缘关系最近;回回苏、耳齿紫苏和野生紫苏形成姐妹分支,其中野生紫苏与耳齿紫苏亲缘关系较近。 冬青科植物枸骨Ilex cornuta 作为外类群。

图3 紫苏与其变种的NJ 树Fig. 3 NJ tree of P. frutescens and its varieties
2.5 紫苏子与其混伪品的序列和遗传距离分析
紫苏子与其混伪品的ITS2 序列差异较大(见表6), 序列长度在191~233 bp,GC 含量在50.50%~64.90%,物种间也存在大量变异位点。 如表7 所示,基于K2P 模型计算紫苏子与其混伪品的遗传距离,急性子、白芥子、油菜子种内遗传距离均为0.000,紫苏子种内平均遗传距离为0.003, 种内最大遗传距离的是混伪品沙苑子0.013。 种间最小遗传距离是白芥子和沙苑子0.627; 紫苏子与其混伪品白芥子的遗传距离最小,而紫苏子与其混伪品菟丝子的遗传距离最大。所有物种的种间最小遗传距离(0.627)大于种内最大遗传距离(0.013),并且紫苏子与其混伪品的种间最小遗传距离(0.634)远大于紫苏子种内遗传距离, 表明基于K2P 遗传距离,ITS2 序列能够区分紫苏子与其混伪品(急性子、沙苑子、白芥子、菟丝子和油菜子)。

表6 紫苏子与其混伪品的ITS2 序列分析Table 6 ITS2 sequence analysis of Perillae fructus and its adulterants

表7 紫苏子与其混伪品的遗传距离Table 7 Genetic distance table of Perillae fructus and its adulterants
2.6 紫苏子与其混伪品的二级结构预测及分析
紫苏子与其混伪品的二级结构符合被子植物一环(主环)四臂(螺旋区)的特征,其中臂III 最长,臂IV 变异最大,其次是臂I,臂II 最保守,螺旋上又有大小和数量不等的茎环(见图4)。 紫苏子与其混伪品在环的大小和位置、旋臂的角度上均有较大区别,其中急性子、沙苑子、白芥子和油菜子在臂I 和臂IV 之间有一段富含嘌呤的单链结构。 因此ITS2二级结构对紫苏子与其混伪品的物种鉴别具有一定的参考价值。

图4 紫苏子与其混伪品的ITS2 二级结构图Fig. 4 Prediction diagram of ITS2 secondary structure of Perillae fructus and its adulterants
2.7 紫苏子与其混伪品的NJ 树、PNJ 树分析
由紫苏子与其混伪品的NJ 树中可见, 紫苏子单独聚为一支,支持率高达99%,表现出良好的单系性(见图5)。常见混伪品沙苑子、白芥子、急性子、菟丝子和油菜子也分别聚为一支。ITS2 一级序列与二级结构联合矩阵构建PNJ 树显示,各物种均能分支区分开与NJ 树结果吻合,并且PNJ 树结果比NJ树显示出更多的系统发育关系信息位点。

图5 紫苏子与其混伪品的NJ 树和PNJ 树Fig. 5 NJ tree and PNJ tree of Perillae fructus and its adulterants
3 结语
我国是紫苏的原产地,紫苏具有很高的食用价值和药用价值,是药食同源的代表植物。 紫苏作为食材是美味的天然调味品,早在两汉时期,已有将活鲤鱼切成生鱼片搭配紫苏食用,既可去腥又可保持鱼肉的鲜美。 并且紫苏在我国用药历史悠久,紫苏叶、 紫苏梗和紫苏子被收录为3 种不同药材,分别具有治疗风寒感冒、调节肠胃、促进气血循环、减轻疼痛、解咳嗽和气喘、缓解便秘的作用。 另外,诗经中“荏染柔木,君子树之”,已经用紫苏指代人们美好的情感,后更用“荏苒冬春谢,寒暑忽流易”,将紫苏与流逝的时光联系起来。 可见,对中国人来说,紫苏不仅是一种食物、一种药材,更是一种中国文化精神象征。
紫苏属下变种多,且变种易受到环境因素的影响而改变,品种的鉴定依赖于具备植物学和生药学等专业知识且经验丰富的学者。 近年来,我国紫苏市场销势活跃,产销两旺,批量成交增加,出口订单上升。 而前几年我国紫苏产量少,市场供应缺口逐年加大,短期难以缓解,紫苏的紧缺已使价格大幅上涨,导致市面上出现紫苏子与其混伪品、紫苏与其变种存在不合理的销售问题。
作者采用ITS2 序列以及二级结构分别对紫苏与其变种、紫苏子与其混伪品进行鉴别,结果显示,仅仅依靠ITS2 序列不能将紫苏与白苏两个种区分开, 但二者的ITS2 二级结构存在内环数量的差异;紫苏、白苏分别与其他变种均可有效区分,符合种间最小遗传距离大于种内最大遗传距离。 在ITS 序列、K2P 遗传距离、ITS2 二级结构、 基于序列的NJ树和基于一级结构和二级结构联合矩阵的PNJ 树均显示紫苏子与其混伪品可以明显区分。 因此,建议ITS2 可以作为紫苏子与其混伪品的DNA 条形码,而对紫苏与白苏的鉴别或建议合并的假设还有待进一步研究。
