黄芪多糖通过调节肠道菌群抑制高脂饮食小鼠肠道炎症反应
2022-04-29张竞男马春丽徐宋瑶张俊锋任贵强扈瑞平
张竞男, 苑 红, 马春丽, 李 丽, 徐宋瑶,张俊锋, 霍 达, 任贵强, 扈瑞平*
(1. 内蒙古医科大学 基础医学院, 内蒙古 呼和浩特 010110;2. 内蒙古医科大学 护理学院, 内蒙古 呼和浩特 010110)
进入互联网时代,伴随人们生活方式的改变和不良饮食习惯的影响,肥胖、糖尿病、脂肪肝、动脉粥样硬化等代谢性疾病的发病率逐渐上升,已经成为威胁大众健康的普遍公共卫生问题。 代谢性疾病的主要发病原因是营养物质代谢过剩诱发的慢性炎症反应[1]。 近年来许多研究证实肠道菌群与代谢、炎症反应、免疫功能等密切相关,并参与脂代谢等生理过程[2-4]。
植物多糖的膳食干预可通过调节肠道菌群结构或多样性,发挥减轻炎症反应、调节血脂代谢等作用[5]。 黄芪多糖(APS)是黄芪主要活性成分之一,作为免疫增强剂在抗肿瘤、抗病毒等方面具有免疫调节作用[6-7];能够有效调节血脂水平并改善胰岛素抵抗,发挥控制血糖、改善心血管功能的作用[8-9]。 作者给高脂饮食小鼠自由饮用黄芪多糖溶液,通过考察小鼠血清炎症因子和肠道菌群的变化,探究黄芪多糖是否可通过调节肠道菌群改善其肠道炎症反应。
1 材料与方法
1.1 材料和试剂
黄芪多糖(质量分数70%):上海易恩化学技术有限公司产品;30 只C57BL/6J 雄性小鼠:北京斯贝福生物技术有限公司提供;总胆固醇(TC)含量测定试剂盒、甘油三酯(TG)含量检测试剂盒、小鼠脂多糖 (LPS)ELISA 试剂盒、 小鼠免疫球蛋白A(IgA)ELISA 试剂盒、小鼠免疫球蛋白M(IgM)ELISA 试剂盒、小鼠免疫球蛋白G(IgG)ELISA 试剂盒、小鼠白细胞介素-1β(IL-1β)ELISA 试剂盒、小鼠肿瘤坏死因子-α(TNF-α)ELISA 试剂盒、小鼠白细胞介素-6(IL-6)ELISA 试剂盒:江苏酶免实业有限公司产品;正庚烷、异丙醇(均为分析纯):西陇科学股份有限公司产品。
1.2 仪器与设备
Forma 900 series 超低温冰箱、Multiskan FC 酶标仪: 赛默飞世尔科技有限公司产品;DNP 型恒温培养箱:精宏科技有限公司产品。
1.3 实验方法
1.3.1 动物模型制备及分组 将C57BL/6J 小鼠适应性喂养7 d,随机分为对照组(C) 、模型组(M)、黄芪多糖处理组(D),每组10 只。 对照组喂标准饲料和饮用水,模型组喂高脂饲料和饮用水,黄芪多糖处理组喂高脂饲料和2 g/dL 黄芪多糖溶液。 连续喂养11 周后采样。
1.3.2 样本采集和处理 取样前12 h 禁食,收集小鼠粪便于离心管中用于高通量测序,记录小鼠体质量。 采用断头法取血于离心管中,静置30 min,于4℃、3000 r/min 离心15 min,分离血清。 迅速剥离脾脏、肾脏周围脂肪组织,并称质量。
1.3.3 血脂、LPS、炎症因子、免疫球蛋白指标的测定根据试剂盒说明测定血清样本中的TC 浓度、TG 质量浓度, 根据ELISA 试剂盒说明测定血清样本中LPS 水平,根据ELISA 试剂盒说明测定血清样本中IL-1β、IL-6、TNF-α 质量浓度, 根据ELISA 试剂盒说明测定血清样本中IgA、 IgG、IgM 质量浓度。
1.3.4 肠道菌群分析 采用CTAB/SDS 方法提取总细菌基因组DNA。 选用上游引物515F(5′-GTGCC AGCMGCCGCGGTAA-3′)和下游引物806R(5′-GG ACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA的V3~V4 区。
1.4 统计学处理
实验结果以均值±标准差的形式表示, 数据采用SPSS 25.0 进行处理, 用Bonferroni 法进行方差分析,分析组间差异,认为P<0.05 为差异有统计学意义。 高通量测序结果采用OTUs 聚类分析法,进行物种注释及丰度分析。
2 结果与分析
2.1 APS 对体质量、脂肪质量、脾脏指数的影响
表1 为饲喂APS 后小鼠体质量、 脂肪质量、脾脏指数的变化。 与对照组比较,模型组小鼠体质量增加9.69%,脂肪质量增加(P<0.01),脾脏指数降低(P<0.05);与模型组相比,黄芪多糖干预后小鼠体质量增加,脂肪质量减少,脾脏指数升高接近对照组小鼠,但均无明显差异。
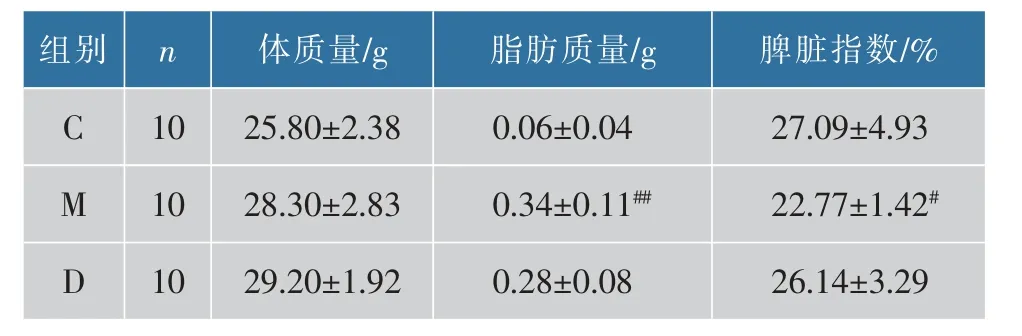
表1 各组小鼠的体质量、脂肪质量、脾脏指数比较Table 1 Comparison of the weight,the weight of fat and spleen index among the three groups
2.2 APS 对血脂水平的影响
APS 对实验小鼠血脂水平的影响如图1 所示。由图可知,与对照组相比,模型组总胆固醇、甘油三酯水平明显升高(P<0.01),说明高脂饮食喂养后小鼠脂质代谢发生异常;与模型组相比,黄芪多糖处理组血清总胆固醇浓度明显降低(P<0.01)。 这说明APS 显著改善了高脂饮食小鼠的总胆固醇异常状态。

图1 APS 对血脂水平的影响Fig. 1 Effect of APS on plasma indexes
2.3 APS 对血清中LPS 水平的影响
APS 对实验小鼠血清LPS 水平的影响如图2所示。与对照组相比,模型组LPS 水平显著升高(P<0.01);与模型组相比,黄芪多糖处理组LPS 水平显著降低(P<0.01)。 说明APS 能够降低因高脂饮食引起的LPS 水平升高。
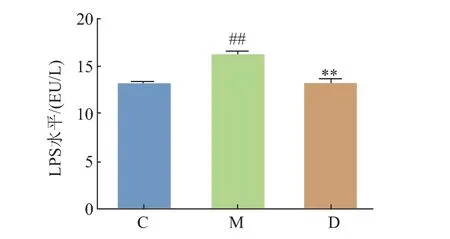
图2 APS 对内毒素LPS 水平的影响Fig. 2 Effect of APS on LPS
2.4 APS 对血清免疫球蛋白质量浓度的影响
APS 对实验小鼠血清免疫球蛋白质量浓度的影响如图3 所示。 与对照组相比,模型组IgA、IgG、IgM 质量浓度降低,其中IgA、IgG 有显著性差异(P<0.05)。 与模型组相比, 黄芪多糖处理组小鼠血清IgA、IgG、IgM 质量浓度升高,但无统计学意义。高脂饮食影响血清中免疫球蛋白的质量浓度,摄入APS能够增加血清中免疫球蛋白质量浓度。
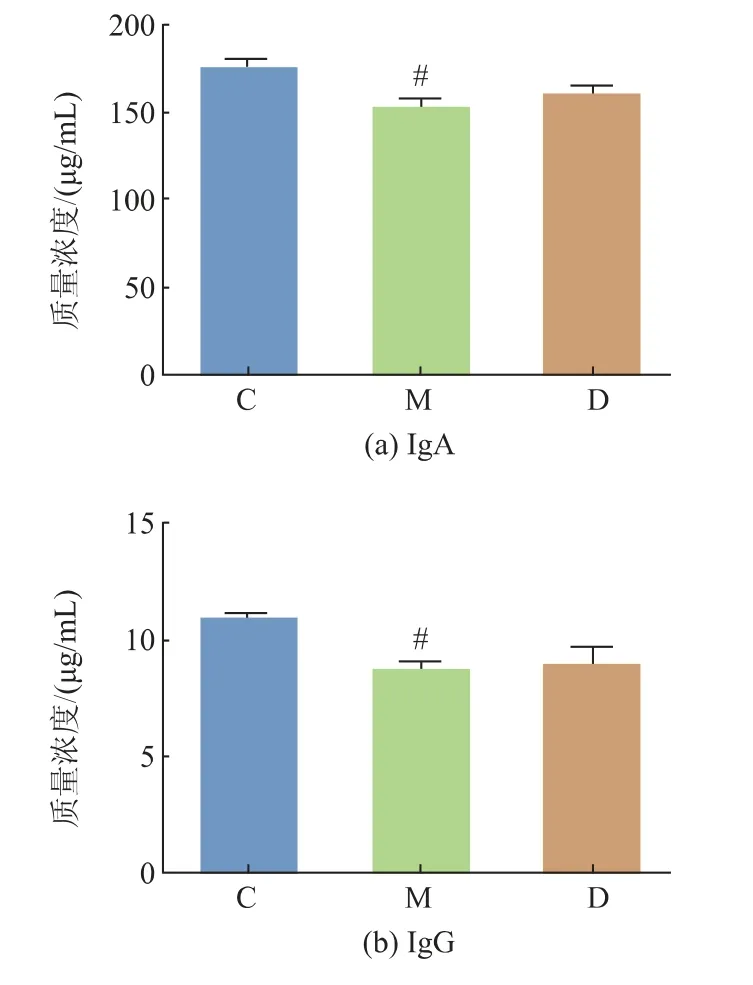
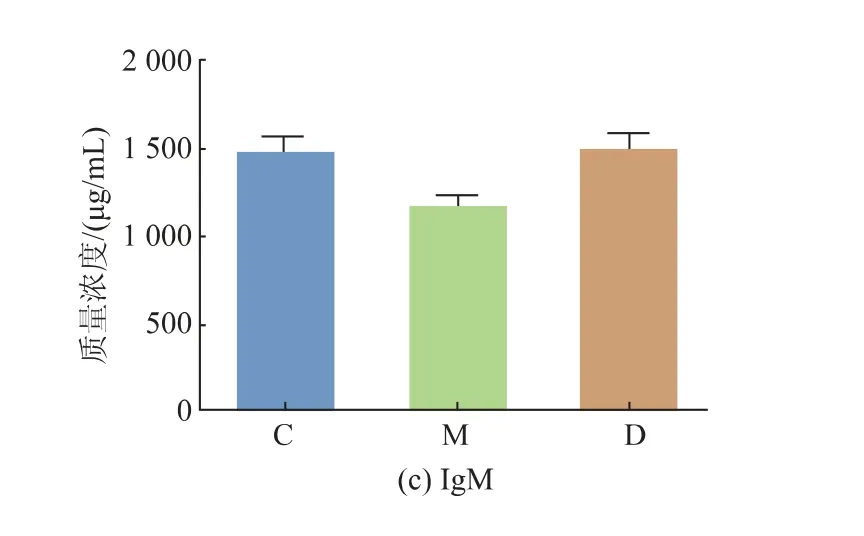
图3 APS 对血清免疫球蛋白质量浓度的影响Fig. 3 Effect of APS on serum immunoglobulin level
2.5 APS 对炎症因子质量浓度的影响
APS 对实验小鼠血清炎症因子质量浓度的影响如图4 所示。 与对照组相比,模型组IL-1β、IL-6、TNF-α 质量浓度均升高, 其中IL-1β、IL-6 差异明显(P<0.01);与模型组相比,黄芪多糖处理组的IL-1β、IL-6、TNF-α 质量浓度均降低,其中IL-1β 质量浓度有显著性差异(P<0.01)。 高脂饮食导致血清炎症因子增多,而APS 可以降低血清中炎症因子质量浓度,尤其是IL-1β 的质量浓度。

图4 APS 对炎症因子质量浓度的影响Fig. 4 Effect of APS on the level of inflammatory factors
2.6 APS 对肠道菌群的影响
如图5 和表2 所示,与对照组比较,模型组小鼠肠道内的有益菌拟杆菌门(Bacteroidota)相对丰度下降(P<0.05),有害菌厚壁菌门(Firmicutes)相对丰度增加,且拟杆菌门与厚壁菌门比值减小,但差异不明显。 与模型组小鼠相比,黄芪多糖干预后,拟杆菌门相对丰度有所增加,厚壁菌门相对丰度有下降趋势,拟杆菌门与厚壁菌门比值升高,但差异不显著。 说明长期高脂膳食会破坏小鼠肠道门水平上的菌群比例, 引起小鼠肠道菌群紊乱,APS 可调节高脂膳食导致的菌群结构失调。
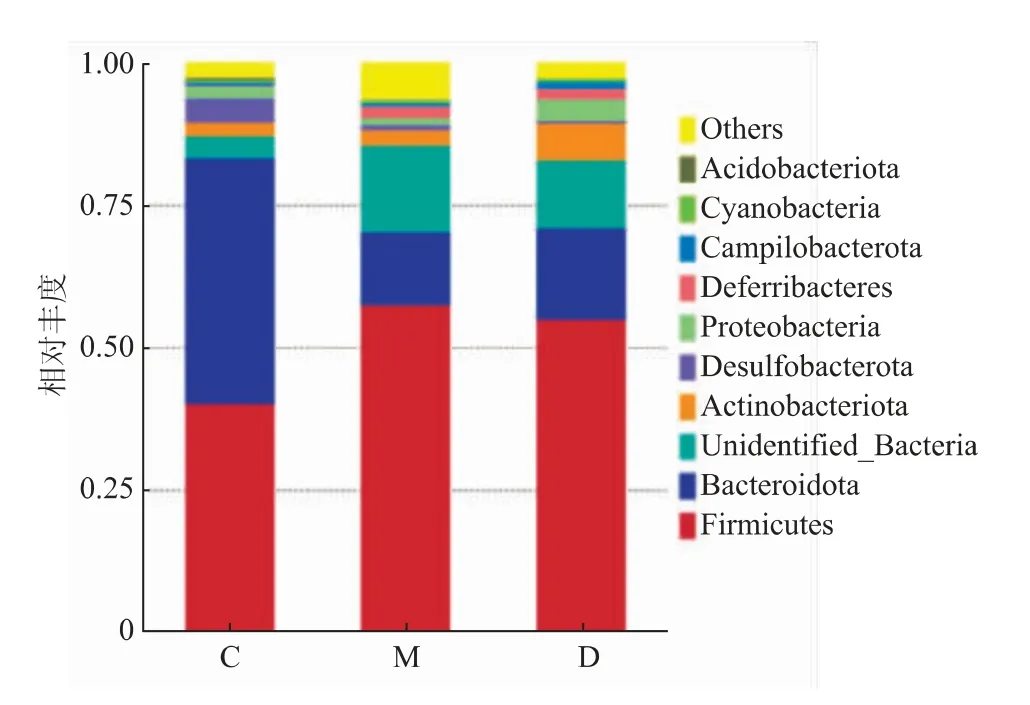
图5 门水平上各组小鼠含量前10 的菌群物种相对丰度Fig. 5 Relative abundance of top 10 bacterial species of mice in each group at phylum level
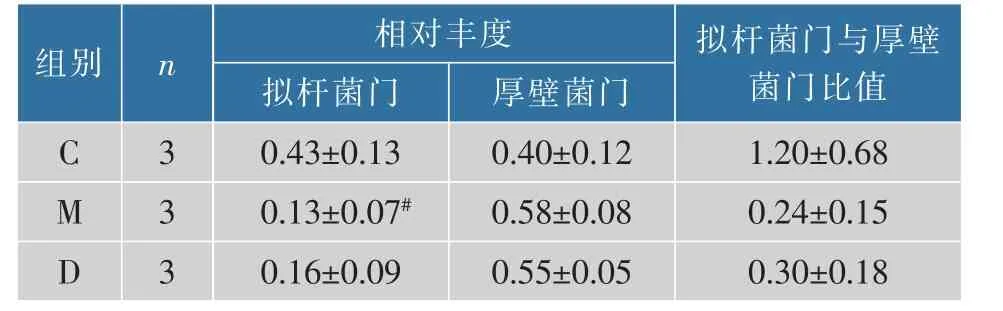
表2 黄芪多糖对肥胖小鼠肠道拟杆菌门、 厚壁菌门相对丰度的影响Table 2 Effect of APS on relative abundance of Bacteroidota and Firmicutes in the obese mice
如图6所示,在属水平,对照组以Jeotgalicoccus、Desulfovibrio、Dubosiella 为主, 其中Jeotgalicoccus、Dubosiella 属于厚壁菌门,Desulfovibrio属于Desulfobacterota; 模型组以Lachnospiraceae_NK4A136_group、 Lactobacillus 、 Colidextribacter 、Intestinimonas 为主,均属于厚壁菌门;黄芪多糖处理 组 以Ileibacterium、Bifidobacterium、Psychrobacter为主、其中Ileibacterium 属于厚壁菌门,Bifidobacterium属于放线菌门(Actinobacteriota),Psychrobacter 属于变形菌门(Proteobacteria)。 与对照组相比,模型组小鼠以厚壁菌门为优势菌群,说明高脂饮食改变肠道菌群结构;黄芪多糖干预后,可改善因高脂饮食导致的菌群失调, 而且增加有益菌双歧杆菌(Bifidobacterium)相对丰度。
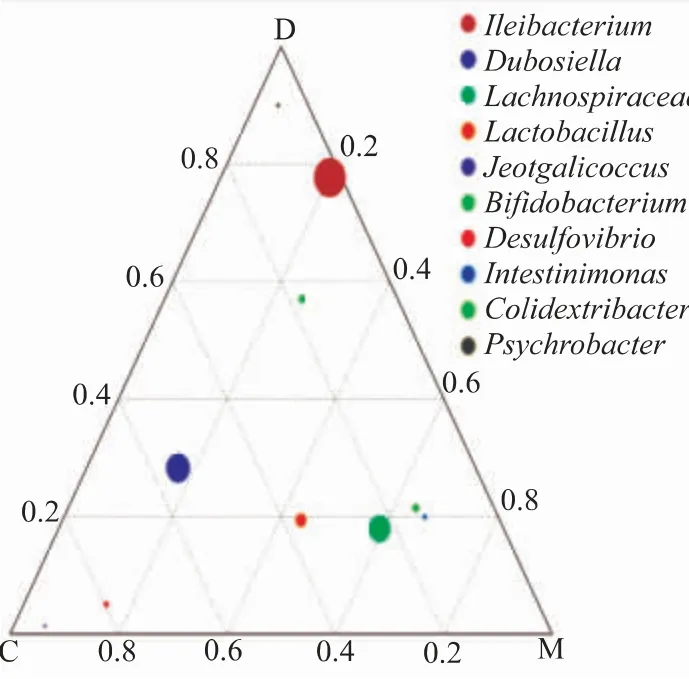
图6 属水平上各组小鼠肠道菌群比例的三元图Fig. 6 Ternary plot of the proportion of intestinal flora in each group at genus level
2.7 讨论
研究表明,长期高脂饮食可以持续改变肠道微生态[10],肠道菌群结构失衡,引起致病菌数量增加,增加内毒素产生, 影响肠上皮细胞的基因表达,使肠黏膜通透性增加[11-12],内毒素进入血液循环,激活TLRs(Toll 样受体)家族中TLR4,触发炎症信号通路[13]。 除此之外,脂肪组织中的NLRs(NOD 样受体)信号通路通常处于激活状态[14],其中NLRP3 以炎性小体的形式,促进内源性和外源性危险信号转化为IL-1。 大量研究提示巨噬细胞是脂肪组织中最主要的炎症细胞[15],脂代谢异常时巨噬细胞向M1 型巨噬细胞极化[16],分泌IL-6、TNF-α 等炎症因子,诱发持续的慢性炎症反应,导致机体代谢紊乱[17-18]。 本实验中黄芪多糖能够在门水平上增加拟杆菌门相对丰度,降低厚壁菌门相对丰度,升高拟杆菌门与厚壁菌门比值。 增加的拟杆菌门可以将植物中的糖类物质分解为益生元,减轻炎症[19];拟杆菌门与厚壁菌门比值的上升直接影响肠道菌群对膳食纤维的代谢,使短链脂肪酸(Short chain fatty acid,SCFAs)浓度升高,SCFAs 可以诱导肠道中调节性T 细胞产生和分化,从而促进抑炎因子IL-10 的产生,发挥抗炎作用[20-21]。 在属水平上有益菌双歧杆菌属增多,能够改善小鼠内毒素血症[22],并对肠黏膜屏障具有保护作用[23],降低LPS 负荷,降低LPS 增多触发的炎症信号通路,减少血清中促炎因子IL-1β、IL-6、TNF-α质量浓度。 表明黄芪多糖可以调节菌群结构,增加有益菌生长,对肠道慢性炎症起到抑制作用。
小鼠由于长期高脂饮食,造成能量过剩,这部分能量转化为脂肪储存在体内[24]。 当血浆中胆固醇浓度增高时, 细胞膜胆固醇合成受抑制, 从而使B淋巴细胞增殖和对抗原信息的识别功能受到限制,进而导致免疫球蛋白分泌减少[25]。 黄芪多糖作为中药黄芪的活性成分,既可以在免疫低下时提高机体免疫力,又可以在炎症持续时,降低炎性水平[26]。 本研究中黄芪多糖可通过提高免疫器官脾脏指数,促进免疫球蛋白分泌,增强小鼠免疫功能,降低炎症因子水平。 已有文献报道,临床常用药物二甲双胍可以降低血清炎症因子IL-6、TNF-α 和IL-1β 水平[27],抑制炎症发展[28-30]。
3 结语
黄芪多糖能够调节高脂饮食小鼠肠道菌群结构,增强小鼠免疫功能,抑制LPS 引起的肠道炎症,改善脂代谢异常。 黄芪多糖与二甲双胍在抑制肠道炎症方面具有相似功效,为将其开发作为预防或治疗代谢性疾病的保健品或药物提供实验依据。
