γ-谷维素和半胱胺对应激小鼠氧化还原状态及免疫功能的影响
2022-04-29陈巍文朱建津黄建平李浙烽蔡平梨
陈巍文, 朱建津*, 黄建平, 李浙烽, 蔡平梨
(1. 江南大学 食品学院,江苏 无锡 214122;2. 杭州康德权饲料有限公司,浙江 杭州 311107;3. 徐州市铜山区家禽技术指导站,江苏 徐州 221100)
社会压力、不良情绪和环境污染等都会使人体产生应激, 在应激状态下机体对能量的需求增加,机体积极分解以提供应激所需的能量,而此时就伴随着活性氧[1](Reactive oxygen species,ROS)等高活性分子产生增多。 当应激持续存在或过于强烈时,过量自由基产生,体内氧化和抗氧化动态平衡被打破,从而导致机体的氧化应激[2]。 应激会通过下丘脑-垂体-肾上腺 (Hypothalamic-pituitary-adrenal,HPA)轴和自主神经系统等对机体免疫系统产生影响[3],另外体内过量ROS 会对免疫细胞的结构和功能造成破坏,从而导致机体免疫系统功能障碍[4]。 因此,寻找安全、高效、经济的抗氧化剂对于缓解氧化应激对机体造成的损伤具有重要意义。
已有研究表明[5-8],γ-谷维素和半胱胺都能够在一定程度上增强机体的抗氧化能力, 对抗氧化应激, 主要通过直接捕捉和清除体内过多自由基,间接增强各种抗氧化酶的活力及提高体内非酶性抗氧化物质的含量等来发挥抗氧化作用,提高机体的总抗氧化能力。Zhu 等发现γ-谷维素通过提高超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶 (Catalase,CAT) 和 谷 胱 甘 肽 过 氧 化 物 酶(Glutathione peroxidase ,GSH-Px)活性,调节凋亡相关蛋白质的表达来改善抗氧化防御系统,减轻乙醇诱导的肝损伤[9]。 Zhou 等发现在育肥猪的日粮中添加半胱胺可显著提高空肠黏膜中谷胱甘肽(Glutathione,GSH)的含量和GSH-Px 活性,并降低了丙二醛(Malondialdehyde ,MDA)的浓度,同时增加了分泌型免疫球蛋白A(Secretory immunoglobulin A,SIgA)、免疫球蛋白M(Immunoglobulin M,IgM)和免疫球蛋白G(Immunoglobulin G,IgG)的浓度,表明半胱胺可以改善育肥猪的抗氧化能力和免疫功能[10]。 但是高剂量半胱胺具有毒性[11],反而会产生过多的过氧化物和自由基,使机体抗氧化能力降低。
作为细胞内能量代谢的主要场所,线粒体[12]不仅是体内ROS 的主要来源, 更是ROS 攻击的首要靶点。 过量ROS 的攻击造成线粒体结构和功能受损, 氧化磷酸化过程发生障碍, 同时进一步造成ROS 的积累[13],形成恶性循环。 此外,线粒体功能障碍会对细胞、组织和器官的功能造成破坏,从而引发一系列疾病如肥胖、心血管疾病和神经退行性疾病[14]等。如果抗氧化剂可以进入线粒体内部,就可以直接从源头上捕获和清除自由基,从而有效发挥抗氧化作用。 考虑到γ-谷维素[15]脂溶性较强的结构特点,而半胱胺[16]主要存在于细胞浆中,因此作者将探讨γ-谷维素和半胱胺是否可以分别在线粒体内外发挥作用,从而在对抗氧化应激和调节机体免疫功能上起到协同作用。
1 材料与方法
1.1 实验材料
实验动物为90 只5 周龄SPF 级别ICR 雄性小鼠,许可证号为SCXK(沪)2018-0003,初始体质量为(25.49±0.75) g,购自上海斯莱克生物科技有限公司。
γ-谷维素(质量分数99%):上海麦克林生化科技有限公司产品;包膜半胱胺(质量分数27%):杭州康德权饲料有限公司产品;强的松:上海阿拉丁生化科技股份有限公司产品;过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、锰-SOD 试剂盒、总抗氧化能力(T-AOC)试剂盒:南京建成生物工程研究所提供; 总蛋白质定量(BCA法)试剂盒、线粒体提取试剂盒、线粒体膜电位检测试剂盒、ATP 含量测定试剂盒: 上海碧云天生物技术有限公司产品;小鼠乙酰辅酶A(Acetyl coenzyme A,A-CoA)ELISA 试 剂 盒、 小 鼠 免 疫 球 蛋 白A(Immunoglobulin A,IgA)ELISA 试剂盒、免疫球蛋白M (IgM)ELISA 试剂盒、 免疫球蛋白G(IgG)ELISA试剂盒、 小鼠肿瘤坏死因子α (Tumor necrosis factor-α,TNF-α)ELISA 试 剂 盒、 白 细 胞 介 素6(Interleukin-6,IL-6)ELISA 试剂盒、白细胞介素10(Interleukin-10,IL-10)ELISA 试剂盒: 江苏酶免实业有限公司产品。
1.2 实验仪器
Sceintz-48 型高通量组织研磨器: 宁波新芝生物科技股份有限公司产品;5804R 台式高速冷冻离心机:德国Eppendorf 公司产品;电热压力蒸汽灭菌器: 上海申安医疗仪器仪表厂制造;Epoch 酶标仪:美国Biotek 公司产品;R686VLT 超低温冷冻冰箱:美国INVETRO 公司产品;Mettle Toledo AB204-N电子天平:梅特勒-托利多仪器(上海)有限公司产品;XB70 制冰机:美国GRANT 公司产品;恒温水浴锅:精宏实验设备有限公司产品。
1.3 实验方法
1.3.1 实验设计与饲养 将90 只5 周龄雄性ICR小鼠适应性饲养一周后,随机分为6 组:正常组、模型组、谷维素组、半胱胺组、联用1 组和联用2 组,每组15 只,每3 d 进行一次皮下注射,正常组注射生理盐水,其他组注射40 mg/kg(以体质量计)的强的松进行造模。 正常组和模型组饲喂正常饲料,其他4 组每kg 饲料中γ-谷维素和半胱胺的添加质量分别为40 mg+0 mg、0 mg+60 mg、20 mg+30 mg、40 mg+60 mg。 饲养时间为8 周。
1.3.2 血浆和组织中生化指标的测定 小鼠饲养8周后, 眼球取血至抗凝管中,4 ℃、4000 r/min 离心10 min,取上层血浆于-80 ℃保存,用于后续氧化还原指标和免疫指标的测定。 取适量心脏、肝脏、空肠加入预冷的生理盐水, 匀浆离心制得10 g/dL 的组织匀浆, 用于蛋白质含量和氧化还原指标的测定,并于-80 ℃保存。另取适量心脏、肝脏和空肠在小鼠处死2 h 内进行线粒体的提取, 并加入储存液进行重悬,用于线粒体蛋白质含量、抗氧化指标的测定以及线粒体功能的评价。其余组织于-80 ℃保存备用。
1.3.3 胸腺、脾脏大小的测定 在处死小鼠前记录小鼠体质量,处死后分别称量小鼠胸腺和脾脏的质量,以胸腺和脾脏的质量(mg)与体质量(g)的比值计算胸腺指数和脾脏指数。
1.4 数据处理与分析
采用SPSS 20.0 软件对实验数据进行分析,结果以平均值±标准误差(Mean±SEM)表示,多组均值采用方差齐性检验和单因素方差分析,多重比较采用Duncan’s 法,P<0.05 表示差异具有统计学意义。采用GraphPad Prism 8.0.1 软件作图。
2 结果与讨论
2.1 γ-谷维素和半胱胺对应激小鼠体内氧化还原状态的影响
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠体内总SOD 活力的影响见图1。 由图中可以看出,模型组在心脏、肝脏和空肠中的总SOD 活力均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组在心脏、 肝脏和空肠中的总SOD 活力均显著高于模型组(P<0.05),其中在心脏和肝脏中与正常组无显著性差异(P>0.05)。 谷维素组在心脏和空肠中的总SOD 活力显著高于模型组(P<0.05),在肝脏中无显著性差异(P>0.05)。半胱胺组和联用2 组在心脏、肝脏和空肠中的总SOD 活力较模型组高,但无显著性差异(P>0.05)。
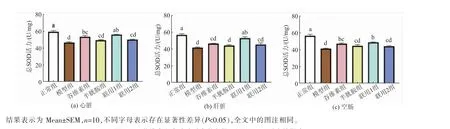
图1 γ-谷维素和半胱胺对应激小鼠组织总SOD 活力的影响Fig. 1 Effect of γ-oryzanol and cysteamine on total SOD activity in tissues of stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠体内GSH-Px 活力的影响见图2。 由图中可以看出,模型组心脏、肝脏、空肠和血浆GSH-Px活力均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏、空肠和血浆GSHPx 活力相对于模型组均有显著提高(P<0.05),其中在心脏、 肝脏和空肠中GSH-Px 活力与正常组无显著性差异 (P>0.05)。 半胱胺组心脏、 肝脏和血浆GSH-Px 活力均显著高于模型组(P<0.05),但均低于联用1 组, 空肠GSH-Px 活力与模型组无显著性差异(P>0.05)。 谷维素组和联用2 组心脏、肝脏、空肠和血浆GSH-Px 活力高于模型组, 但无显著性差异(P>0.05)。

图2 γ-谷维素和半胱胺对应激小鼠体内GSH-Px 活力的影响Fig. 2 Effect of γ-oryzanol and cysteamine on GSH-Px activity in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠体内总抗氧化能力 (Total antioxidant capacity,T-AOC)的影响见图3。 由图中可以看出,模型组心脏、肝脏、空肠和血浆中T-AOC 均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏、空肠和血浆中T-AOC 相对于模型组均有显著提高(P<0.05),其中在心脏、肝脏和血浆中与正常组无显著性差异(P>0.05)。 谷维素组肝脏中T-AOC 显著高于模型组(P<0.05),心脏、空肠和血浆中T-AOC 与模型组无显著性差异(P>0.05)。半胱胺组和联用2 组心脏、肝脏、空肠和血浆中TAOC 相较于模型组有所提高,但无显著性差异(P>0.05)。

图3 γ-谷维素和半胱胺对应激小鼠体内总抗氧化能力的影响Fig. 3 Effect of γ-oryzanol and cysteamine on T-AOC in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠体内MDA 水平的影响见图4。由图中可以看出,模型组心脏、肝脏、空肠和血浆MDA 水平均显著高于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的降低。 联用1 组心脏、肝脏、空肠和血浆中MDA 水平相对于模型组均有显著降低(P<0.05),其中在心脏、肝脏和血浆中与正常组无显著性差异(P>0.05)。谷维素组心脏和肝脏中MDA 水平显著低于模型组(P<0.05), 但在空肠和血浆中MDA 水平与模型组无显著性差异(P>0.05)。 半胱胺组结果与谷维素组类似。联用2 组肝脏MDA 水平显著低于模型组(P<0.05),在心脏、空肠和血浆中MDA 水平相对于模型组略有降低,但差异不显著(P>0.05)。
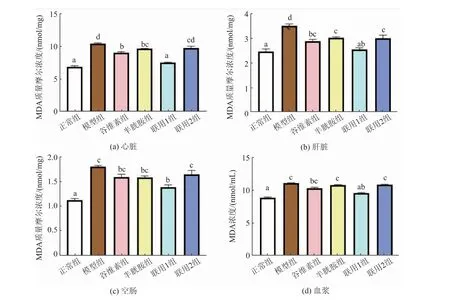
图4 γ-谷维素和半胱胺对应激小鼠体内MDA 水平的影响Fig. 4 Effect of γ-oryzanol and cysteamine on MDA content in stressed mice
2.2 γ-谷维素和半胱胺对应激小鼠线粒体氧化还原状态和功能的影响
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠线粒体Mn-SOD 活力的影响见图5。 由图中可以看出,模型组心脏、肝脏和空肠线粒体Mn-SOD 活力均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏和空肠线粒体Mn-SOD 活力均显著高于模型组(P<0.05),其中在肝脏中与正常组无显著性差异(P>0.05)。 谷维素组肝脏和空肠线粒体Mn-SOD 活力显著高于模型组(P<0.05),在心脏中无显著性差异(P>0.05)。半胱胺组和联用2 组心脏、肝脏和空肠线粒体Mn-SOD 活力较模型组高,但无显著性差异(P>0.05)。
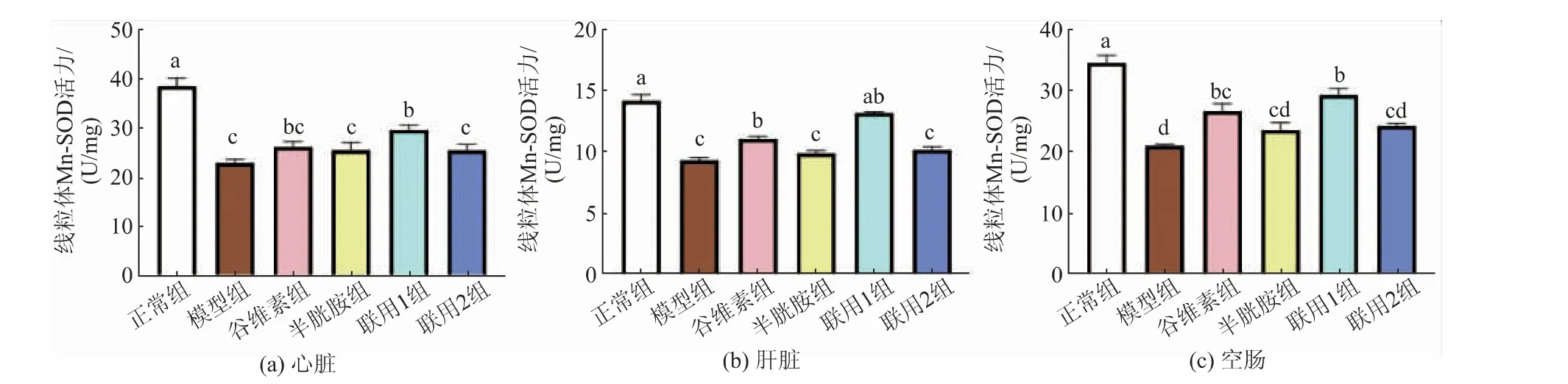
图5 γ-谷维素和半胱胺对应激小鼠线粒体Mn-SOD 活力的影响Fig. 5 Effect of γ-oryzanol and cysteamine on mitochondrial Mn-SOD activity in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠线粒体MDA 质量摩尔浓度的影响见图6。由图中可以看出,模型组心脏、肝脏和空肠线粒体MDA 质量摩尔浓度均显著高于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的降低。 联用1 组心脏、肝脏和空肠线粒体MDA 质量摩尔浓度相对于模型组均有显著降低(P<0.05),其中在肝脏和空肠中与正常组无显著性差异(P>0.05)。谷维素组心脏、肝脏和空肠线粒体MDA 质量摩尔浓度均显著低于模型组 (P<0.05),但也均显著高于联用1 组(P<0.05)。 半胱胺组空肠线粒体MDA 质量摩尔浓度显著低于模型组(P<0.05), 但在心脏和肝脏中线粒体MDA 质量摩尔浓度相对于模型组略有降低,但差异不显著(P>0.05)。 联用2 组结果与半胱胺组类似。

图6 γ-谷维素和半胱胺对应激小鼠线粒体MDA 质量摩尔浓度的影响Fig. 6 Effect of γ-oryzanol and cysteamine on mitochondrial MDA content in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠线粒体膜电位的影响见图7。 由图中可以看出,模型组心脏、肝脏和空肠线粒体膜电位均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏和空肠线粒体膜电位均显著高于模型组(P<0.05),其中在空肠中与正常组无显著性差异(P>0.05)。谷维素组心脏、肝脏和空肠线粒体膜电位均显著高于模型组(P<0.05),但均低于联用1 组。 半胱胺组和联用2 组心脏、肝脏和空肠线粒体膜电位较模型组略高,但无显著性差异(P>0.05)。
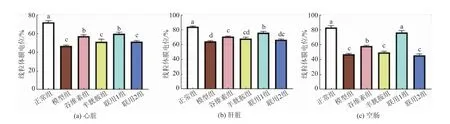
图7 γ-谷维素和半胱胺对应激小鼠线粒体膜电位的影响Fig. 7 Effect of γ-oryzanol and cysteamine on mitochondrial membrane potential in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠线粒体乙酰辅酶A 质量摩尔浓度的影响见图8。 由图中可以看出,模型组心脏、肝脏和空肠线粒体乙酰辅酶A 质量摩尔浓度均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏和空肠线粒体乙酰辅酶A 质量摩尔浓度均显著高于模型组(P<0.05),其中在肝脏中与正常组无显著性差异(P>0.05)。 谷维素组肝脏和空肠线粒体乙酰辅酶A 质量摩尔浓度均显著高于模型组(P<0.05),但在心脏中与模型组无显著性差异(P>0.05)。半胱胺组和联用2 组空肠线粒体乙酰辅酶A质量摩尔浓度显著高于模型组(P<0.05),心脏和肝脏线粒体乙酰辅酶A 质量摩尔浓度较模型组略高,但无显著性差异(P>0.05)。

图8 γ-谷维素和半胱胺对应激小鼠线粒体乙酰辅酶A 质量摩尔浓度的影响Fig. 8 Effect of γ-oryzanol and cysteamine on A-CoA content in mitochondria of stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠线粒体ATP 质量摩尔浓度的影响见图9。由图中可以看出,模型组心脏、肝脏和空肠线粒体ATP 质量摩尔浓度均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组心脏、肝脏和空肠线粒体ATP 质量摩尔浓度均显著高于模型组(P<0.05), 其中在心脏和肝脏中与正常组无显著性差异(P>0.05)。 谷维素组心脏、肝脏和空肠线粒体ATP 质量摩尔浓度均显著高于模型组(P<0.05),但均低于联用1 组。联用2 组肝脏线粒体ATP 质量摩尔浓度显著高于模型组(P<0.05),心脏和空肠线粒体ATP 质量摩尔浓度与模型组无显著性差异。半胱胺组心脏、肝脏和空肠线粒体ATP 质量摩尔浓度较模型组略高,但无显著性差异(P>0.05)。

图9 γ-谷维素和半胱胺对应激小鼠线粒体ATP 质量摩尔浓度的影响Fig. 9 Effect of γ-oryzanol and cysteamine on ATP level in mitochondria of stressed mice
2.3 γ-谷维素和半胱胺对应激小鼠免疫功能的影响
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠脏器指数的影响见图10。 由图中可以看出,模型组脾脏指数和胸腺指数均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2组相对于模型组均有一定程度的提高。 联用1 组脾脏指数和胸腺指数均显著高于模型组(P<0.05),且胸腺指数与正常组无显著性差异(P>0.05)。 谷维素组胸腺指数显著高于模型组(P<0.05),脾脏指数比模型组略高,但无显著性差异(P>0.05)。半胱胺组和联用2 组脾脏指数和胸腺指数相对于模型组略高,但均无显著性差异(P>0.05)。
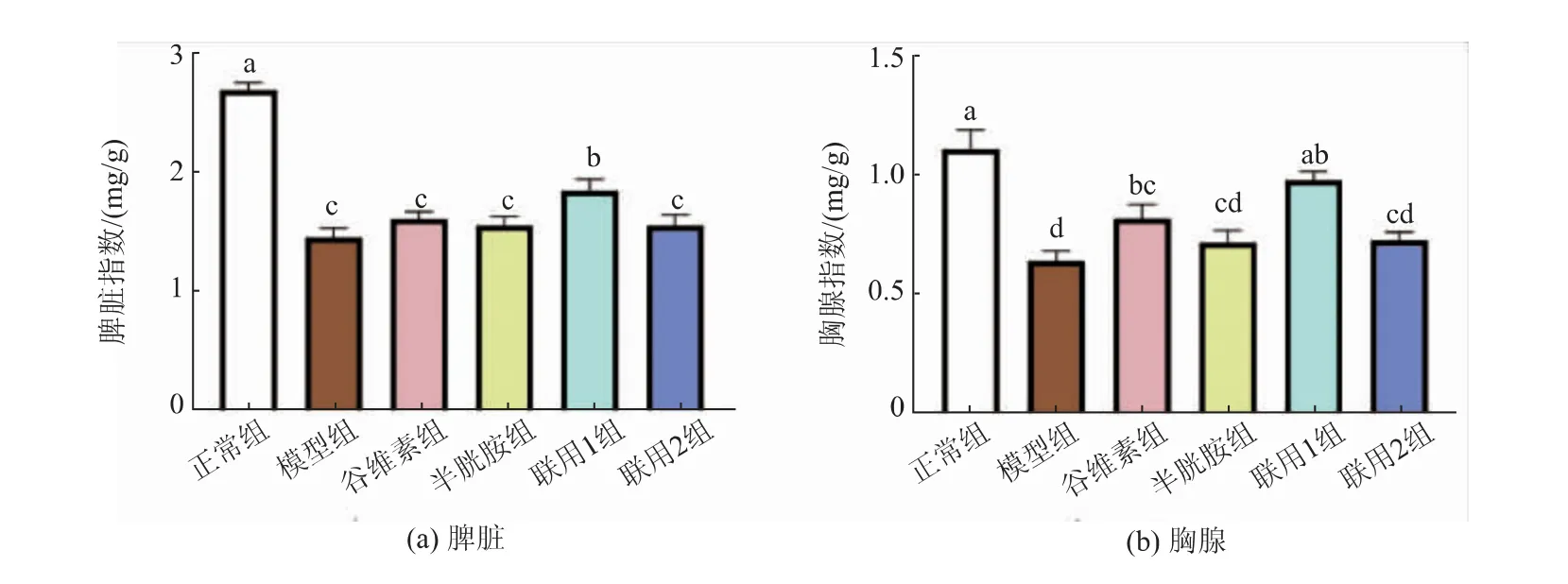
图10 γ-谷维素和半胱胺对应激小鼠脏器指数的影响Fig. 10 Effect of γ-oryzanol and cysteamine on spleen and thymus index in stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠血浆中免疫球蛋白质量浓度的影响见图11。 由图中可以看出,模型组血浆中免疫球蛋白质量浓度均显著低于正常组(P<0.05),谷维素组、半胱胺组、联用1 组和联用2 组相对于模型组均有一定程度的提高。 联用1 组血浆中免疫球蛋白质量浓度均显著高于模型组(P<0.05),其中IgM 和IgG 质量浓度与正常组无显著差异(P>0.05)。 谷维素组和联用2 组血浆中IgG 质量浓度均显著高于模型组(P<0.05),IgA 和IgM 质量浓度比模型组略高, 但均无显著性差异(P>0.05)。 半胱胺组血浆中IgA、IgM 和IgG 质量浓度与模型组相比略高, 但无显著性差异(P>0.05)。

图11 γ-谷维素和半胱胺对应激小鼠血浆中免疫球蛋白质量浓度的影响Fig. 11 Effect of γ-oryzanol and cysteamine on the content of immunoglobulin in plasma of stressed mice
饲料中添加不同剂量的γ-谷维素和半胱胺对应激小鼠血浆中细胞因子水平的影响见图12。由图中可以看出, 模型组血浆中促炎因子肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)质量浓度均显著高于正常组(P<0.05),抑炎因子白细胞介素-10(IL-10)质量浓度显著低于正常组(P<0.05)。 联用1组TNF-α 和IL-6 质量浓度均显著低于模型组(P<0.05),且与正常组无显著性差异(P>0.05),IL-10 质量浓度显著高于模型组(P<0.05)。 谷维素组和联用2 组TNF-α 和IL-6 质量浓度均显著低于模型组(P<0.05),但均高于联用1 组,IL-10 质量浓度比模型组略有提高,但差异不显著(P>0.05)。 半胱胺组IL-6 质量浓度显著低于模型组(P<0.05),TNF-α 和IL-10 质量浓度与模型组无显著性差异(P>0.05)。
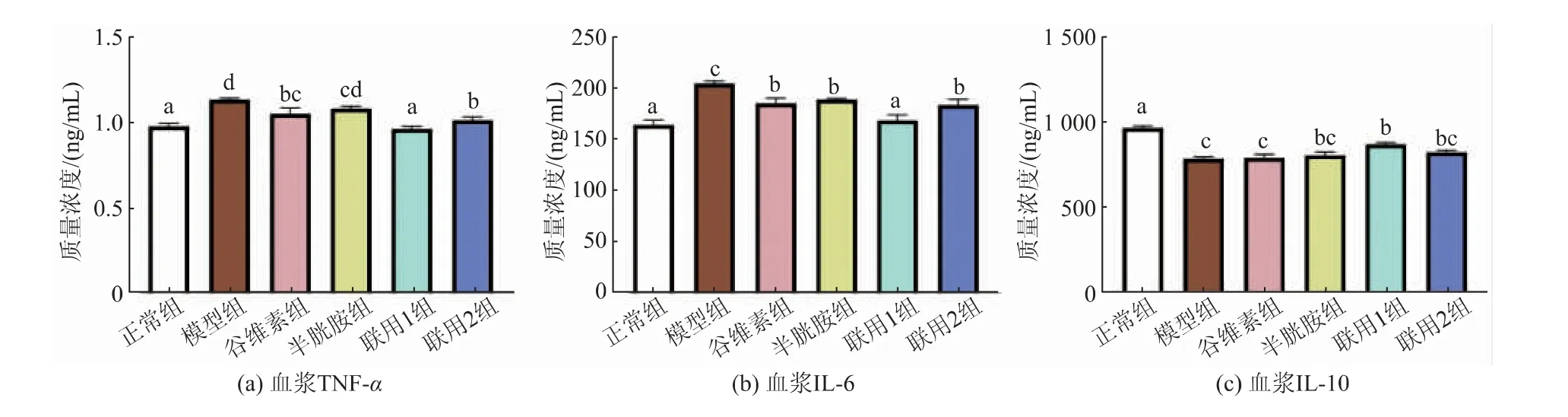
图12 γ-谷维素和半胱胺对应激小鼠血浆中TNF-α、IL-6 和IL-10 质量浓度的影响Fig. 12 Effect of γ-oryzanol and cysteamine on plasma TNF-α、IL-6 and IL-10 in stressed mice
2.4 讨论
超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)是体内抗氧化防御系统中的两种关键酶[17],可以有效清除自由基。T-AOC 是衡量机体氧化应激水平和抗氧化能力的重要指标[18]。MDA 是一种脂质过氧化产物,反映体内脂质过氧化程度,也用于衡量机体氧化应激水平。 研究表明,氧化应激会导致体内抗氧化酶的活性和含量大幅下降, 同时MDA水平显著升高[19],而抗氧化剂的补充可缓解这一状况。 半胱胺可以通过发挥抗氧化作用来缓解应激,刘智通过在仔猪饲料中添加半胱胺显著提高了血浆中GSH-Px 的活力[20]。 γ-谷维素由于其结构中的阿魏酸基团可以在生物体内发挥较好的抗氧化作用, 研究表明,γ-谷维素可以提高小鼠肝脏和血清中CAT、SOD、GSH-Px 和GSH 的活性,同时显著降低MDA 的含量[21-22]。 本研究结果表明,模型组体内总SOD 活力、GSH-Px 活力和T-AOC 显著低于正常组,且MDA 水平显著高于正常组,表明成功建立了氧化应激模型;γ-谷维素和半胱胺单用时均可以在一定程度上提高机体的抗氧化能力,缓解应激,与前人研究结果一致;联用1 组体内的抗氧化酶活力及T-AOC 相对于模型组均有显著提高,MDA 水平显著降低,在4 组用药组中对抗氧化应激的效果最明显,说明低剂量γ-谷维素与半胱胺联用显著改善了机体的氧化损伤,考虑可能是由于γ-谷维素因其脂溶性结构可以进入线粒体内清除自由基[23],而半胱胺在胞浆中发挥作用[16],并使GSH-Px 活力显著提高,二者在体内协同发挥抗氧化作用;但是当二者以较高剂量联用时, 并没有表现出这种作用,可能是由于高剂量的半胱胺具有细胞毒性[24],反而加重了氧化应激。
过量ROS 对线粒体膜、 蛋白质及DNA 进行攻击造成氧化损伤, 从而引起线粒体结构和功能异常,表现为线粒体膜电位降低[25]、氧化磷酸化等能量代谢过程紊乱、ATP 合成减少[12,26]等。 线粒体Mn-SOD 活力及MDA 含量是衡量线粒体抗氧化能力及其内部氧化还原状态的重要指标。线粒体膜电位[27]、乙酰辅酶A[28]和ATP 含量常被用来作为衡量线粒体功能的重要指标。 研究表明,氧化应激会导致线粒体内抗氧化酶活性降低,线粒体结构和功能被破坏,最终引起细胞凋亡[29]。 本研究结果显示,模型组线粒体Mn-SOD 活力相对于正常组显著降低,MDA质量摩尔浓度显著增加,且膜电位、能量代谢中间物A-CoA 和ATP 质量摩尔浓度显著降低, 表明模型组小鼠线粒体内部氧化还原稳态失衡,受到氧化损伤,从而导致线粒体功能障碍,与前人研究结果一致;谷维素组总体上可以缓解氧化应激造成的线粒体功能受损,类似的,蒋维维表示γ-谷维素作为抗氧化剂可有效对抗H2O2诱导的肝细胞线粒体膜电位的降低,减轻细胞损伤[13];但是本研究结果中半胱胺组对线粒体功能的调节作用不明显, 而联用1组的效果在4 组用药组中最为显著,可明显提高应激小鼠体线粒体内Mn-SOD 活力, 降低MDA 质量摩尔浓度, 显著改善了线粒体脂质过氧化程度,且使线粒体膜电位、A-CoA 和ATP 水平得到显著提升, 有效缓解了应激条件下造成的线粒体损伤,推测可能是一方面γ-谷维素进入线粒体直接有效地中和了过多的ROS,另一方面半胱胺和γ-谷维素间接作用于内源性抗氧化防御系统,提高线粒体内抗氧化酶的活性,来共同抵御线粒体氧化损伤和功能受损。
脾脏和胸腺是机体发挥免疫作用的重要场所,其大小可以在一定程度上反映机体的免疫功能强弱[30]。 研究表明,机体在应激条件下会发生免疫抑制,出现免疫器官萎缩,细胞因子异常释放,血液中免疫球蛋白水平降低等。 本研究结果显示,相对于正常组,模型组小鼠的脾脏指数和胸腺指数、血浆中IgA、IgM 和IgG 质量浓度和抑炎因子IL-10 质量浓度显著降低, 促炎因子TNF-α 和IL-6 质量浓度显著升高,表明应激小鼠体内免疫功能受损,与前人结论一致。 田媛媛表示谷维素可能通过下调TNF-α 和IL-6 相关基因表达来抑制促炎因子的分泌,从而发挥抗炎作用[31],与本研究谷维素组结果一致。 王建峰等发现,半胱胺可以通过增强体内的抗氧化能力来提高机体的免疫能力[32],但本研究结果中半胱胺组的作用效果没有那么显著,可能是实验条件造成的差异。 本研究中联用1 组对应激小鼠的免疫功能起到明显的调节作用,在4 组用药组中效果最显著,与上面的研究结果一致,表明当γ-谷维素与半胱胺以较低剂量联用时可能通过缓解小鼠体内的氧化应激来有效调节机体的免疫应答功能。
3 结语
本研究结果表明,γ-谷维素和半胱胺单独使用对应激小鼠的氧化还原状态和免疫功能均有一定程度的改善作用,但是当二者以较低剂量联用时的作用效果比较高剂量的单用和联用都显著,表明当γ-谷维素和半胱胺以较低剂量联用时可以起到协同作用,在体内充分发挥抗氧化功效,进而调整机体免疫系统。 究其原因,可能是γ-谷维素直接进入到线粒体内部清除自由基,而半胱胺在线粒体外的细胞浆内发挥作用,二者共同帮助机体增强抗氧化防御体系,但其作用部位及具体的作用机制还待进一步研究。
