达格列净改善糖尿病动脉粥样硬化模型小鼠斑块的作用机制
2022-04-29张唯薇蒋梦婷
方 岩,张唯薇,蒋梦婷,宋 玲,刘 杰,易 丽,李 泱,高 磊
1 解放军医学院,北京 100853;2 解放军总医院第六医学中心 心血管病医学部,北京 100853;3 解放军总医院第一医学中心 心内科,北京 100853
动脉粥样硬化(atherosclerosis,AS)是引起冠心病的重要原因,合并糖尿病(diabetes mellitus,DM)的冠心病患者血运重建获益低,主要不良心血管事件发生率高,是棘手的临床问题[1-2]。降糖药是治疗糖尿病的重要手段,但传统降糖药缺乏心血管保护作用。钠-葡萄糖共转运体2(sodiumglucose cotransporter-2,SGLT2)抑制剂作为新型降糖药,因在心血管方面的独特保护作用受到广泛关注。尤其是DECLARE系列研究,揭示了SGLT2抑制剂达格列净在糖尿病和非糖尿病人群中都有保护作用[3]。SGLT2抑制剂的主要药理作用是抑制葡萄糖在肾的再吸收,促进葡萄糖排泄[4]。除此之外,抑制血管炎症、减少氧化应激、减少泡沫细胞形成等也是其改善AS的潜在方式[5-6],但具体机制有待进一步研究。有研究表明,SGLT2抑制剂可以降低巨噬细胞的炎症水平,抑制包括(interleukin,IL)-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)在内的多种炎症因子的分泌[7]。巨噬细胞参与了AS发生发展的全过程,巨噬细胞迁移到斑块后,通过分泌多种炎症因子,引起斑块负荷增大和纤维帽破裂,诱发不良心血管事件[8]。粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)是巨噬细胞分泌的重要炎症因子,可以激活下游信号通路,促进巨噬细胞的分化、成熟、增殖,诱导多种相关细胞因子的分泌,加重AS斑块的进展[9-10]。同时,针对GMCSF的抗体通过调控髓系细胞和淋巴系细胞功能,可以降低MCP-1、IL-6、TNF-α等炎症因子水平,是心血管病免疫治疗的潜在靶点[11-12]。因此,SGLT2抑制剂可能通过减少GM-CSF及其下游炎症因子的分泌,减缓斑块内巨噬细胞浸润,改善糖尿病动脉粥样硬化。本研究选取链脲佐菌素(streptozocin,STZ)诱导的糖尿病动脉粥样硬化ApoE-/-小鼠和脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7巨噬细胞系作为研究对象,使用SGLT2抑制剂达格列净分别进行在体和离体干预,旨在观察达格列净对糖尿病AS斑块内巨噬细胞浸润的影响,并探究其机制。
材料与方法
1 实验动物 6周龄雄性C57BL/6基因背景的ApoE-/-小鼠30只,SPF级,普通饲料适应性饲养1周后,第2周逐步替换为高脂高胆固醇饲料饲养,上述小鼠和饲料均购于斯贝福北京生物®技术有限公司。小鼠饲养环境:室温22~24℃,湿度40%~60%,光暗间隔12 h,每笼3~4只,自由饮水。上述实验方案经解放军总医院实验动物福利伦理委员会审查通过。
2 实验材料 小鼠巨噬细胞系RAW264.7(中国科学院上海细胞库),RPMI-1640完全培养基(武汉普诺赛®生命科技有限公司),PBS缓冲液[赛默飞®世尔科技(中国)有限公司],二甲基亚砜(Dimethyl sulfoxide,DMSO;Sigma-Aldrich®公司),LPS(Sigma-Aldrich®公司),CCK-8试剂盒 (日本同仁化学研究所),小鼠GM-CSF、IL-6、TNF-α、MCP-1 ELISA试剂盒(北京成志科为®生物科技有限公司),4%多聚甲醛固定液(武汉赛维尔®生物科技有限公司),改良油红O染色液(北京索莱宝®科技有限公司),Anti-F4/80、Anti-Cleaved Caspase 3抗体[艾博抗(上海)®贸易有限公司],生物素化山羊抗兔IgG(北京中杉金桥®生物技术有限公司)。
3 动物分组及建模 上述30只小鼠分为动脉粥样硬化组(Con组,n=10)、动脉粥样硬化合并糖尿病胰岛素干预组(Insulin组,n=10)和动脉粥样硬化合并糖尿病达格列净干预组(Dapa组,n=10)。高脂高胆固醇饲料饲养8周后,禁食14 h,Insulin组和Dapa组小鼠腹腔注射STZ(Sigma-Aldrich公司),剂量50 mg/kg,连续5 d[13]。注射结束1周后,尾静脉采血测血糖,3次随机血糖>16.7 mmol/L视为糖尿病造模成功。糖尿病造模成功后,Insulin组小鼠腹腔注射甘精胰岛素(0.75 U/mL,赛诺菲北京®制药有限公司) 200 µL,Dapa组小鼠腹腔注射达格列净(1 mmol/L,上海阿拉丁生化科技®股份有限公司) 200 µL,1次/d,连续8周,定期监测体质量,眼眶静脉丛采血测血糖和血脂等。
4 小鼠血管取材及切片 连续干预8周后,经异氟烷麻醉,全身灌注固定上述小鼠。具体操作:麻醉后,暴露小鼠心脏,剪开小鼠右心耳,5 mL注射器针头扎入左心室,缓慢推注PBS缓冲液。推注5~10 min观察肝变白后,换4%多聚甲醛固定液继续缓慢推注5~10 min。暴露位于脊柱左前侧的完整主动脉和心脏,眼科镊轻轻剥离主动脉周围脂肪组织,小心剪去主动脉走行过程中发出的分支,分离出上至头臂干、左颈总动脉、左锁骨下动脉,下至髂动脉分叉的完整大体血管标本和心脏,浸泡于4%多聚甲醛固定液。心脏经沉糖48 h后,OCT包埋剂包埋,在冰冻切片机上进行主动脉根部连续切片,切片厚度6 µm,每套收集30张切片。
5 病理染色 1)大体油红O染色:将大体血管标本置于4%多聚甲醛中固定24 h以上,取出后PBS缓冲液浸洗2次,用弹簧剪小心地将血管纵向剖开。将剖开的血管浸入改良油红O染液中,37℃浸染60 min,75%乙醇分化,使血管壁内侧脂肪斑块呈橘红色或鲜红色,其余位置接近无色。蒸馏水洗涤2次后,将染好的大体血管标本平展固定在黑色平板上拍照。使用Image J软件定量分析油红O染色阳性动脉粥样硬化病变面积占血管总面积的百分比。2)切片油红O染色和HE染色:将上述主动脉根部切片按照传统方法进行染色后拍照。使用Photoshop勾勒出每张切片斑块轮廓和管腔轮廓,使用Image J软件定量分析每张切片中油红O染色阳性区域面积占斑块面积的百分比和HE染色斑块面积占主动脉管腔面积的百分比。3)免疫组化染色:将上述主动脉根部冰冻切片室温下平衡30 min后,丙酮固定10 min。PBS洗3次,每次5 min,3%过氧化氢孵育5 min。再用PBS洗3次后,每次5 min,室温下山羊血清封闭10 min,接着滴加含F4/80抗体(稀释200倍)的一抗工作液,湿盒内4℃过夜。PBS洗3次,每次5 min,滴加生物素标记二抗,37℃孵育30 min。PBS洗3次,每次5 min,滴加辣根酶标记链霉卵白素,37℃孵育30 min。PBS洗3次,每次5 min,滴加DAB显色剂显色。自来水充分冲洗,复染,封片,显微镜下拍照。使用Image J软件定量分析每张切片中斑块内F4/80阳性区域面积占斑块面积的百分比。
6 RAW264.7细胞培养和达格列净浓度预实验 冻存细胞复苏后,配置RPMI 1640完全培养基并培养细胞[14]。培养环境:孵箱温度37℃,5%CO2。每48 h换液1次,当细胞密度达到80% ~90%时进行传代,选择复苏后2~6代对数生长期的细胞进行研究。使用DMSO溶解达格列净,将含有达格列净的DMSO溶解于培养基中。将RAW264.7细胞接种于96孔板,按照0.2%DMSO,0、1、5、10、50、100、500 mmol/L设置达格列净干预浓度梯度,每个梯度设6个复孔。培养24 h后,每孔中加入100 µL新鲜培养基和10 µL CCK-8试剂,孵箱孵育2 h,酶标仪检测450 nm处的吸光度(optical density,OD)。将0 mmol/L达格列净对应OD值为参考,设为100%,其余各组结果均以此为参考用百分比表示,选择未对细胞产生明显毒性的最大浓度行进一步干预实验。
7 达格列净干预后RAW264.7细胞增殖和凋亡检测 按照上述CCK-8接种方法,加入50 mmol/L达格列净进行干预,分别在0 h、24 h、48 h、72 h加入CCK-8试剂,孵育2 h后检测450 nm处的OD值,观察OD值随时间变化情况。在六孔板中接种RAW264.7细胞,加入50 mmol/L达格列净进行干预,培养72 h后提取细胞蛋白进行Western blot实验,检测目的条带Cleaved Caspase 3(CL Caspase3)和内参β-actin,使用Image J软件对结果进行半定量分析。对照组加入与50 mmol/L达格列净含相同浓度DMSO的培养基。每组重复3次。
8 ELISA检测细胞上清炎症因子 将RAW264.7细胞接种于24孔板,实验组使用达格列净(50 mmol/L)预处理24 h后,加入LPS(100 nmol/L)诱导炎症,继续培养24 h。然后取24孔板中细胞培养基上清液,按照ELISA试剂盒操作步骤,检测细胞上清液中IL-6、MCP-1、TNF-α、GM-CSF的浓度。炎症对照组加入与50 mmol/L达格列净含相同浓度DMSO的培养基预处理24 h,然后加入LPS(100 nmol/L)继续培养24 h。另设无上述处理的RAW264.7细胞培养48 h作为空白对照组。每组实验重复3次。
9 统计学方法 运 用 软 件SPSS19.0进 行 统计分析。计量资料以±s表示。两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
结 果
1 达格列净干预后小鼠基础生理指标变化 经STZ处理后,Insulin组和Dapa组小鼠3次随机血糖均较Con组升高,并超过16.7 mmol/L,提示糖尿病AS模型小鼠构建成功(图1)。模型构建成功的小鼠按照分组进行8周干预。Insulin组和Dapa组小鼠干预8周后随机血糖较各组干预前均明显降低(P< 0.05),且两组间无统计学差异。小鼠体质量监测结果显示,干预8周后,Insulin组和Dapa组体质量均较Con组下降,Insulin组与Dapa组组间体质量差异无统计学意义。干预8周后,各组间三酰甘油和总胆固醇差异无统计学意义。
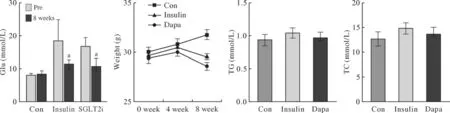
图1 达格列净干预后,小鼠血糖、体质量、三酰甘油、总胆固醇指标变化情况(aP<0.05, vs Pre)Fig.1 Changes of blood glucose, body weight, triglyceride and total cholesterol in mice after dapagliflozin intervention (aP<0.05, vs pre)
2 达格列净干预对动脉粥样硬化病变的影响 小鼠动脉大体油红O染色结果表明,Insulin组AS病变面积占血管总面积的百分比较Con组明显升高,提示糖尿病会加速AS病变(图2)。在糖尿病AS小鼠中,Dapa组AS病变面积占血管总面积的百分比较Insulin组明显降低(P<0.05),证实了达格列净延缓糖尿病AS病变进展。
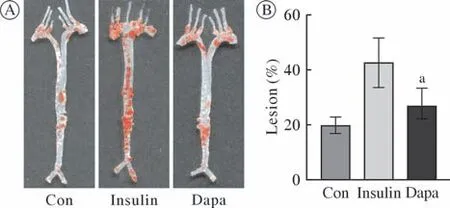
图2 大体油红O染色评估达格列净干预后动脉粥样硬化病变Fig.2 Lesion of atherosclerosis after dapagliflozin intervention evaluated by gross oil red O staining
3 达格列净干预后主动脉根部动脉粥样硬化斑块性质和大小 主动脉根部切片的油红O染色(oil red O staining,ORO)和HE染色结果进一步证实了达格列净延缓糖尿病AS斑块进展(图3)。ORO结果显示,各组ORO阳性区域面积占斑块面积百分比均超过50%,证实了斑块内富含脂质成分。HE染色结果显示,Dapa组斑块面积占管腔面积百分比较Insulin组明显降低(P< 0.05)。
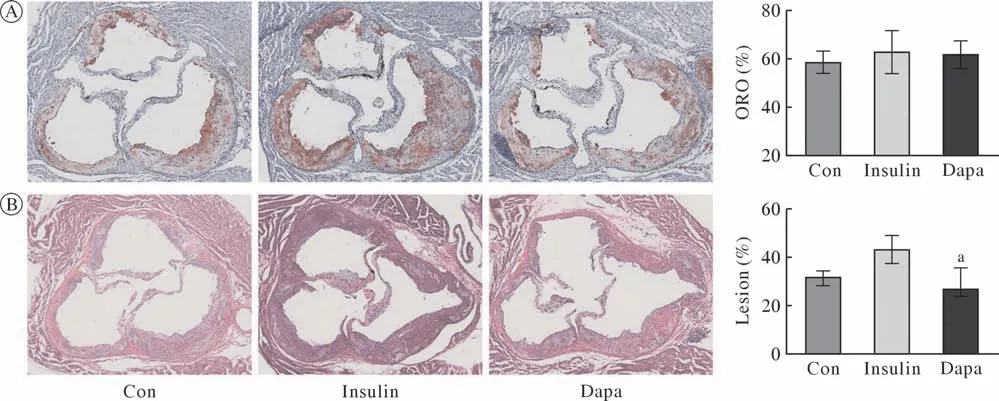
图3 油红O染色和HE染色评估达格列净干预后主动脉根部动脉粥样硬化斑块性质及大小Fig.3 Characteristics and size of atherosclerotic plaque in aortic root after dagaglizin intervention evaluated by oil red O staining and HE staining
4 动脉粥样硬化斑块内巨噬细胞分布 主动脉根部切片的免疫组化结果显示(图4),F4/80阳性巨噬细胞主要分布于主动脉根部AS斑块肩部或者脂质核心的上方,还有少量分布于斑块内部的坏死核心边缘,这与既往研究结果一致。F4/80免疫组化染色结果局部放大,可以清楚显示各组斑块内巨噬细胞浸润情况,Insulin组巨噬细胞浸润数量最多。定量分析进一步表明,与Insulin组相比,Dapa组糖尿病动脉粥样硬化斑块内巨噬细胞浸润面积明显减少(P<0.01)。
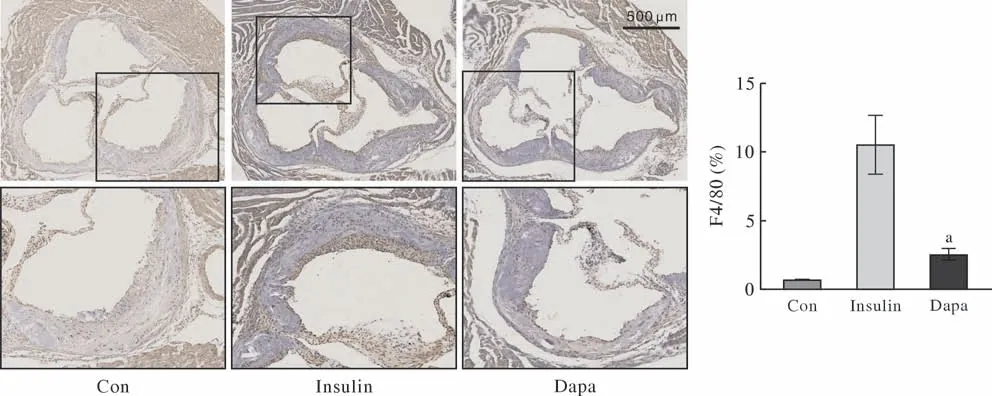
图4 达格列净干预后,不同组间动脉粥样硬化斑块内巨噬细胞浸润情况(aP<0.01, vs Insulin)Fig.4 Macrophage infiltration in atherosclerotic plaques among groups after dapagliflozin intervention (aP<0.01, vs insulin)
5 CCK-8筛选达格列净干预最佳浓度 达格列净干预24 h后,CCK-8结果显示,随着达格列净浓度升高,RAW264.7细胞活性较空白组出现下降趋势(图5)。其中,浓度为100 µmol/L和500 µmol/L时,细胞活性显著低于空白组(P< 0.01),浓度为50 µmol/L时,细胞活性与空白组相比无显著性变化,且各组中最大DMSO浓度(0.2% DMSO)组与空白组相比无显著变化,排除了DMSO对活性的影响。因此50 µmol/L达格列净是不影响细胞活性的最大浓度,可作为达格列净干预的最佳浓度。
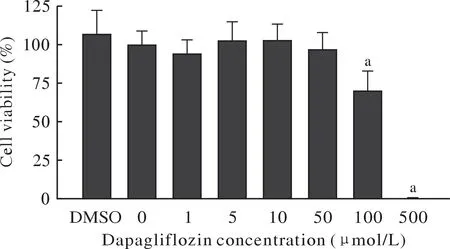
图5 CCK-8检测达格列净干预对RAW264.7细胞活性的影响(aP<0.01, vs 0 µmol/L)Fig.5 Effect of dapagliflozin intervention on RAW264.7 cell viability detected by CCK-8 (aP<0.01, vs 0 µmol/L)
6 达格列净对RAW264.7细胞增殖和凋亡的影响 CCK-8增殖实验显示,随着培养时间的延长,达格列净组(Dapa)和对照组(Con)的OD值均不断增加(图6)。达格列净(50 µmol/L)干预72 h,可见Dapa组OD值较Con组出现明显下降,差异有统计学意义(P< 0.05),证实了达格列净对RAW264.7细胞增殖的抑制作用。Western blot结果可见,凋亡相关蛋CL Caspase3条带在Dapa组与Con组之间无显著差异,进一步的半定量分析也未见两组间有统计学差异,提示达格列净(50 µmol/L)未对巨噬细胞凋亡产生显著影响。
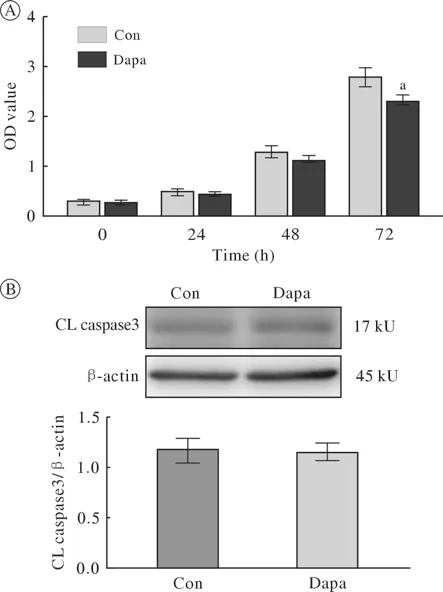
图6 达格列净对RAW264.7细胞增殖和凋亡的影响Fig.6 Effect of dapagliflozin on proliferation and apoptosis of RAW264.7 cells
7 达格列净对LPS诱导的RAW264.7细胞炎症因子分泌的影响 采用ELISA方法检测干预后各组细胞上清液中炎症因子分泌情况(图7)。结果显示,与空白对照组(Con)相比,炎症对照组(LPS)中炎症因子IL-6、TNF-α、MCP-1、GM-CSF明显升高,证实体外RAW264.7细胞炎症模型诱导成功[15-16]。实验组(LPS + Dapa)经达格列净预处理后,与LPS组相比,IL-6、MCP-1显著下降(P<0.05),TNF-α有下降趋势,但无统计学差异。同时,与LPS组相比,LPS + Dapa 组GM-CSF也显著降低(P<0.01),表明达格列净通过体外直接作用抑制了GM-CSF等细胞炎症因子的分泌。

图7 ELISA检测达格列净对LPS诱导RAW264.7细胞炎症因子分泌的影响(aP<0.05, bP<0.01, vs LPS)Fig.7 Effects of dapagliflozin on LPS-induced secretion of inflammatory cytokines in RAW264.7 cells detected by ELISA ( aP<0.05, bP<0.01,vs LPS)
讨 论
近年来,EMPA-REG、CANVAS、DECLEAR等多个SGLT2抑制剂的大型临床研究表明,SGLT2抑制剂在降低血糖的同时,可显著降低糖尿病合并心血管疾病或心血管高危因素患者的心血管预后[3,17-18]。DECLEAR研究进一步揭示了SGLT2抑制剂在降低致命和非致命AS相关事件风险中的重要作用[3,19]。SGLT2抑制剂改善糖尿病患者AS的作用方式,除了直接控制血糖外,还包括减轻容量负荷、保护肾、减少炎症等方面[7],但其具体机制仍不清楚。本研究发现SGLT2抑制剂抑制巨噬细胞增殖和GM-CSF相关炎症因子分泌可能是改善糖尿病动脉粥样硬化的机制之一。
在小鼠动物模型中,达格列净、恩格列净、卡格列净等被证明可以减轻糖尿病动脉粥样硬化病变[20-22]。Leng等[20]的研究显示,与对照组相比,达格列净可使糖尿病ApoE-/-小鼠胸主动脉和腹主动脉粥样硬化病变面积减少34%,主动脉根部病变面积减少64%。本研究中,达格列净干预组小鼠主动脉糖尿病AS病变面积百分比与胰岛素组相比减少了38%,主动脉根部病变面积百分比与胰岛素组相比减少了25%,与上述研究结论一致。本研究还发现,合并糖尿病的AS小鼠斑块内大量巨噬细胞浸润,达格列净剂干预8周后,斑块内巨噬细胞浸润较胰岛素组明显减少,这与Ganbaatar等[23]使用恩格列净干预结果类似。同时,本研究使用胰岛素干预作为阳性对照,保证了达格列净和胰岛素两组血糖、体质量、血脂等指标的一致性,排除了上述因素对结果的干扰,使结论更为可靠。
多项研究表明,GM-CSF作为促炎细胞因子,可以加重多种慢性自身免疫和炎症性疾病,包括类风湿关节炎、多发性硬化和动脉粥样硬化[9-10]。GM-CSF可以有效刺激粒细胞和单核-巨噬细胞系的增殖、分化和成熟[10-11],促进巨噬细胞在斑块内的浸润[10-11,24]。小鼠静脉注射GM-CSF可显著促进动脉粥样硬化病变细胞增殖,而抗GM-CSF抗体功能阻断GM-CSF则可抑制细胞增殖[24]。GM-CSF可以诱导巨噬细胞产生更多TNF-α、IL-6等炎症因子,并通过离体作用促进促炎M1巨噬细胞形成,与体内巨噬细胞M1极化有关[25]。本研究使用LPS处理小鼠巨噬细胞RAW264.7,诱导细胞炎症模型,GM-CSF分泌水平显著升高。达格列净预处理后,GM-CSF及IL-6和MCP-1水平显著下降,证明了SGLT2抑制剂可以通过直接作用减轻巨噬细胞炎症,并且可以减少GM-CSF及其下游炎症因子的分泌。上述途径可能是达格列净减少斑块内巨噬细胞浸润的原因之一。另外,本研究显示达格列净可以抑制巨噬细胞增殖,可能也与达格列净抑制GM-CSF分泌,进而减弱细胞增殖能力有关。Ying等[9]的研究发现,内质网应激可以通过转录因子NF-κB增加GM-CSF旁分泌,使动脉粥样硬化斑块不稳定。Yang等[26]的研究也证实了NF-κB在调控GM-CSF分泌中的作用。部分离体实验表明,达格列净可以降低LPS诱导的H9c2细胞中NF-κB的表达,抑制高糖诱导的NF-κB的激活,从而抑制炎症改变[27-28]。因此,NF-κB可能是达格列净降低巨噬细胞分泌GM-CSF的途径之一,这有待进一步的研究证实。同时,相关研究表明另一种SGLT2抑制剂卡格列净可抑制血管平滑肌细胞迁移和增殖,该抑制作用发生在没有细胞死亡的情况下,并与细胞周期阻滞和DNA合成减少有关[29]。结合本研究的凋亡检测结果,50 µmol/L达格列净抑制巨噬细胞增殖的同时未对巨噬细胞凋亡产生影响,达格列净抑制巨噬细胞增殖可能与细胞周期阻滞有关,而非诱导凋亡,这有待进一步实验证实。
综上,本研究证实SGLT2抑制剂达格列净可以抑制巨噬细胞的增殖和GM-CSF及相关下游炎症因子的分泌。这可能是达格列净减少糖尿病动脉粥样硬化斑块内巨噬细胞浸润、改善糖尿病动脉粥样硬化的机制之一。
