外周血相关指标对晚期尿路上皮癌患者一线PD-1单抗治疗疗效的预测价值
2022-04-29韩馥馨李玲玲李晓燕
韩馥馨,李玲玲,李晓燕,胡 毅
1 解放军总医院第五医学中心 肿瘤学部,北京 100039;2 解放军总医院第一医学中心 肿瘤内科,北京100853
尿路上皮癌(urothelial carcinoma,UC)是泌尿系统最常见的恶性肿瘤之一。据2020年全球癌症统计数据(GLOBOCAN 2020)中的全球恶性肿瘤发病率和死亡率,膀胱癌是全球第10大常见癌症,2020年新发病例57.3万,死亡病例21.3万,在男性新发病例中排名第6位,死亡病例中排名第9位[1]。据统计,我国膀胱癌的发病率在不断升高,且仍有继续升高的趋势[2]。近年来,多项应用免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗UC的研究逐渐开展,并且取得了巨大突破。基于多项临床研究结果,自2016年起多种ICIs被批准用于晚期UC患者的二线治疗[3-9]、不能耐受含铂化疗患者的一线治疗[10-11]以及在一线化疗肿瘤得到控制后的维持治疗。国内一项真实世界研究结果认为一线PD-1单抗联合化疗较单纯化疗具有更好的疗效,且两组不良反应相当[12]。ICIs在UC治疗中带来的生存获益令人鼓舞,但获益人群的筛选是免疫治疗的主要挑战。既往研究中关注的生物标志物主要包括PD-L1/PD-1表达情况、肿瘤突变负荷(tumor mutation burden,TMB)等,虽然它们对ICIs在临床应用具有指导意义并对ICIs的疗效具有一定的预测作用,但作为独立预测标志物尚不够成熟[13]。PD-L1及TMB的检测主要依赖于对病理组织的免疫组化或全外显子基因组测序,而病理组织的获取多为有创介入操作,且检测组织部位、时机、平台和结果判读标准等均可能影响研究结果,因此与免疫治疗相关的生物标志物需要进一步研究[14]。近几年外周血液学指标与免疫治疗疗效相关性的研究越来越多,主要指标包括血红蛋白(hemoglobin,Hb)、中性粒-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)等。既往已有研究显示NLR作为简单且易于获得的生物标志物,可用于帮助预测晚期恶性黑色素瘤和晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者免疫治疗的应答及预后[15-17]。自2017年起,解放军总医院第一医学中心肿瘤内科在知情同意的晚期UC患者中开始尝试一线免疫治疗。本研究通过系统回顾46例一线接受PD-1单抗治疗的晚期UC患者的外周血相关指标与疗效及生存预后的相关性,旨在为免疫治疗应用于晚期UC患者的一线治疗提供一定的临床参考。
对象与方法
1 研究对象 收集2017年3月- 2020年4月于解放军总医院第一医学中心肿瘤内科住院接受一线PD-1单抗(单药或联合化疗)治疗的晚期UC患者,包括肿瘤位于膀胱、输尿管及肾盂部位的病理诊断为“尿路上皮癌”的患者。纳入标准:1)原发肿瘤或转移病灶的组织病理学诊断明确为尿路上皮癌,根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)对膀胱癌及UC的TNM分期标准,结合相关影像学检查分期为ⅢB~Ⅳ期不可手术或术后发生复发转移的晚期UC患者;2)有最少1个可通过影像学资料进行测量或评估疗效的原发或转移病灶,并有相关影像学资料可供测量和评价;3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≤3分,患者充分了解并同意治疗方案后接受一线PD-1单抗治疗≥2个周期。排除标准:1)基线评估患者ECOG评分>3,无法耐受免疫治疗,或合并严重心肺功能疾病、其他原发肿瘤等可能影响生存的疾病;2)存在遗传性/获得性免疫缺陷疾病、自身免疫性疾病、器官移植史等免疫治疗禁忌证;3)无可评估疗效的病灶或影像学资料。
2 分析指标 1)一般资料和临床资料:包括性别、年龄、病理类型、ECOG评分、TNM分期、治疗方案等。2)疗效评价指标:即第一次注射PD-1单抗前1周内及接受治疗6周后的血液检测结果,包括Hb、绝对中性粒细胞计数(absolute neutrophil count,ANC)、绝对淋巴细胞计数(absolute lymphocyte count,ALC)、绝对单核细胞计数(absolute monocyte count,AMC)及血小板(platelet,PLT)计数;计算所有患者NLR、PLR、淋巴细胞-单核细胞比值(lymphocyte to monocyte ratio,LMR)及系统免疫炎症指数(systemic immune-inflammation index,SII;SII=PLT×NLR);计算上述指标的中位数,作为每个变量分组的Cut-off值,将研究对象按中位数分为高组和低组,分别比较两组中位无进展生存期(progression-free survival,PFS)差异。
3 统计学方法 统计学软件应用SPSS26.0。应用单因素分析筛选差异有统计学意义的变量,纳入Cox模型多因素分析,探究影响疾病进展的危险因素。应用Kaplan-Meier生存模型和log-rank检验确定中位PFS的组间差异,通过受试者工作特征(receiver operation characteristic,ROC)曲线评估差异有统计学意义指标的结局预测能力,P<0.05为差异有统计学意义。
结 果
1 基线特征 纳入研究对象共46例,其中膀胱癌17例,输尿管癌15例,肾盂癌14例,病理类型均为尿路上皮癌,TNM分期为ⅢB~Ⅳ期。所有研究对象均在一线治疗中应用PD-1单抗,其中单免疫治疗12例,免疫联合化疗34例。见表1。
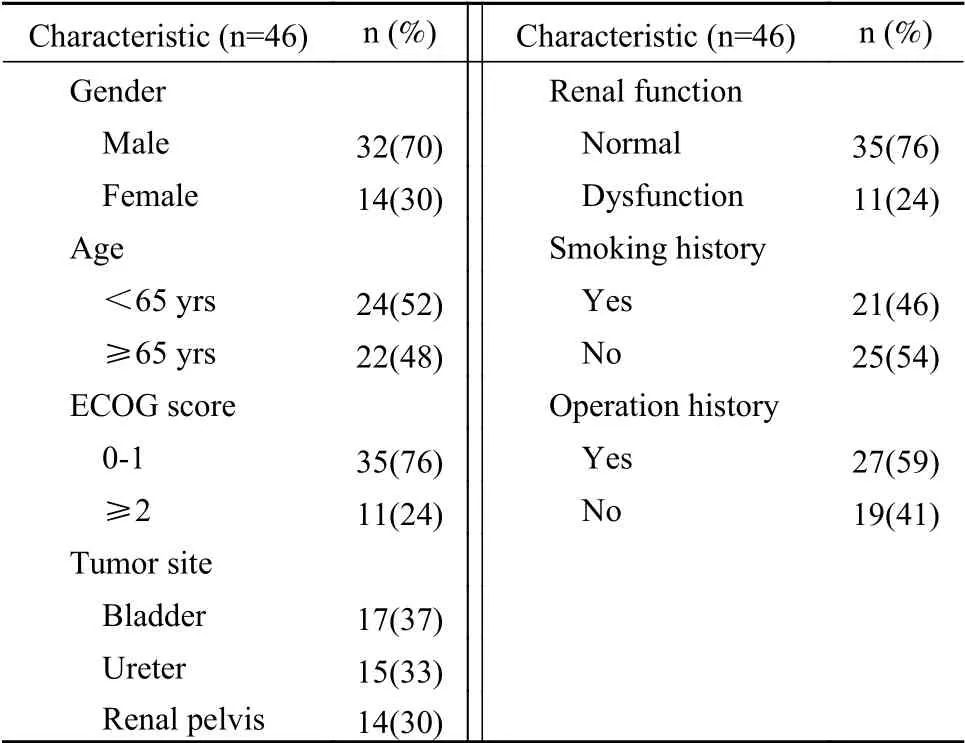
表1 46例UC患者的基线特征Tab. 1 Baseline characteristics of the 46 patients with UC
2 46例UC患者的PFS资料及其Kaplan-Meier生存曲线 46例患者的PFS为3~22+个月(+表示截尾数据,即截至2020年4月时收集的PFS月数),平均PFS为10.2个月,中位PFS为10.5个月。具体数据参见PFS生存曲线(图1)。
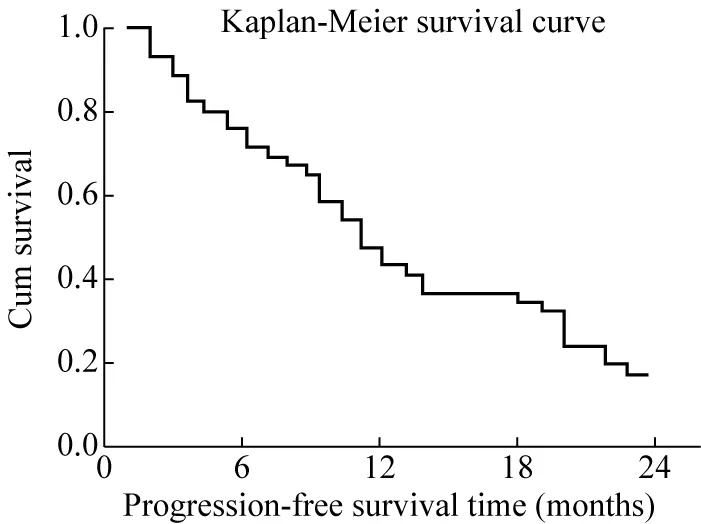
图1 46例UC患者的PFS资料(Kaplan-Meier生存曲线)Fig.1 PFS of 46 patients with UC (Kaplan-Meier survival curve)
3 预后影响因素分析及筛选相关预测指标 单因素分析结果显示,患者的中位PFS与治疗6周时的Hb、NLR、SII有关(P<0.05)。其中,高Hb组的中位PFS较低Hb组延长了8.4个月(15.0个月vs6.6个月),差异有统计学意义(P=0.018);高NLR组的中位PFS较低NLR组明显缩短(6.6个月vs未达到),差异有统计学意义(P=0.028);高SII组的中位PFS较低SII组缩短了8.4个月(6.6个月vs15.0个月),差异有统计学意义(P=0.041)。多因素分析结果显示:治疗6周后的Hb、NLR和SII是预后的显著影响因素(P=0.019、0.043、0.024)。基线时各项指标的不同水平组间患者中位PFS比较,差异均无统计学意义。见表2。
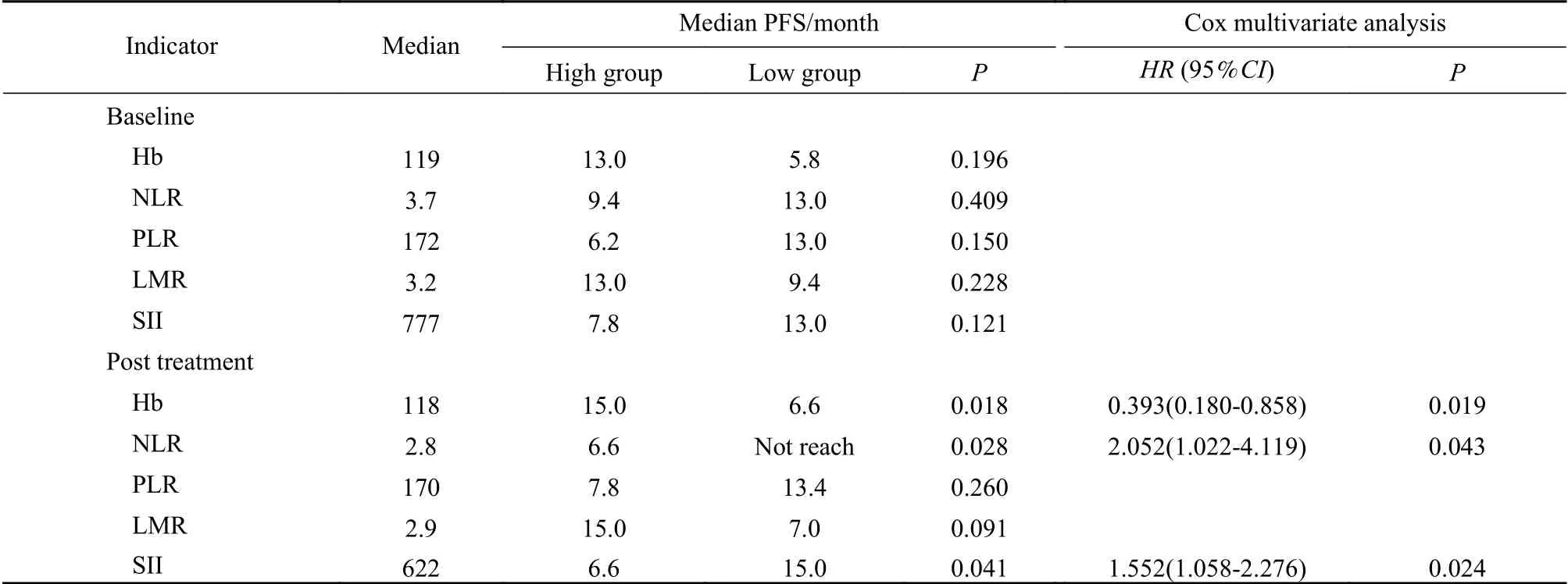
表2 预后关联因素的单因素及多因素分析结果Tab. 2 Results of univariate and multivariate analyses for factors associated with prognosis
4 治疗6周后的Hb、NLR、SII对预后的预测效能分析 进一步探讨治疗6周后的SII、NLR、Hb对预后的预测效能:以预后相对不良患者资料为阳性样本(n=22,PFS≤10个月),以预后相对较好患者资料为阴性样本(n=24,PFS>10个月),建立ROC诊断分析模型。各指标均参考临床实践划分成若干个组段,再以软件拟合之ROC曲线,读取约登指数最大值点,对应计算理论阈值和各项参数,并按实测样本计算敏感度、特异性、准确度。结果显示,三项指标的ROC-AUC(95%CI)分别为0.666(0.391~0.944)、0.698 (0.435~0.958)、0.760(0.570~0.943),均对接受免疫治疗患者的疗效或预后具有一定的预测效能,其中Hb的预测价值最高,见表3。ROC分析曲线见图2。

表3 治疗6周后的Hb、NLR、SII对预后的预测效能Tab. 3 Efficacy of Hb, NLR and SII in predicting prognosis

图2 相关指标预测预后的ROC曲线Fig.2 ROC curves for associated prognostic indicators
讨 论
在多数恶性肿瘤中,机体一般状态和炎症在肿瘤进展和生存中起着关键性的作用,可通过外周血细胞计数的变化体现,且血液检验是几乎所有癌症患者的常规检查,因此血液化验指标是更为简便易得的参数。由于最近几年ICIS逐渐应用于临床各瘤种的治疗中,研究者捕捉到了反映患者免疫状态的外周血液学指标,如NLR、PLR和SII等,均有可能对癌症患者的预后和免疫治疗疗效有一定的预测作用。目前已有一些研究报道了高NLR水平、低PLR水平或低SII水平预示恶性黑色素瘤、NSCLC和小细胞肺癌(small cell lung cancer,SCLC)患者对免疫治疗可能有较好的应答,并且与延长的生存时间相关[18-21]。除此之外,有相关研究报道了其他血液学指标如Hb和乳酸脱氢酶不仅与恶性肿瘤的生存预后相关,也可作为NSCLC、恶性黑色素瘤或其他实体瘤对免疫治疗疗效的预测因子[22-25]。然而,目前尚缺乏利用外周血液参数预测晚期UC患者一线ICIs治疗疗效的相关研究,因此本研究对一线接受PD-1单抗治疗的晚期UC患者的基线及治疗后外周血检测指标Hb、NLR、SII、PLR、LMR与疗效及生存预后的相关性分别进行了分析。
既往的一些研究认为,Hb水平可能通过影响机体的血氧含量进而影响肿瘤的生长及癌症患者抗肿瘤治疗应答和生存预后。2020年一项国内的回顾性研究结果认为,应用ICIs治疗晚期非小细胞肺癌时Hb≥110 g的患者较<110 g的患者明显延长了中位PFS(10.0个月vs4.0个月,P<0.001)和中位总生存期(overall survival,OS)(17.6个月vs10.5个月,P<0.001)[23]。本研究对一线ICIs治疗的晚期UC患者的基线Hb进行了分组对比,差异无统计学意义,但治疗后6周Hb计数降低患者的中位PFS较Hb无明显降低患者缩短了8.4个月,且差异有统计学意义(P=0.018)。同时,本研究结果显示治疗后Hb对UC患者免疫治疗的预后具有不错的预测效能。较基线情况相比,治疗后的Hb水平结合了应用ICIs治疗后患者的机体反应或对药物的耐受性等因素,因此治疗后Hb水平较基线水平可能更好地预测UC患者应用ICIs的疗效或生存预后。
研究者发现中性粒细胞可以诱导机体的炎症反应,通过促进血管在肿瘤中的生成、抑制机体免疫功能等作用,促进肿瘤的生长或转移[26]。已有多项研究证明粒细胞在肿瘤组织的浸润与肝癌、结直肠癌、肾癌等肿瘤的不良预后有明确的相关性[27]。人体免疫功能的实现主要依赖于淋巴细胞,其通过识别并杀伤肿瘤细胞而抑制肿瘤的生长和进展,机体淋巴细胞状态尤其是肿瘤组织浸润的淋巴细胞可以反映机体对肿瘤的免疫状态[28]。越来越多的研究证明NLR水平可用于预测恶性黑色素瘤和NSCLC患者接受免疫治疗的疗效,即低NLR水平与应用免疫治疗患者延长的中位PFS或OS相关[20-21]。另外一项关于NLR预测SCLC患者应用免疫治疗疗效的研究结果显示,免疫治疗6周后NLR<5的患者较≥5的患者明显延长了PFS,可能是预测SCLC患者对免疫治疗早期反应的标志物[19]。本研究结果在对比不同NLR水平患者PFS的基础上,分析了该指标的预后预测能力,结果显示低NLR水平与UC患者PFS的延长相关,且该指标有一定的预后预测价值。
由于SII在NLR的基础上整合了外周血中血小板的水平,因此SII较NLR和PLR更能反映机体炎症与免疫之间的平衡,是更有效的有预测价值的血液学参数。一项Meta分析探讨2441例NSCLC患者的预后影响因素,结果显示SII升高是NSCLC患者PFS和OS的独立影响因素[29]。另外,SII也被证明在肝癌、胆管癌、结直肠癌和食管癌等恶性肿瘤中具有强大的预测预后能力[30-31]。本研究对ICIs治疗后6周的SII与PFS的关系进行分析显示,SII≥622的患者较<622患者中位PFS缩短了8.4个月(6.6个月vs15.0个月),差异有统计学意义(P=0.041),且其预后预测效能分析显示治疗后6周的SII水平对UC患者免疫治疗疗效和预后具有一定预测价值。
综上,尽管目前已有多项外周血指标对免疫治疗疗效和预后预测作用的相关研究正在开展,但国内外尚缺乏晚期UC患者一线应用ICIs的相关数据。本研究回顾性地分析了可能与一般状态或炎症相关的外周血指标对晚期UC患者一线免疫治疗PFS的预测作用,为晚期UC患者一线免疫治疗的应用提供了一定的临床参考,目前国内外尚未见相关研究。本研究作为回顾性研究具有一些不足之处:1)由于样本量的限制,本研究仍需积累更多的研究对象进一步增加研究的可靠性;2)由于随访时间限制,尚未进行OS的观察。
