年龄校正查尔森合并症指数对老年晚期非小细胞肺癌患者抗PD-1免疫治疗的预后评估
2022-04-29邵佳康周宇欣张雅迪刘传玲刘茗露范运龙杨子仲王玉颖贾谷和赵卫红焦顺昌
邵佳康,周宇欣,张 正,张雅迪,赵 晓,刘传玲,刘茗露,范运龙,杨子仲,李 智,王玉颖,田 坤,贾谷和,赵卫红,焦顺昌
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,北京 100853;3 南开大学医学院,天津 300071
肺癌是全球癌症死亡的主要原因之一,而确诊肺癌的患者中约85%为非小细胞肺癌(nonsmall cell lung cancer,NSCLC),且多数 NSCLC患者初诊时即为晚期,往往预后不佳[1-3]。与化疗和靶向治疗相比,针对程序性细胞死亡受体1/程序性细胞死亡配体1(programmed cell death receptor 1/programmed cell death ligand 1,PD-1/PD-L1)通路的免疫治疗对NSCLC患者的生存有明确和持续的改善,免疫治疗深刻地改变了肺癌的治疗模式[4-5]。然而,老年NSCLC患者是一个异质性群体,评估其免疫治疗的风险效益极具挑战性,因为年龄往往不足以反映老年患者器官功能储备、治疗耐受性和预后情况[6-7]。据报道,老年患者合并症对包括NSCLC在内的各种恶性肿瘤的抗癌治疗有很大的影响[8]。因此,有学者提倡将老年病学综合评估纳入肿瘤学分析中,其中应用较广的是年龄校正查尔森合并症指数(age-adjusted Charlson comorbidity index,aCCI),其为量化多种合并症信息、加权年龄评分后的综合指标,可反映患者的整体功能状态[9-10]。事实上,老年病学评估和aCCI的应用主要是在化疗和手术的背景下发展起来的,其在免疫治疗中作用的证据相对匮乏[11]。因此,我们收集解放军总医院第一医学中心≥70岁老年NSCLC患者免疫治疗相关数据,探索在这一特殊群体中aCCI与免疫治疗预后的关系。
资料与方法
1 资料 收集2014年1月1日- 2019年12月31日在解放军总医院第一医学中心接受免疫治疗的≥70岁NSCLC患者的临床资料。截止到末次随访时间(2021年6月30日),本研究共纳入118例患者。其中男性94例(79.7%),平均年龄为(74.7±4.3)岁,美国东部肿瘤协作组行为状态(Eastern Cooperative Oncology Group performance status,ECOG PS)评分≥2分的患者有42例(35.6%)。既往有吸烟史的患者74例(62.7%),有饮酒史的患者38例(32.2%)。其中腺癌63例(53.4%),鳞癌52例(44.1%)。肿瘤分化程度为低分化58例(49.1%),中分化37例(31.4%)。美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期为Ⅲ期患者38例(32.2%),Ⅳ期80例(67.8%)。纳入标准:1)病理明确诊断为NSCLC,且依据AJCC第8版NSCLC的TNM临床分期标准[12],分期为ⅢA~ⅣB期;2)第1次行免疫治疗时的实际年龄≥70岁;3)行免疫治疗2周期以上,且有用于评估疗效的影像学和检验学数据。排除标准:1)仅通过PET-CT和CT影像学诊断,无病理诊断;2)仅使用1次免疫治疗,无法评估疗效;3)一般信息和诊疗信息大量缺失,无法具体分析;4)后期随访失访。
2 aCCI量表评分及分组 aCCI量表依据19种不同疾病和不同年龄段的加权得分计算最终评分,若患者同时罹患所有疾病,且糖尿病、肝病和实体瘤3种疾病以严重程度取最高赋值分,同时年龄位于最高组(≥80岁)时,计算总分为37分,分值越高合并症越多,基础状态越差。每种疾病及不同年龄段的具体得分见表1。在患者进行免疫治疗前,根据其合并症情况,使用aCCI评分量表对患者进行评分[13]。以本研究全部患者样本aCCI评分中位数为截断值,将研究人群分为低合并症评分组和高合并症评分组,比较两组生存差异。

表1 年龄校正查尔森合并症指数评分细则Tab. 1 Scoring of the age-adjusted Charlson Comorbidity Index
3 疗效评价与生存分析 根据实体瘤免疫治疗疗效评价标准(immune-modified response evaluation criteria in solid tumors,imRECIST)评估PD-1单抗的治疗疗效[14]。1)疗效评价:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。其中客观缓解率(objective responserate,ORR)为CR+PR,疾病控制率(disease control rate,DCR)为CR+PR+SD。2)主要研究终点:无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)为主要研究终点。其中PFS是指患者从初次免疫治疗至出现肿瘤客观进展或全因死亡的时间,OS是指从患者初次免疫治疗到任何因素导致患者死亡或末次随访的时间。
4 统计学分析 采用SPSS22.0和GraphPad Prism 8.0进行统计学和生存分析。计数资料使用例数、构成比或百分比表示。组间比较使用χ2检验或Fisher精确概率检验。计量资料以±s或Md(IQR)表示。使用Kaplan-Meier生存曲线分析患者PFS和OS,log-rank检验评估组间差异,以单因素和多因素Cox回归分析不同临床特征及合并症与预后(PFS、OS)的关联。P<0.05为差异有统计学意义。
结 果
1 患者一般资料 根据aCCI量表中纳入的19种相关疾病统计老年NSCLC患者的合并症情况,除实体瘤外,本研究纳入的老年NSCLC患者不合并偏瘫、痴呆/阿尔茨海默病、白血病、淋巴瘤、获得性免疫缺陷综合征,故共统计14种相关合并症。其中排名前3的合并症为糖尿病、心肌梗死和肝病,分别为20例(16.9%)、16例(13.6%)和9例(7.6%),后依次为充血性心力衰竭8例(6.8%)、慢性阻塞性肺病或哮喘8例(6.8%)、脑血管疾病或短暂性脑缺血发作7例(5.9%)、周围血管疾病3例(2.5%)、肾病3例(2.5%)、结缔组织疾病2例(1.7%)、消化性溃疡2例(1.7%)。aCCI最低评分为5分,最高评分为13分。中位aCCI评分9分为截断值,aCCI评分<9分为低合并症评分组(37例),aCCI评分≥9分为高合并症评分组(81例)。除ECOG PS评分及AJCC分期(P<0.05)外,两组患者的一般特征差异均无统计学意义(P>0.05)。见表2。
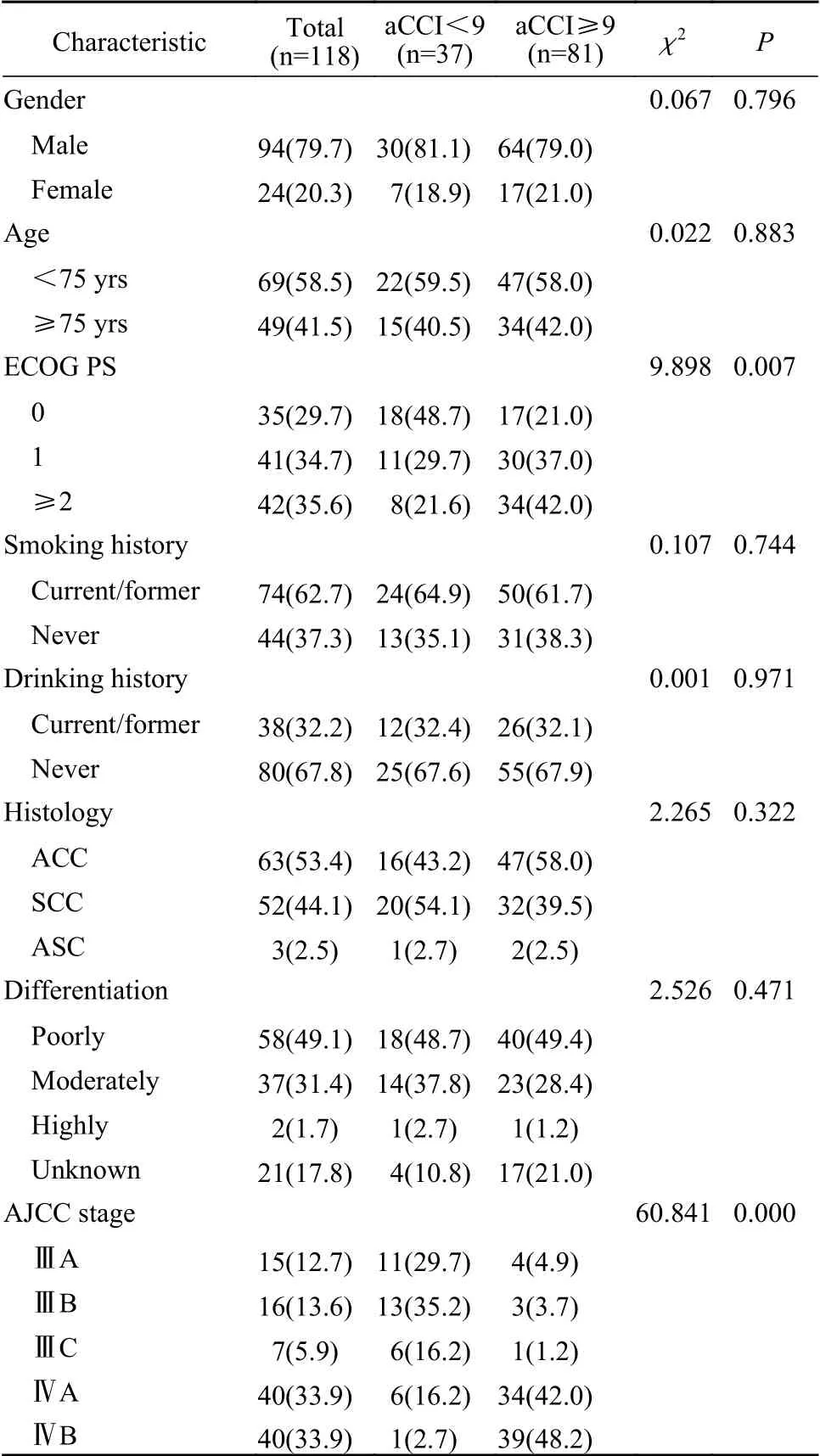
表2 患者人口学及临床特征(n, %)Tab. 2 Demographics and clinical characteristics of the NSCLC patients (n, %)
2 免疫治疗情况及疗效评价 本研究中免疫治疗作为NSCLC一线治疗的患者占比最多,为60例(50.9%),作为二线治疗的患者34例(28.8%),三线及以上的患者24例(20.3%)。治疗药物除帕博利珠单抗(pembrolizumab)和纳武单抗(nivolumab)外,还包括信迪利单抗(sintilimab)、卡瑞利珠单抗(camrelizumab)、特瑞普利单抗(toripalimab)和派安普利单抗(penpulimab)。其中免疫单药治疗48例(40.7%),免疫联合化疗46例(39.0%),免疫联合抗血管治疗13例(11.0%),免疫同时联合化疗和抗血管11例(9.3%)。疗效评估达到CR 2例(1.7%),PR 25例(21.2%),SD 63例(53.4%),PD 28例(23.7%),患者整体ORR为22.9%,DCR为76.3%。见表3。
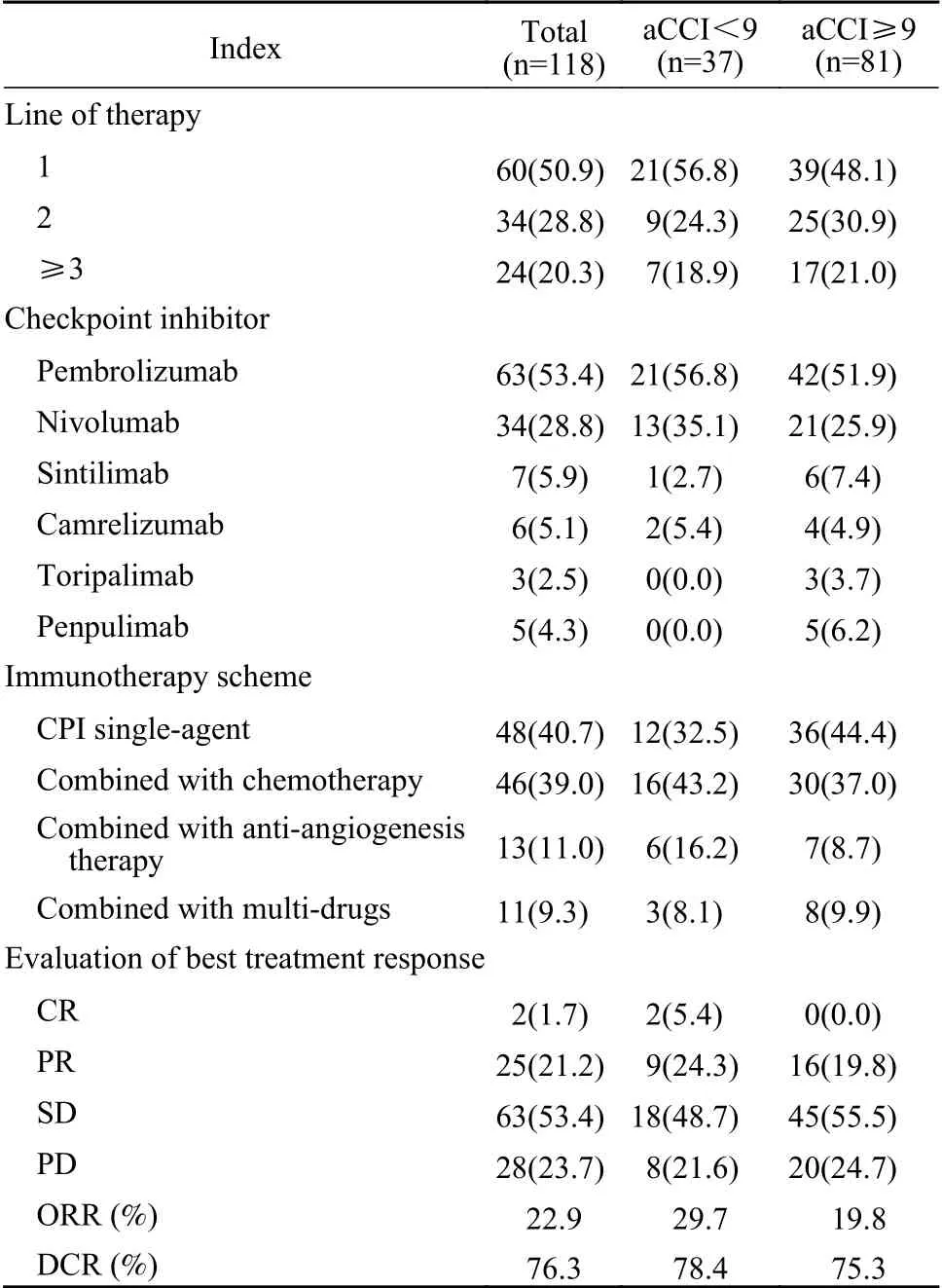
表3 免疫治疗情况及疗效评价(n, %)Tab. 3 Immunotherapy and efficacy evaluation (n, %)
3 高、低aCCI评分组的预后比较 本研究样本的aCCI评分为5~13分,低aCCI评分组中发生肿瘤进展和死亡的人数均较高aCCI评分组少。低aCCI评分组的中位PFS为10.6个月(95%CI:6.0~15.2),高aCCI评分组的中位PFS为6.1个月(95%CI:4.8~7.4);低aCCI评分组的中位OS为33.9个月(95%CI:13.7~54.1),高aCCI评分组的中位OS为11.7个月(95%CI:9.5~13.9)。Kaplan-Meier生存曲线提示低aCCI评分组的生存预后明显优于高aCCI评分组(PFS,P<0.01;OS,P<0.001)。见图1、图2。
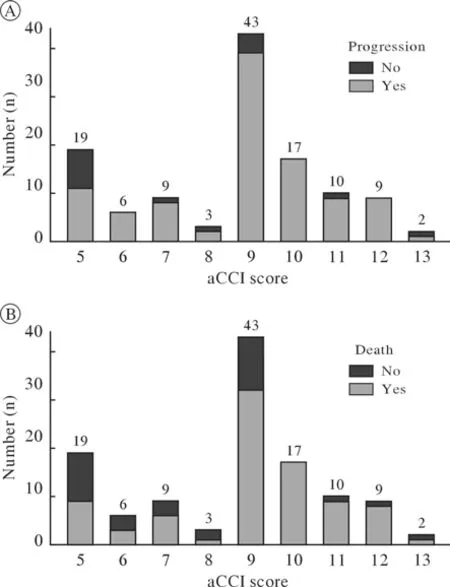
图1 不同aCCI评分组中发生进展(A)或死亡(B)的人数Fig.1 Cases of progression (A) or death (B) occurred in different aCCI score groups
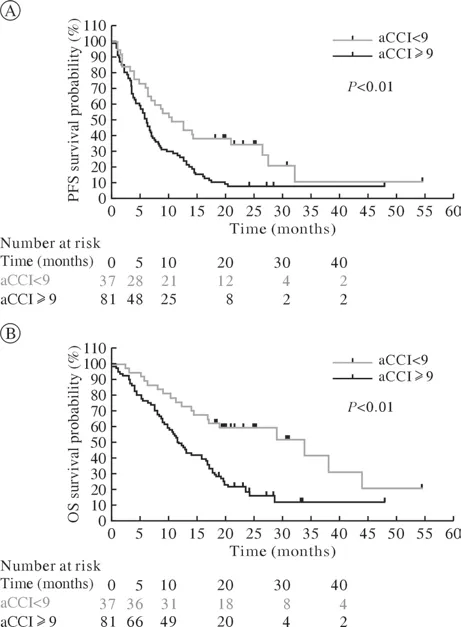
图2 不同aCCI评分组患者无进展生存期和总生存期曲线Fig.2 Progression-free survival and overall survival curves of patients in different aCCI-score groups
4 患者生存影响的因素分析 1)关于PFS:单因素Cox回归分析提示ECOG PS=1分组(HR=6.885;95%CI:3.777~12.552;P<0.001)和ECOG PS≥2分 组(HR=23.964;95%CI:11.941~48.092;P<0.001)较ECOG PS=0分组的PFS更短,aCCI评分≥9分组(HR=1.937;95%CI:1.240 ~3.026;P<0.01)较aCCI评分<9分组的PFS更短。多因素Cox回归分析提示ECOG PS=1分组(HR=6.279;95%CI:3.396~11.610;P<0.001)和ECOG PS≥2分组(HR=22.062;95%CI:10.869 ~44.781;P<0.001)较ECOG PS=0分组的PFS更短。2)关于OS:单因素Cox回归分析提示ECOG PS=1分组(HR=6.946;95%CI:3.300~14.619;P<0.001)和ECOG PS≥2分 组(HR=104.103;95%CI:39.396~275.091;P<0.001)较ECOG PS=0分组的OS更短,aCCI评分≥9分组(HR=2.617;95%CI:1.552~4.413;P<0.001)较aCCI评分<9分组的OS更短。多因素Cox回归分析提示ECOG PS=1分组(HR=6.637;95%CI:3.114 ~14.146;P<0.001)和ECOG PS≥2分 组(HR=99.356;95%CI:36.939~267.238;P<0.001)较ECOG PS=0分组的OS更短,aCCI评分≥9分组(HR=1.986;95%CI:1.147~3.441;P<0.05)较aCCI评分<9分组的OS更短。见表4。
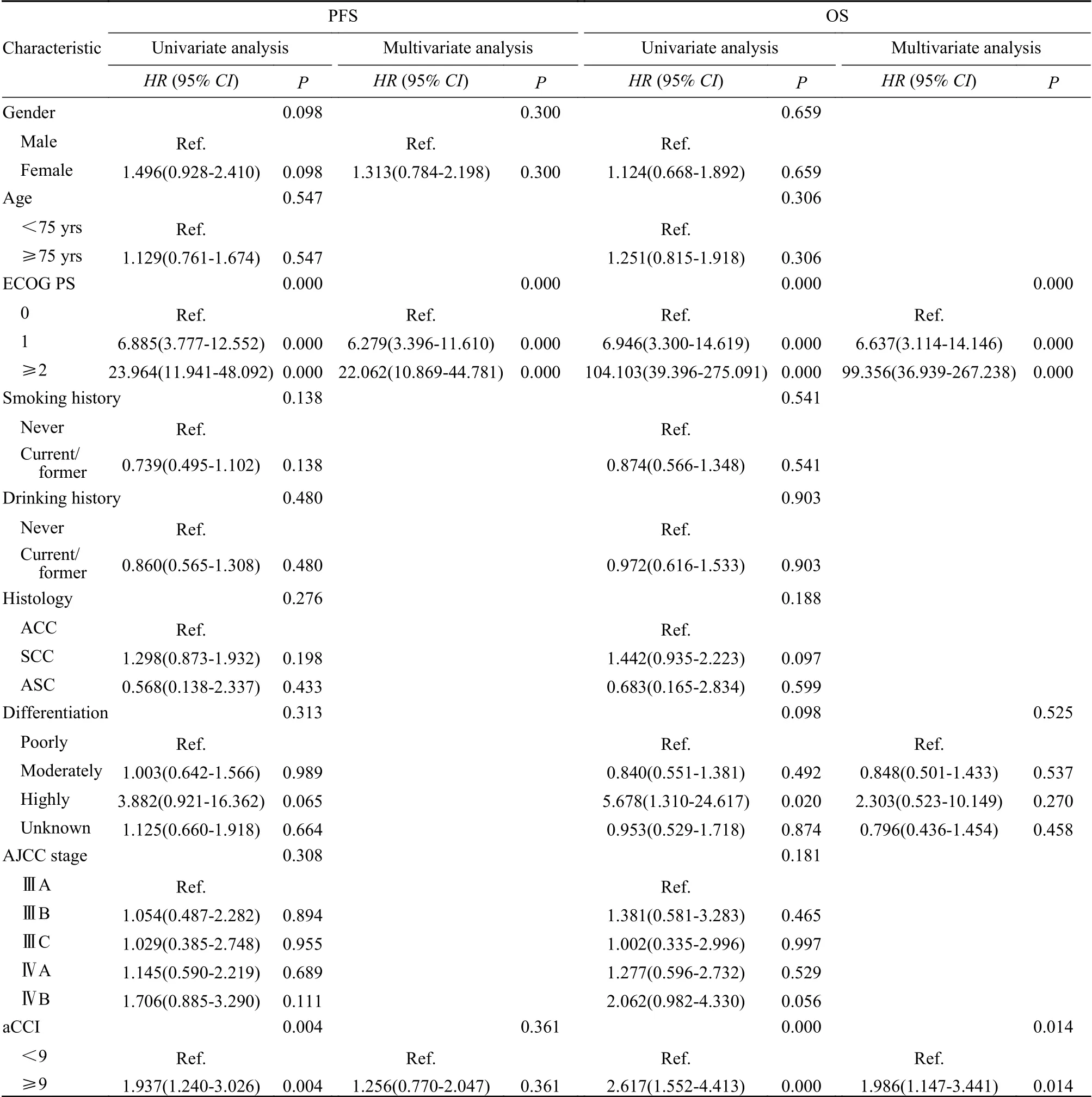
表4 单因素、多因素Cox回归分析基线临床特征与预后的关系Tab. 4 Univariate and multivariate Cox regression analysis of the relationship between baseline clinical characteristics and prognosis
讨 论
NSCLC的发病率随年龄的增长呈现上升趋势,有研究表明已确诊的患者中约半数超过70岁[1-2]。说明老年患者是NSCLC的主要患病人群。免疫治疗正在使包括NSCLC在内的癌症治疗发生革命性的变化,但与年龄相关的免疫系统重塑过程在理论上可能会影响其疗效[15]。目前,NSCLC免疫治疗疗效令人备受鼓舞,但有关老年NSCLC患者免疫治疗的数据相当有限[4-5]。在一份美国食品药品监督管理局(Food and Drug Administration,FDA)发布的多癌种临床试验10年分析报告中指出,仅24%的临床试验患者年龄≥70岁[6,16]。也有研究表明在有关NSCLC的多数大型临床试验中,其招募患者的中位年龄较NSCLC实际中位发病年龄小10岁[17]。提示老年NSCLC患者在临床试验中的代表性不足、研究不充分。即便如此,纳入临床试验的老年患者较真实世界中的老年患者更为健康,因为他们往往有更低的ECOG PS评分,意味着这部分患者拥有更好的器官功能储备、合并更少的老年常见病、罹患更少的老年相关综合征等[6-7]。除此之外,这些临床试验即便纳入了少部分老年NSCLC患者,但未针对这一特殊群体进行专门的老年病学评估和相关合并症分析,故免疫检查点抑制剂在真实世界中治疗具有合并症的老年NSCLC患者,数据较为匮乏、分析不够充分。因此,我们基于复杂的真实世界背景,分析了合并基础疾病、年龄≥70岁的老年NSCLC患者经PD-1单抗治疗的预后情况,探索合并症与免疫治疗预后的关系,为该类患者的临床治疗积累经验。
本研究显示性别、年龄、吸烟史、饮酒史、组织学类型、肿瘤分化程度、AJCC分期等因素均与PD-1单抗治疗老年NSCLC患者的预后无关(P>0.05),这与Ahmed等[7]的研究结论相似。而ECOG PS=0分、1分的患者预后均优于ECOG PS≥2分的患者,这与临床实践相符,ECOG PS评分越低,代表患者体力状况越好、合并基础病更少、对治疗的耐受性和反应性更好,故PFS和OS往往更长[7]。
此外,合并症被认为是NSCLC患者生存的一个负面预后因素[18]。而在真实世界的临床实践中,老年NSCLC患者合并更多的基础疾病[13,19-20]。目前,吸烟可以促进肺癌发生发展的观点已被学界普遍认可[21]。据文献报道,吸烟还可通过诱导慢性炎症、促进脂肪累积、兴奋交感神经、损伤血管内皮等途径,诱发糖尿病、心肌梗死和周围血管病等急慢性疾病[21-24]。日本的一项研究表明合并糖尿病的NSCLC患者预后整体较差,提示糖尿病对NSCLC患者的长期生存有负面影响;此外,该研究还发现合并糖尿病的NSCLC患者同时合并心血管疾病、血脂异常和肾功能损害的概率也较高,这些合并症往往协同作用,影响患者的器官功能储备和整体预后状态[25]。
需要说明的是,这些合并症在老年NSCLC患者中常共同存在、互相影响,拥有相似的临床致病危险因素和病理生理学信号转导途径[25-28]。但仅从单一疾病或某几种疾病的角度分析老年NSCLC患者的预后,会忽视患者整体的器官功能水平对免疫治疗的影响,在不同研究背景下分析异质性较大的老年人群极易导致结论不一致。此外,即便是轻度或控制良好的合并症仍可能使治疗复杂化并降低治疗疗效。因此,很难同时评估合并症对免疫治疗预后的影响,并将这些信息整合到临床实践以及发病率和死亡率的估计中。为此我们引入了可以量化且简便计算的aCCI评分。aCCI是一个结合年龄因素且量化多种合并症的综合指标,可反映患者的整体功能状态,已被证明可评估肺癌患者的预后[9-10]。在我们的研究中,高aCCI评分组(≥9分)较低aCCI评分组(<9分)具有更短的PFS和OS。说明aCCI可以预测应用抗PD-1免疫治疗的老年晚期NSCLC患者的预后,这与Yang等[13]的研究结论相似。aCCI仅通过病史采集和量化合并症分析即可预测免疫治疗的预后,考虑其针对老年NSCLC患者独有的简便性、适用性和经济性,我们推荐在对老年NSCLC患者使用免疫治疗前进行aCCI评分筛查,对低aCCI评分的患者考虑使用可能获益的免疫治疗。
本研究有以下局限性:1)这是一个单中心的回顾性研究,有回顾性研究本身的局限;2)样本量相对较小,需要在更大样本量的人群中进行验证;3)本研究的发现是推测性的,需要更大规模的前瞻性研究进一步证实。然而,尽管这些因素在一定程度上削弱了本研究结论的准确性和可靠性,但其为针对老龄NSCLC患者开展的一项临床评估,对未来开展的相关前瞻性研究有一定的启示意义。
