淋巴细胞/单核细胞比率与PD-1抑制剂治疗食管癌患者预后的关系探讨
2022-04-29高一鸣陈思远韩馥馨
高一鸣,陈思远,韩馥馨,胡 毅
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,北京 100853
据全球癌症报告统计,2020年食管癌约新发604 000例,因食管癌致死544 000例[1]。全球新发食管癌病例中,超过50%发生在中国,且呈逐渐升高的趋势。据统计,食管癌在中国所有癌症类型中,发病率排名第3,致死率排名第4[2]。近年来,以程序性死亡受体1/程序性死亡配体1(programmed cell death receptor 1/programmed cell death ligand 1,PD-1/PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗已在多种癌症中取得重大进展[3-6],其中ICIs应用于各类食管癌的临床试验取得了可喜成绩[7-8]。虽然ICIs应用于食管癌效果显著,但仍有部分患者不能从中获益。因此,探索可靠的疗效预测指标成为食管癌ICIs治疗中的重要挑战。既往研究报道肿瘤相关性炎症与不同类型癌症患者肿瘤进展和生存密切相关,而外周血炎性指标可反映患者全身炎症状态[9]。这些指标主要包括中性粒-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)和淋巴细胞-单核细胞比值(lymphocyte-tomonocyte ratio,LMR)等。既往研究表明,外周血NLR、PLR与ICIs治疗不同类型癌症的肿瘤进展和总生存期相关,可被列为预测ICIs疗效的生物标志物[10-13]。最近研究发现较低的LMR与肿瘤患者的不良预后密切相关,但对应用ICIs的食管癌患者研究较少[14]。因此,本研究通过对202例接受ICIs治疗的食管癌患者进行双向观察性研究,以评估外周血LMR作为PD-1抑制剂治疗预后生物标志物的价值,为临床筛选高获益人群提供依据。
对象与方法
1 研究对象 双向性收集解放军总医院第一医学中心2016年7月- 2021年6月接受PD-1抑制剂治疗的食管癌患者临床数据。纳入标准:1)组织病理学明确诊断为食管癌,包括UICC/AJCC TNM分期Ⅰ~Ⅳ期,WHO组织学分型为鳞状细胞癌和腺癌;2)充分了解并同意治疗方案后接受PD-1抑制剂治疗,联合或未联合手术、放疗、化疗等其他治疗;3)接受PD-1抑制剂治疗前后均有可供测量和评估疗效的影像学资料。排除标准:1)体力状况评分ECOG 评分>3,无法耐受免疫治疗;2)失访;3)无疗效评价。
2 PD-1抑制剂用药方法 1)帕博利珠单抗:200 mg/次,静脉注射,1次/21 d。2)卡瑞利珠单抗:200 mg/次,静脉注射,1次/21 d。3)纳武利尤单抗:360 mg/次,静脉注射,1次/21 d。
3 分组及分析指标 1)收集患者基线数据,包括姓名、性别、用药时年龄、吸烟状态、ECOG评分、接受ICIs治疗时的TNM分期、远处转移部位等。2)记录患者使用PD-1抑制剂第1周期前和第2周期后1周内的外周血液检测结果,包括绝对淋巴细胞计数(absolute lymphocyte count,ALC)和绝对单核细胞计数(absolute monocyte count,AMC),计算基线及2周期后LMR。使用ROC曲线计算LMR的最佳Cut-off值,并将研究对象分为高LMR组和低LMR组。3)收集并随访达到结局指标时间。4)采用RESISIT1.1实体瘤疗效评价标准评价疗效;无进展生存期(progression-free survival,PFS)为随机化开始至任何原因出现疾病进展或死亡的时间;总生存期(overall survival,OS)为随机化开始至任何原因出现死亡的时间。5)随访截至2021年9月30日。
4 统计学方法 应用R软件(3.6.3版本)进行统计分析。分类变量以例数(百分比)表示,采用χ2检验和Fisher精确检验;连续变量以Md(IQR)表示,采用Wilcoxon秩和检验。采用Kaplan-Meier法分别绘制以PFS和OS为终点的生存曲线,检验方法为log-rank检验。将LMR水平和其他相关协变量分别纳入以PFS和OS为终点的单因素Cox回归模型,并将差异显著的变量纳入多因素Cox回归模型分析关联因素。P<0.05为差异有统计学意义。
结 果
1 患者一般临床特征 研究共收集231例应用PD-1抑制剂的食管癌患者,排除外周血检测结果缺失及失访患者,最终纳入202例进行本研究。患者中位年龄为61.5(55,66)岁,男性182例(90.1%),女性20例(9.9%);食管鳞癌190例(94.1%);ECOG评分为0~1分189例(93.6%);ICIs用药类型为特瑞普利单抗86例(42.6%),信迪利单抗23例(11.4%),帕博利珠单抗73例(36.1%),其他20例(10.0%)。见表1。
2 预后情况 入组患者整体中位PFS为29.2个月,中位OS为35.3个月。见图1。
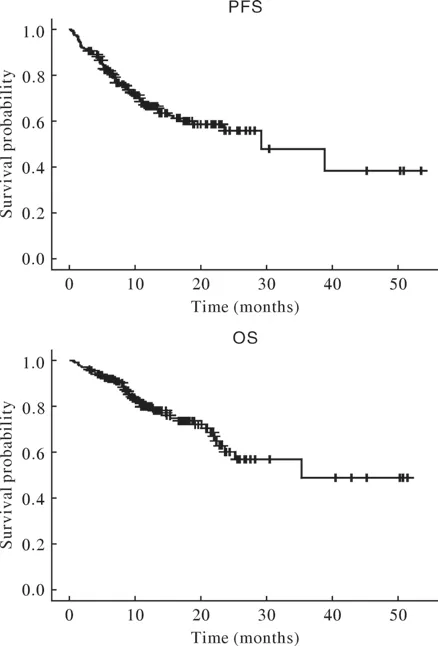
图1 入组患者生存曲线(PFS与OS)Fig.1 Survival curves (PFS and OS) for all the patients
3 患者分组及基线特征比较结果 先按生存情况(死亡为阳性样本,生存为阴性样本),进行LMR对预后的评估价值分析(ROC分析),再利用ROC曲线确定基线LMR最佳Cut-off值为2.708,曲线下面积为0.641(0.559~0.723)(图2)。据其分组:高LMR组(≥2.708) 133例,低LMR组(<2.708) 69例。高LMR组中位年龄为62(55,66)岁,男性118例(58.4%),女性15例(7.4%);低LMR组中位年龄为61(54, 66)岁,男性64例(31.7%),女性5例(2.5%)。高LMR组和低LMR组应用不同类型PD-1抑制剂例数分别为特瑞普利单抗67例(33.2%)和19例(9.4%)、信迪利单抗15例(7.4%)和8例(4%)、帕博利珠单抗42例(20.8%)和31例(15.3%)、其他9例(4.5%)和11例(5.5%)。两组基线特征比较见表1。
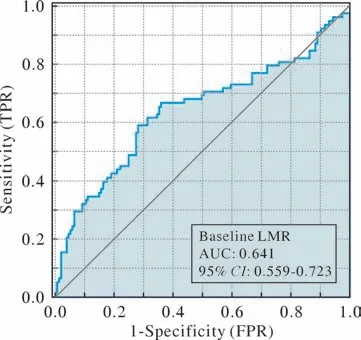
图2 LMR预测死亡的ROC曲线Fig.2 ROC curve for LMR predicting death

表1 202例食管癌患者基线特征(n, %)Tab. 1 Baseline characteristics of the 202 esophageal cancer patients (n, %)
4 基线LMR水平与预后的关系 低LMR组的中位PFS(11.6个月)和中位OS(23.6个月)显著短于基线高LMR水平组(P<0.001)。见图3。
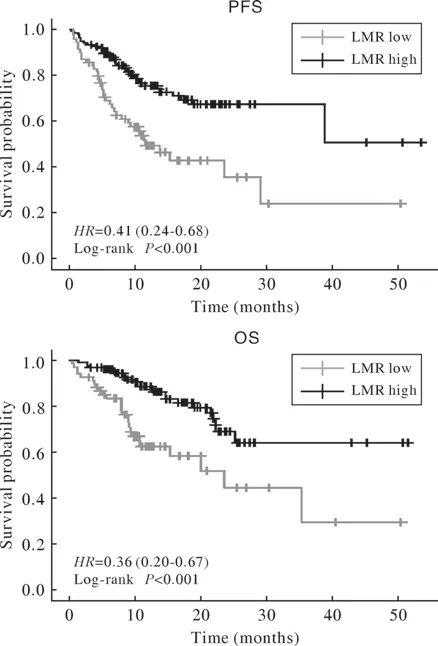
图3 基线LMR的PFS和OS曲线Fig.3 PFS and OS curves by baseline LMR
5 两周期LMR水平与预后的关系 202例患者中有20例2周期后外周血检验结果缺失,剔除后共纳入182例患者进行预后分析,其中2周期高LMR组99例,低LMR组83例。结果显示,2周期后与低LMR组相比,高LMR组中位PFS延长了23.1个月[38.9个月vs15.8个月,HR(95%CI):0.41(0.24~0.68),P<0.001],中位OS也显著延长[HR(95%CI):0.39(0.21~0.74),P=0.003]。值得注意的是,2周期高LMR组PFS曲线在第40个月左右时下降,低于2周期低LMR组;OS曲线在第35个月左右时下降,与2周期低LMR组重合。见图4。
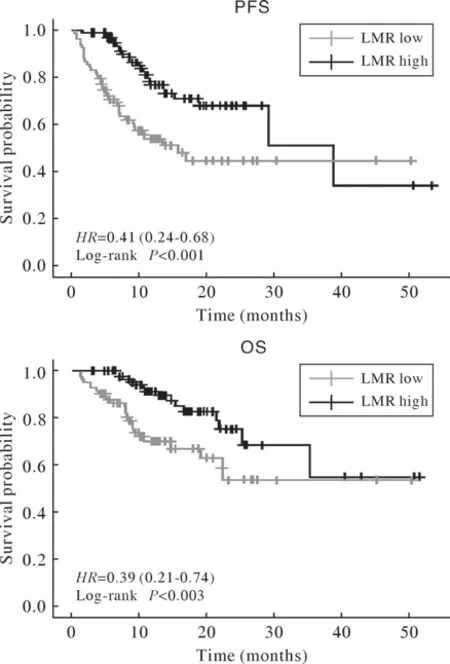
图4 2周期后LMR的PFS和OS曲线Fig.4 PFS and OS curves after 2 cycles treatment by LMR
6 影响PD-1抑制剂治疗预后的因素分析 以PFS为终点,进行单因素和多因素回归分析,将单因素分析中P<0.1的协变量纳入多因素分析。结果显示,肿瘤分化程度、ECOG评分、基线LMR水平是影响患者PFS的独立预后因素。与基线高LMR水平相比,基线低LMR水平显著增加了应用PD-1抑制剂食管癌患者疾病进展的风险[HR(95%CI):2.487(1.559~3.969),P=0.003](表2)。以OS为终点,进行单因素和多因素回归分析。结果显示,ECOG评分和基线LMR水平是影响患者OS的独立预后因素。与基线高LMR水平相比,基线低LMR水平显著增加了应用PD-1抑制剂食管癌患者死亡的危险[HR(95%CI):2.804(1.602~4.906),P<0.001](表3)。
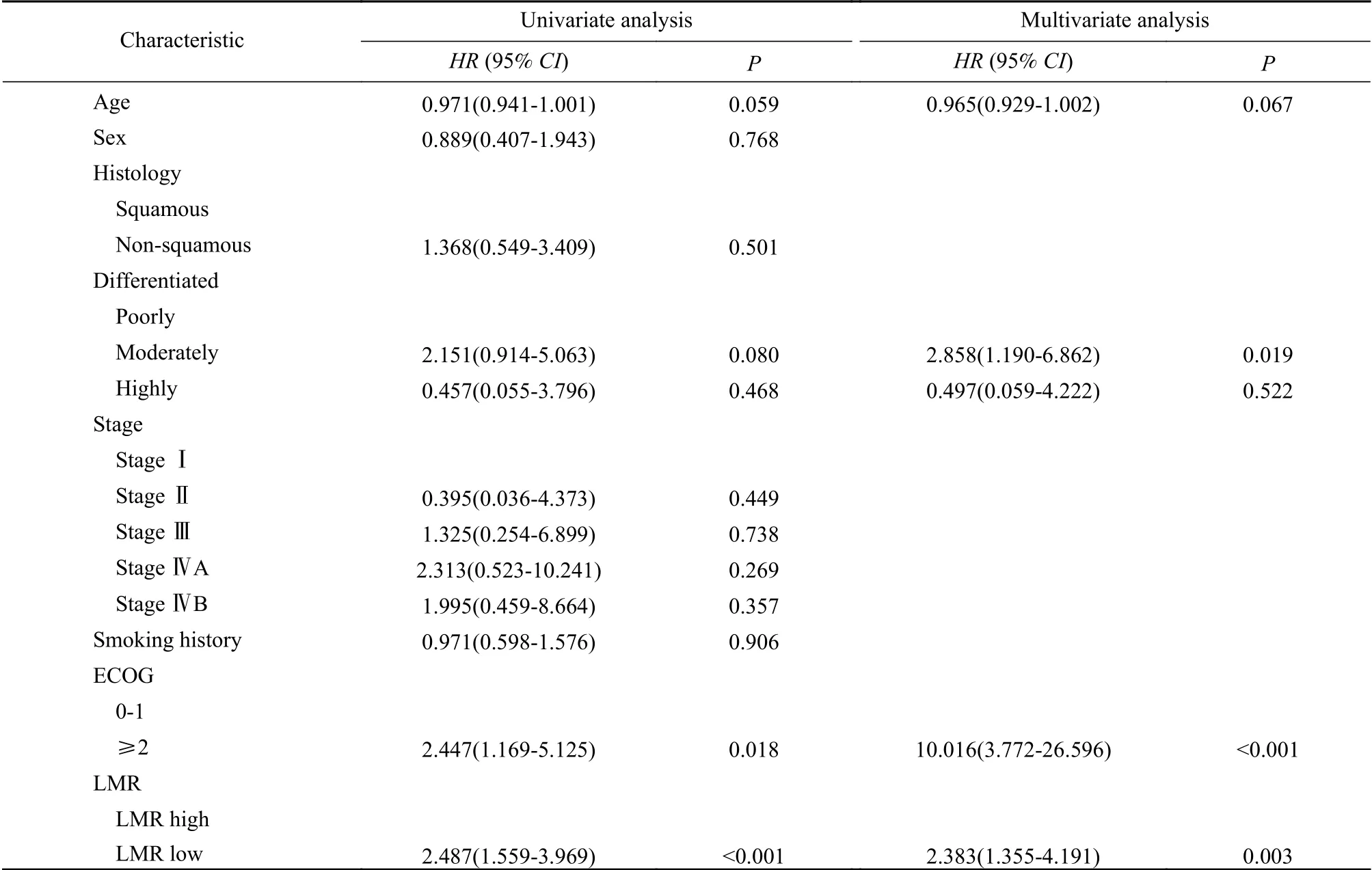
表2 PFS 单因素、多因素Cox回归分析Tab. 2 Univariate and multivariate Cox regression analyses for PFS
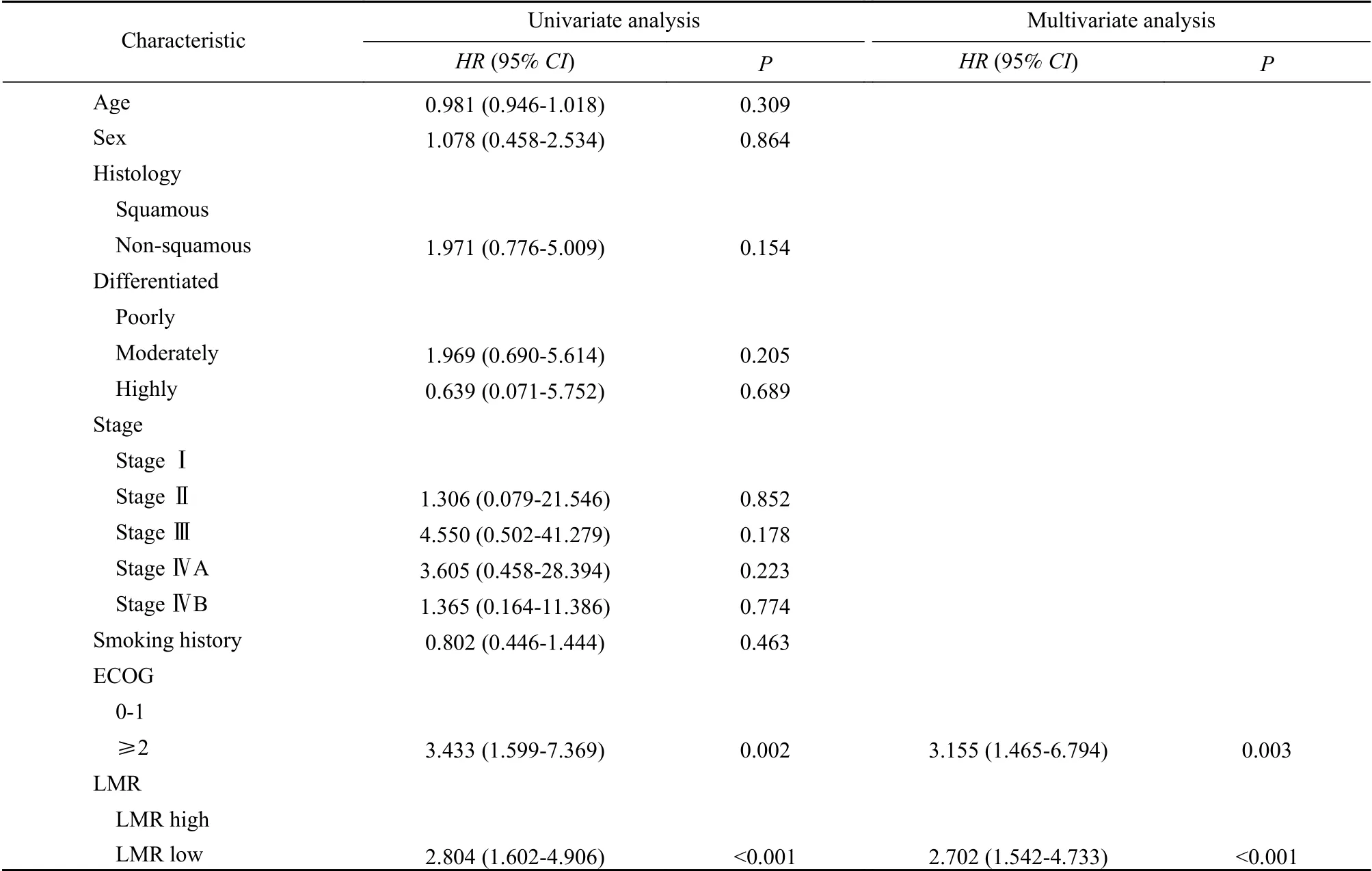
表3 OS 单因素、多因素Cox回归分析Tab. 3 Univariate and multivariate Cox regression analyses for OS
讨 论
本文探讨应用PD-1抑制剂的食管癌患者基线LMR水平与预后的关系。生存曲线结果显示,在入组患者中,外周血基线低LMR水平组的中位PFS(P<0.001)和中位OS(P<0.001)显著短于基线高LMR水平组。单因素和多因素比例风险模型分析结果显示,与基线高LMR水平相比,基线低LMR水平显著增加了患者疾病进展(HR:2.487,P=0.003)和死亡(HR:2.804,P<0.001)的风险。因此可得出结论,基线低LMR水平是预测应用PD-1抑制剂的食管癌患者预后的独立危险因素。这与既往针对其他种类癌症的研究结果一致。既往研究报道,基线LMR水平及变化与应用ICIs治疗的胃癌患者生存密切相关,高LMR组较低LMR组PFS[HR0.58(0.38~0.91)]和OS[HR0.38(0.24~0.62)]均更长[15];在接受ICIs治疗的膀胱癌患者中,LMR水平可以作为预测疗效的独立生物标志物[16];外周血LMR水平可以反映机体炎症状态,而免疫细胞可通过驱动炎症细胞,改变其功能状态,从而促进肿瘤内血管生成、癌细胞增殖和侵袭[17-19]。
在外周血检测数据中,也有其他可以反映机体炎症状态的血液学指标。包括中性粒细胞-淋巴细胞比率、肺免疫预后指数、胃免疫预后指数、血小板-淋巴细胞比率等,这些指标基线水平增高,可以反映机体高炎症状态,且与肿瘤的不良预后相关[20-21]。
本研究局限性如下:1)研究开始于2020年7月,计划收集研究开始前4年内和研究开始后未来1年内应用PD-1抑制剂食管癌患者的数据。由于随访时间的限制,一部分对象并未达到研究终点,未获得中位OS数据;2)由于应用PD-1抑制剂2周期后的外周血检测数据的缺失而损失了一部分数据;3)研究对象来自于单一机构,存在一定程度的偏倚,将来可以继续纳入其他中心的数据,进一步分析基线LMR水平与应用PD-1抑制剂食管癌患者预后的关系,提高研究可信度。
综上,本研究明确了对于应用PD-1抑制剂治疗的食管癌患者,基线LMR水平与生存获益相关,或可作为患者预后的独立预测因子。
