pH 敏感型聚合物胶束对I 型志贺毒素A 亚基的递送及细胞毒性
2022-04-29孙敏佳刘晔宏薛依桐徐首红张俊琪
孙敏佳, 刘晔宏, 薛依桐, 徐 俊, 王 彤, 徐首红, 张俊琪
( 1. 华东理工大学化学与分子工程学院,结构可控先进功能材料及其制备教育部重点实验室,上海200237;2. 复旦大学基础医学院教育部/卫建委医学分子病毒学重点实验室&病原生物系,上海 200032)
白喉毒素、铜绿假单胞菌外毒素A、产气荚膜梭菌肠毒素、志贺毒素等细菌外毒素由于其活性部位能够特异性地抑制细胞某种功能而导致细胞程序性死亡,因而被作为肿瘤治疗的新方法获得广泛研究[1-4]。志贺毒素是由痢疾志贺菌和肠出血性大肠埃希菌产生的蛋白毒素,具有细胞毒性、肠毒素毒性和神经毒性3 种生物学活性[5-7],分为I 型志贺毒素(Stx1)和II 型志贺毒素(Stx2),两者基因同源性约为56%[7]。其中,Stx1 由1 个A 亚基和5 个B 亚基组成,两部分通过非共价作用结合。5 个B 亚基形成的孔环结构通过与细胞表面特异性糖脂受体三己糖神经酰体Gb3 结合,将A 亚基运输至靶细胞的胞浆中[5,8-9]。Stx1 的A 亚基(Stx1A)由315 个氨基酸组成,分子量为32 kDa,具有高度特异的RNA N-糖苷酶活性,通过催化28S rRNA 的第4 324 位的腺苷脱嘌呤,使延伸因子1 依赖性的氨酰-tRNA 与核糖体的结合受到抑制,从而阻断了肽链延伸和蛋白质合成,引起细胞损伤[6]。已有实验证明,Stx1A 静脉或腹腔注射小鼠的半数致死量(LD50)仅为400 ng[10-11],对上皮的人肾腺癌细胞LD50 仅为1 pg/mL[12]。Stx1A强大的细胞毒性功能,使其成为肿瘤治疗研究和发展的新热点。
然而,由于Stx1A 自身的细胞毒性作用没有靶向性,同时作为分子量大于5 kDa 的多肽物质具有不稳定易降解、不易被细胞摄取等缺点,其开发与应用受到严重制约[13-14]。因此,研发有效的载体系统靶向递送Stx1A,使其免于体内外不稳定性、免疫原性和半衰期短的影响,同时提高Stx1A 胞内的有效转运,对于拓宽这类细菌蛋白毒素在肿瘤治疗中的应用有着重要意义。
肿瘤微环境静脉回流缓慢且淋巴清除率差,这使得分子量大于40 kDa 的大分子物质更容易渗透进入肿瘤组织并长期滞留,被称为增强渗透滞留(Enhanced Permeability and Retention,EPR)效应[15]。聚合物胶束的纳米级粒径可以避免巨噬细胞识别和吞噬,使其能通过肿瘤组织的EPR 效应增强被动靶向性,减少药物不良反应,被认为是最有前景的抗肿瘤药物递送系统之一[16]。降低聚合物胶束在体内循环系统的药物释放、提高胶束在肿瘤部位的蓄积和实现胶束在肿瘤细胞内的快速释药是聚合物胶束递送系统亟待解决的关键问题。大量研究表明,pH 响应型聚合物胶束因具有智能的酸敏释药性而很好地解决了上述问题。pH 敏感型聚合物胶束在体内的运输不断经历pH 值由高到低的梯度变化[17]:当外部环境如人体循环系统和正常组织pH 值(约为7.4)高于聚合物胶束嵌段聚合物的平衡解离常数时,聚合物胶束以紧密完整的形态包载药物,基本不释放,并通过EPR 效应将药物高浓度蓄积于肿瘤组织;当外部环境如肿瘤微环境的pH 值(6.5~7.2)接近聚合物胶束嵌段聚合物的平衡解离常数时,胶束略有膨胀松动,但是药物仍包载在胶束的疏水核中。当外部环境如细胞内吞体pH 值(5.0~6.0)低于聚合物胶束的嵌段聚合物的平衡解离常数时,胶束开始解聚并快速释放药物。因此pH 敏感型聚合物胶束有望完成肿瘤细胞内的药物递送、释放,实现癌症的靶向治疗。
本课题组在前期研究工作中设计合成、制备了pH 敏感型纳米胶束PEG8-PDPA100-PEG8(其中PEG为聚乙二醇,PDPA 为聚异丙基甲基烯酸酯)可以有效地将小分子药物DOX、核酸药物HER2 和生物大分子转铁蛋白(分子量为7.7 kDa)完整递送和释放至肿瘤细胞并发挥相应的生物学功能[18-19]。实验已证明,聚合物胶束具有高效的生物大分子包载率、良好的生物相容性和精准的pH 响应性。在此基础上,本文通过制备和验证pH 敏感型聚合物胶束对Stx1A 的转染率及诱导细胞发生程序性死亡的效率,考察Stx1A 在体外对肿瘤细胞Hela 的毒性作用,为细菌蛋白毒素在肿瘤治疗中的应用研究及pH 响应型纳米载体的深入研究提供有力的依据。
1 材料与方法
1.1 原料和试剂
四氢呋喃(THF,分析纯,上海泰坦试剂有限公司,使用前重蒸除水);细胞毒性试剂盒(CCK-8, 日本DOJINDO 公司);无血清培养基(DMEM, 美国Gibco 公司);热灭活胎牛血清(FBS,美国Gibco 公司);BeaverBeadsTMHis-tag 蛋白纯化试剂盒(苏州海狸公司);膜联蛋白V-PI 凋亡检测试剂盒(Annexin V-FITC/PI,美国SAB 公司);FITC 荧光标记试剂盒(美国赛默飞世尔科技公司);兔网织红细胞裂解液系统(Rabbit Reticulocyte Lysate System,美国Promega公司)。
1.2 测试与表征
动态光散射仪(Zetasizer Nano ZS90 型,英国马尔文公司);荧光显微镜(EVOS FL 型,美国AMG 公司);流式细胞仪(FACS Calibur 型,美国BD Biosceiences 公司);超声波信号发生器(上海比朗公司);透射电子显微镜(JEM-1400 型,日本电子株式会社)。
1.3 实验步骤
1.3.1 野生型Stx1A 和突变型Mu-Stx1A 蛋白的表达
(1) 质粒构建与转化 野生型stx1A 编码序列(长度)和突变型Mu-stx1A 编码序列由上海楚豫生物有限公司合成。Mu-Stx1A 编码序列是通过对Stx1A氨基酸序列中的活性位点进行点突变,将第167 位谷氨酸突变为天冬氨酸,作为本研究的阴性对照[20]。分别将stx1A 和Mu-stx1A 编码序列插入载体pET28aXbal 和XhoI 位点构建表达质粒pET-28a-stx1A 和pET-28a-Mu-stx1A。用热激法将质粒转化至感受态细胞DH5α,并接种于卡那抗性的LB(Luria-Bertani)平板(含硫酸卡那霉素50 μg/ mL),37 ℃倒置培养过夜。挑取单克隆接种到5 mL 含有50 μg/mL 卡那霉素的LB 液体培养基中,在37 ℃、250 r/min 条件下振荡培养6 h。小抽后,取2 μL 质粒进行Xbal 和XhoI双酶切电泳鉴定和测序分析。
(2) 野生型Stx1A 和突变型Mu-Stx1A 重组蛋白表达 将构建好的表达质粒转化至感受态细胞Rosettagami(DE3),利用卡那抗性LB 平板筛选阳性克隆。挑选阳性克隆接种至5 mL 含有50 μg/mL 卡那霉素的LB 液体培养基中,37 ℃振荡培养过夜。次日,将上述菌液全部接种于150 mL 含有50 μg/mL卡那霉素的LB 液体培养基中,37 ℃振荡培养至吸光度(OD600)达到0.8,加入终浓度为0.5 mmol/L 的异丙基硫代半乳糖苷(IPTG),在16 ℃诱导过夜,然后在4 ℃、4 000 r/min 条件下离心25 min,收集菌体沉淀进行蛋白纯化。
(3) 野生型Stx1A 和突变型Mu-Stx1A 重组蛋白的分离纯化 用BeaverBeadsTMHis-tag Protein Purification 试剂盒纯化蛋白。将2 g 菌液沉淀用10 mL 结合液(40 mmol/L 咪唑的磷酸盐缓冲液(PBS)溶液)重悬,加入蛋白酶抑制剂苯甲基磺酰氟(PMSF)(1 mmol/L),置于冰上超声裂解细菌(超声参数:功率300 W,超声3 s,间隔6 s,总时间30 min)。将超声破碎后的菌液加入预处理后的5 mL 镍离子螯合磁珠(150~250 μmol/L)中混合均匀,然后在4 ℃旋转混合仪上旋转孵育1 h 使目标蛋白结合在磁珠上。对磁珠和菌液进行磁性分离,用洗液洗涤磁珠2 次,加入洗脱液洗脱目标蛋白。将空载体、未诱导菌液、诱导后菌液、洗脱液进行SDS-PAGE,检测蛋白表达和蛋白纯度。
(4) 野生型Stx1A 和突变型Mu-Stx1A 的活性测定
荧光素酶(Luciferase)的荧光标准曲线:用1 mg/mL的BSA 缓冲液稀释配制4.3×10-10~4.3×10-19mol/L 的荧光素酶溶液,以荧光素为底物,用化学发光仪检测荧光素酶在催化荧光素氧化过程所产生的生物荧光,以荧光素酶的物质的量为横坐标,荧光强度为纵坐标,做荧光标准曲线。
用兔网织红细胞裂解液(含有蛋白质合成所必需的tRNA、核糖体、起始延伸和终止因子等组分)体外转录试剂盒检测野生型Stx1A 和突变型Mu-Stx1A蛋白对荧光素酶蛋白合成过程的影响。在冰浴上用预冷PBS 溶液将野生型蛋白和突变型蛋白分别稀释成不同的浓度,分别取1.5 μL 蛋白溶液与17.5 μL 的兔网织红细胞裂解液在37 ℃下反应60 min,以不加蛋白的兔网织红细胞裂解液在37 ℃下反应60 min作为阳性对照。再分别加入0.25 μL 氨基酸混合物(无亮氨酸,1 mmol/L)、0.25 μL 氨基酸混合物(无蛋氨酸,1 mmol/L)、0.5 μL RNasin®核糖核酸酶抑制剂(40 ug/μL)、2 μL 荧光素酶对照RNA (1 μg/μL)和5.5 μL 无核酸酶水。然后在30 ℃下培养90 min,加入荧光素底物,测定荧光强度,根据荧光素酶荧光标准曲线计算相应的荧光素酶的含量,从而反映出野生型Stx1A 和突变型Mu-Stx1A 对荧光素酶合成过程的影响。
(5) 野生型Stx1A 和突变型Mu-Stx1A 的荧光标记
将370 μg 异硫氰酸荧光素酯( FITC,MW=389.5)染料标记试剂溶解在37 μL 的二甲基亚砜(DMSO)中,使FITC 与蛋白的物质的量之比为40∶1,取适量的FITC 与0.2 mg/mL 的野生型或突变型蛋白混合,避光条件下搅拌反应60 min,用FluoReporter®蛋白标记试剂盒中配备的Spin 柱和纯化树脂除去非特异性连接的染料分子,从而得到FITC 标记的野生型或突变型蛋白。
1.3.2 聚合物胶束包载Stx1A 或Mu-Stx1A 用课题组合成的PEG8-PDPA100-PEG8制备胶束包载蛋白。取0.2 mg/mL 的蛋白200 μL 加入0.8 mL、pH 为7.4 的PBS 缓冲液中,然后逐滴滴入棕色小瓶中(瓶内装有50 μL、6 mg/mLPEG8-PDPA100-PEG8的四氢呋喃溶液),搅拌过夜,使四氢呋喃挥发完全。最终棕色小瓶内的蛋白质量浓度为0.04 mg/mL,聚合物质量浓度为0.3 mg/mL。使用动态光散射仪检测空胶束及载蛋白胶束的粒径分布及表面电位;将一定量的空胶束、游离蛋白及载蛋白胶束分别负载在铜网上,用透射电子显微镜观察形貌。
1.3.3 细胞转染率测定 细胞转染率:将Hela 细胞(ATCC)在体积分数为10%牛血清蛋白(FBS) DMEM双抗培养基(含100 U/mL 青霉素G/硫酸链霉素)中贴壁培养至细胞密度达到80%,然后接种于含新鲜培养基的12 孔板(5×105个/孔)中继续培养过夜。当孔板中细胞密度达到80%时,用荧光标记的不同浓度的Stx1A 胶束、Mu-Stx1A 胶束以及空胶束将其分别转染2 h,用PBS 洗涤,将细胞重悬于培养液中,用流式细胞仪分析细胞转染率。
1.3.4 细胞凋亡测定 用Annexin V-FITC/PI 细胞凋亡试剂盒检测细胞凋亡率:首先将Hela 细胞接种在6 孔板中,培养过夜;然后分别与空胶束、Stx1A 胶束和Mu-Stx1A 胶束(其中Stx1A 和Mu-Stx1A 的质量均为4 μg)共孵育2 h,用PBS 洗3 遍,将细胞重悬于结合缓冲液中与annexin V-FITC 和碘化吡啶(PI)于室温下共孵育10 min,用流式细胞仪分析细胞凋亡率。
2 结果与讨论
2.1 pET-28a-stx1A 和pET-28a-Mu-stx1A 的 质 粒鉴定
stx1A 编码序列插入质粒pET-28a 的XbaI 和XhoI 单克隆位点之间。用XbaI 和XhoI 分别双酶切pET-28a-stx1A 和pET-28a-Mu-stx1A。琼脂糖凝胶电泳结果(图1(a))显示,酶切产物长度约为900 bp。将酶切鉴定结果为阳性的质粒送测序分析,测序结果和双酶切结果均证明pET-28a-stx1A 和pET-28a-Mu-stx1A 重组质粒构建成功。
2.2 野生型Stx1A 和突变型Mu-Stx1A 重组蛋白表达与鉴定
分别将空载体和未诱导Stx1A 或Mu-Stx1A 菌液、诱导后Stx1A 或Mu-Stx1A 菌液、纯化后洗脱下来的Stx1A 或Mu-Stx1A 重组蛋白溶液进行SDSPAGE 和考马斯亮蓝染色。从图1(b)SDS-PAGE 图中可以看出,在32 kDa 左右出现条带,表明野生型Stx1A 和突变型Mu-Stx1A 重组蛋白成功表达。

图1 Xbal 和XhoI 双酶切电泳(a)和Stx1A 重组蛋白,Mu-Stx1A 重组蛋白的SDS-PAGE(b)Fig. 1 pET-28a-Stx1A digested with Xbal and XhoI (a) and SDS-PAGE of Stx1A and Mu-Stx1A recombinant protein (b)
2.3 野生型Stx1A 和突变型Mu-Stx1A 对蛋白合成的抑制作用
首先考察了Stx1A 和Mu-Stx1A 对蛋白合成的抑制功能。用兔网织红细胞裂解液体外转录翻译试剂盒检测Stx1A 和Mu-Stx1A 对荧光素酶转录与翻译过程的影响,判断Stx1A 和Mu-Stx1A 的生物活性。从图2 的结果可以看出,当野生型Stx1A 质量浓度在10~40 μg/mL 时,荧光素酶合成量出现骤然的下降,从100%降至约10%,表明野生型Stx1A 具有抑制蛋白合成的功能;当野生型Stx1A 质量浓度高于40 μg/mL 时,荧光素酶合成量继续减少,直至几乎完全抑制体外蛋白的合成,表明野生型Stx1A 具有抑制蛋白合成的功能,有较高的生物活性。相反,突变型Mu-Stx1A 在1.25~40 μg/mL 的质量浓度范围内,对荧光素酶合成量几乎没有抑制作用;当其质量浓度高于40 μg/mL 时,荧光素酶合成量仍在80%以上,表明突变型Mu-Stx1A 不具有抑制蛋白合成的功能。因此突变型Mu-Stx1A 可作为本实验的阴性对照。在本实验中野生型Stx1A 和突变型Mu-Stx1A 的质量浓度均选择40 μg/mL,在该浓度下,野生型Stx1A 能够抑制90%的体外蛋白合成量,而突变型Mu-Stx1A几乎不具有抑制体外蛋白合成的作用。这是由于野生型Stx1A 蛋白具有高度特异的RNA N-糖苷酶活性,催化28S rRNA 上的腺苷脱嘌呤,使延伸因子1 依赖性的氨酰-tRNA 与核糖体的结合受到抑制,从而阻断了肽链延伸和蛋白质合成;而突变型Mu-Stx1A 氨基酸序列是通过对Stx1A 氨基酸序列中的活性位点进行点突变,使得重组表达的突变型Mu-Stx1A 蛋白不再具有蛋白抑制作用。
图2 Stx1A 和Mu-Stx1A 对蛋白的合成抑制作用Fig. 2 Inhibition of protein synthesis by Stx1A and Mu-Stx1A
2.4 包载蛋白的聚合物胶束物理化学性质
实验测试了PEG8-PDPA100-PEG8空胶束及其包载Stx1A 和Mu-Stx1A 前后的理化性质。表1 所示是通过动态光散射仪检测胶束和蛋白的性质与参数,空胶束的粒径为173.4 nm,在包载Stx1A 或Mu-Stx1A 后,胶束粒径变为189.0 nm 和208.5 nm。与空胶束粒径相比,在包载蛋白后含蛋白胶束的粒径有所增大,且形成Stx1A 胶束和Mu-Stx1A 胶束的聚合物分散系数(PDI)值较小,说明形成的聚合物胶束粒径均一。同时,在pH 为7.4 时,Stx1A 和Mu-Stx1A 蛋白的电位分别为-11.0 mV 和-12.4 mV,空胶束的电位为-8.8 mV,在包载Stx1A 或Mu-Stx1A 后,胶束电位分别变为-12.2 mV和-14.9 mV。实验结果显示空胶束和包载蛋白的胶束都呈电负性。图3 示出了通过TEM 表征空胶束及其包载蛋白后的形貌,空胶束的粒径为130 nm左右,游离蛋白的粒径在40~60 nm之间,包载蛋白的胶束粒径在150 nm 左右,这主要是因为动态光散射仪检测时胶束处于水化状态因而粒径会比TEM 结果略大。同时,聚合物胶束在包载蛋白后其粒径略有增加,这与动态光散射仪测定结果一致。通常情况下,蛋白表面存在亲水区域和疏水区域[21],因此可以推测本文所用的聚合物可能是蛋白表面的疏水区域通过疏水相互作用把蛋白载入到胶束中。
图3 空胶束(a)、蛋白(b)及载蛋白胶束(c)的TEM 图Fig. 3 TEM images of unloaded micelles (a), free protein (b) and protein-loaded micelles (c)

表1 胶束及蛋白的性质和参数Table 1 Properties and parameters of micelle and free protein
2.5 聚合物胶束包载对蛋白的细胞转染率的影响
为了考察聚合物胶束的包载对蛋白的细胞转染率的影响,本文用聚合物胶束包载FITC 标记的野生型或突变型蛋白并转染Hela 细胞,用流式细胞仪测定细胞转染率,结果如图4 所示。研究表明,未包载的 Stx1A 和 Mu-Stx1A 细胞几乎不能被细胞摄取(转染率分别为0.518%(图4(a))和0.417%(图4(d))),主要是因为蛋白质多肽类生物大分子自身很难穿过细胞膜的磷脂双分子层而进入细胞内部[22]。而聚合物胶束包载的Stx1A 胶束(4 μg)、Stx1A 胶束(6 μg)的细胞转染率分别为20.1%(图4(b))和59.4%(图4(c)),相应地,Mu-Stx1A 胶束(4 μg)、Mu-Stx1A 胶束(6 μg)的细胞转染率分别为22.7%(图4(e))和39.6%(图4(f))。说明无论是野生型还是突变型蛋白,通过聚合物胶束包载运输都能够实现蛋白物质的胞内有效运输而获得较高的细胞转染率,且当与Hela 细胞孵育的蛋白量从4 μg 增加到6 μg 时,细胞转染率提高,表明该聚合物胶束具有将蛋白运载进入胞内的能力。
图4 FITC 标记的Stx1A 胶束和Mu-Stx1A 胶束的细胞转染率Fig. 4 Cell transfection efficiency of FITC-labeled Stx1A and Mu-Stx1A micelles
本文所用的pH 敏感型聚合物胶束在我们课题组之前的研究中[19]已经验证了其能够通过内吞作用进入细胞的溶酶体中。通过测定发现聚合物胶束的pH 敏感点在6.9 左右,而在癌细胞中内体的pH 值为5.0~6.0。因此当胶束进入内体时,PDPA(聚异丙基甲基烯酸酯)发生质子化胶束溶胀解体释放蛋白质,同时由于胶束“质子海绵”效应的渗透裂解和胶束溶胀产生的机械应变会导致内体破裂[23],将目标蛋白释放到胞浆中。
2.6 聚合物胶束包载蛋白对细胞毒性的影响
为了测定聚合物胶束包载的Stx1A(Stx1A 胶束)对Hela 细胞的细胞毒性,选用胶束包载的突变型Mu-Stx1A(Mu-Stx1A 胶束)作为阴性对照。不同质量的Stx1A 胶束或者Mu-Stx1A 胶束与Hela 细胞共孵育2 h 后,在显微镜下观察细胞形态,并用Annexin VFITC/PI 细胞凋亡试剂盒检测细胞凋亡率,实验结果如图5 所示。从图5(a)可以看到在相同的蛋白量下,与Mu-Stx1A 胶束共孵育后的细胞相比,Stx1A 胶束作用后的Hela 细胞浓缩变圆,失去黏附能力。且随包载的Stx1A 质量的增加,细胞病变效应越明显(图5(a~c))。相应地,Mu-Stx1A 胶束作用后的细胞即使在较高的Mu-Stx1A 质量(8 μg)下细胞也正常,贴壁生长良好,呈菱形或不规则的三角形(图5(d~f))。用流式细胞仪分析Stx1A 胶束或Mu-Stx1A 胶束(4 μg)对Hela 细胞的凋亡率的影响,发现与未包载Stx1A 或未包载Mu-Stx1A 共孵育后,细胞凋亡率分别为5.90%和7.78%(图6(a、c)),而与Stx1A 胶束或Mu-Stx1A 胶束(4 μg)作用后,Hela 细胞凋亡率分别为35.5%和5.22%(图6(b、d)),该数据和图5 观察到的细胞形态结果一致。以上结果表明,聚合物胶束包载的Stx1A 进入细胞后仍然具有生物活性,能够抑制蛋白合成导致细胞凋亡,而作为对照的Mu-Stx1A 胶束由于其本身没有相应的生物功能因而细胞毒性极小。

图5 Hela 细胞与不同质量的Stx1A micelle 和Mu-Stx1A micelle 作用后的细胞形态Fig. 5 Apoptosis of Hela cells after treated with Stx1A micelle or Mu-Stx1A micelle with different mass
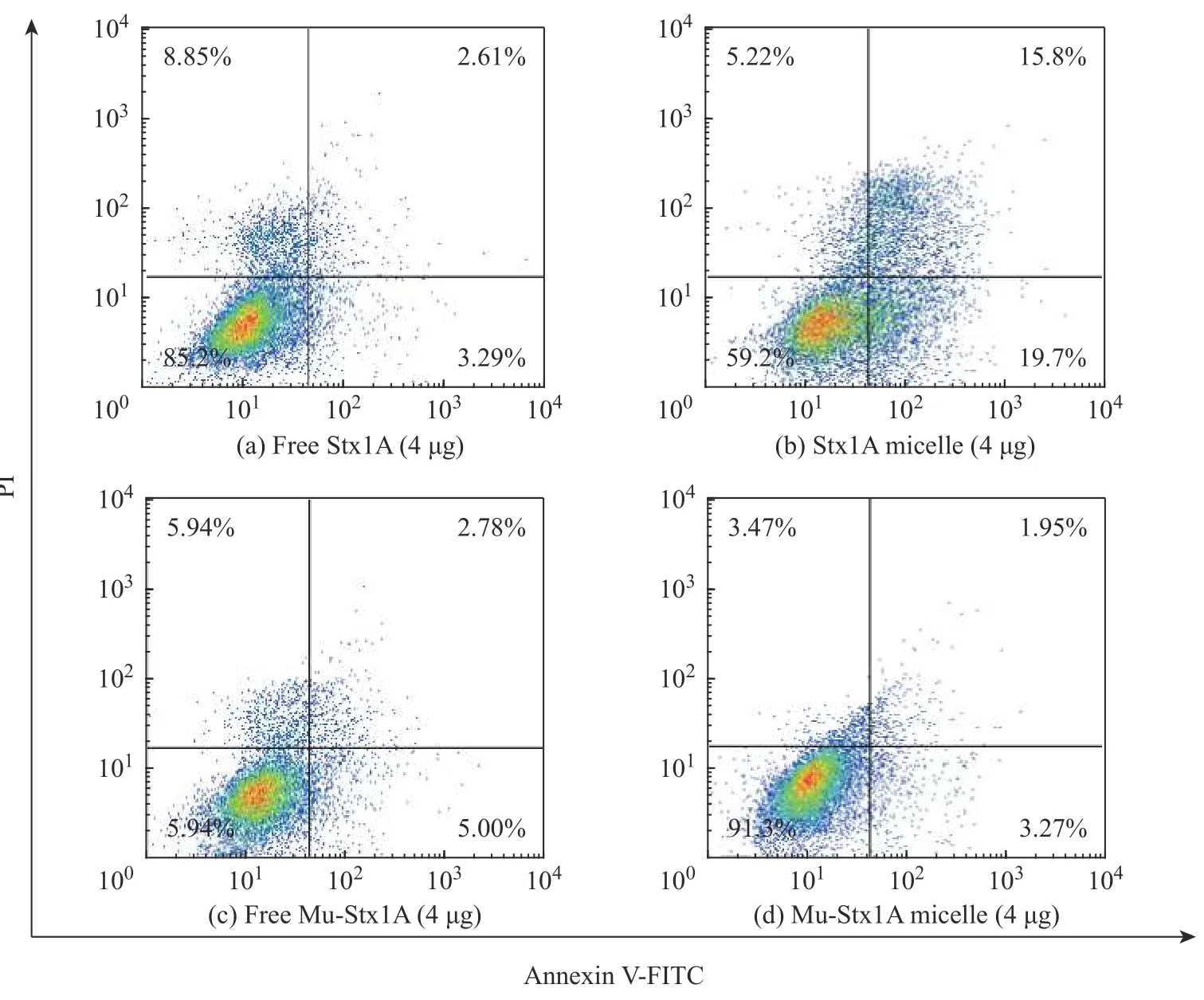
图6 Hela 细胞与不同浓度的 Stx1A micelle 或 Mu-Stx1A micelle 作用后的凋亡实验Fig. 6 Apoptosis experiment of Hela cells after treated with Stx1A micelle or Mu-Stx1A micelle with different concentrations
3 结束语
利用pH 敏感型三嵌段聚合物PEG8-PDPA100-PEG8与志贺毒素蛋白Stx1A 自组装形成蛋白-聚合物胶束,这种pH 敏感型胶束在正常体液环境下不溶胀,转染进入细胞后,由于内体中pH 低,PDPA 的质子化速率快,使得胶束迅速溶胀解体将Stx1A 释放至肿瘤细胞浆中,Stx1A 具有抑制蛋白合成的作用,其在胞浆中发挥毒性功能,诱导细胞程序性死亡。
该聚合物胶束具有细胞毒性低、制备简单、稳定性好等优点,可以作为蛋白类、核酸类等生物大分子细胞转染的选择。本研究为肿瘤细胞靶向递送功能性生物大分子提供了一种有效方法,并为后续Stx1A 在肿瘤治疗中的研究和应用提供了一定的理论基础。
