半乳凝集素3在小鼠肺缺血再灌注损伤中的表达*
2022-04-28刘豪何小静刘春霞伍思怡林飞
刘豪,何小静,刘春霞,覃 伊,伍思怡,赵 晨,林飞
(广西医科大学附属肿瘤医院麻醉科,南宁 530021)
肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI)是指当肺组织缺血缺氧一段时间重新建立血流和通气时,先前缺血的肺脏会加剧缺血性损伤并导致微血管通透性和肺血管阻力增加以及免疫反应强烈激活的一系列复杂的病理生理过程[1-2]。LIRI是一种复杂的“无菌性”炎症,被认为与血管通透性增加以及细胞因子和补体系统的激活直接相关[3],先天性和适应性免疫反应的激活可导致肺损伤[4],但是对于LIRI发生和发展的调控机制目前尚未阐明,临床上仍缺乏有效的防治手段。
半乳凝集素3(galectin 3,Gal3)是一种结合β-半乳糖苷的凝集素,高度保守并广泛分布于细胞内和细胞外[5]。近年来,Gal3被认为是一种新型炎症因子,参与血管内炎症、巨噬细胞活化、细胞增殖和细胞黏附等过程[6-7]。有研究证实,Gal3可以促进组织器官的免疫炎症反应,激活炎症小体,促进细胞因子风暴综合征,导致组织损伤和炎症爆发[8-10]。但是Gal3在LIRI中的作用机制尚不明确,本研究通过建立小鼠LIRI模型,探讨Gal3在LIRI中的表达情况。
1 材料与方法
1.1 实验动物
在广西医科大学实验动物中心购买健康的SPF级C57BL/6J雄性小鼠20只,动物合格证号:202006019。体重(20±5)g,6~8周龄,以12 h光照/黑暗交替循环饲养,期间自由进食、饮水。
1.2 主要试剂与材料
苏木精—伊红(HE)染色试剂盒(#G1120)购自北京索莱宝科技有限公司。酶联免疫吸附法(ELISA)试剂盒(#CSB-E04741m、#CSB-E08054m)购于武汉华美生物工程有限公司。免疫荧光染色相关试剂(#P0265、#P0262、#P0260、#P0131)和BCA蛋白浓度测定试剂盒(P0010)购自上海碧云天生物技术研究所。TRIzol试剂、cDNA合成试剂盒和Tli RNaseH Plus定量试剂盒均购自日本Takara公司。一抗:β-actin兔单克隆抗体(#4970)购自美国CST公司,稀释倍数为1∶1 000;Gal3小鼠单克隆抗体(#ab2785)购自英国Abcam公司,稀释倍数为1∶1 000,免疫荧光染色稀释倍数为1∶200。二抗均购自英国Abcam公司:山羊抗兔IgG H&L(IRDye®800CW)预吸附二抗(#ab216773)、山羊抗小鼠IgG H&L(IRDye®800CW)预吸附二抗(ab216772),稀释倍数为1∶15 000;山羊抗小鼠IgG H&L(#ab97020)用于免疫荧光染色,稀释倍数为1∶500。
1.3 实验方法
1.3.1动物分组与处理20只C57BL/6小鼠随机分为假手术组和4组实验组(即LIRI后2 h组、LIRI后6 h组、LIRI后12 h组、LIRI后24 h组),每组4只。所有小鼠备皮后经腹腔注射1%戊巴比妥(50 mg/kg)进行麻醉、固定,行气管通气[11]。于小鼠左侧胸骨第3~4肋间位置切开皮肤,然后逐层钝性分离,直至暴露左肺,找到左肺门后使用无损显微血管夹夹闭肺门,可观察到左肺不再通气,夹闭60 min后松开血管夹,逐层进行缝合。其中假手术组只开胸不夹闭肺门,于开胸后60 min处死小鼠;各实验组分别于松开血管夹后2 h、6 h、12 h、24 h处死小鼠。收集各组左肺标本,储存于-80℃冰箱用于后续实验。
1.3.2 HE染色观察肺组织病理形态学变化 取小鼠左肺组织,置于4%多聚甲醛中浸泡固定24 h,常规石蜡包埋后切成5μm厚的组织薄片,置于载玻片上,切片常规HE染色封片后,通过光学显微镜观察肺组织病理形态学变化,拍照。参照文献标准对肺损伤程度进行评分[12]。
1.3.3支气管肺泡灌洗液(BALF)提取 小鼠被处死后,从主支气管用1 mL预冷的磷酸盐缓冲盐水(PBS)灌注左肺以收集BALF。收集的液体在4℃、1 500 r/min条件下离心10 min,取上清液用于后续实验。
1.3.4 ELISA检测BALF中白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNF-α)表达量 将提取的BALF按照试剂盒说明书进行实验分析。
1.3.5实时荧光定量PCR(RT-qPCR)检测肺组织Gal3 mRNA表达量用TRIzol法提取肺组织的总RNA后,检测RNA的纯度和浓度,按照cDNA合成试剂盒步骤进行逆转录。将cDNA按Tli RNaseH Plus定量试剂盒步骤进行RT-qPCR反应,检测Gal3 mRNA表达(ABI 7900型荧光定量PCR仪),使用2-ΔΔCT法进行数据分析。以GAPDH作为内参基因,其引物序列:上游,5’-AGGTCGGTGTGAACG-GATTTG-3’,下游,5’-TGTAGACCATGTAGTTGAGGTCA-3’;Gal3的引物序列,上游:5’-AGACAGCTTTTCGCTTAACGA-3’,下 游,5’-GGGTAGGCACTAGGAGGAGC-3’。
1.3.6 Western blotting法检测肺组织Gal3蛋白表达量 提取肺组织总蛋白,BCA法测定蛋白浓度。以50μg蛋白量上样,10%聚丙烯酰胺凝胶电泳后转移至PVDF膜,5%脱脂奶粉封闭60 min后洗膜,将PVDF膜置于稀释的一抗中4℃孵育过夜。次日,洗膜后将PVDF膜置于对应的二抗中室温孵育1 h,使用Alpha Innotech化学发光凝胶成像系统扫描成像,Image J软件分析各蛋白条带灰度值。
1.3.7免疫荧光染色检测肺组织Gal3表达 将肺组织石蜡切片常规脱蜡水化后,使用1×(pH=6)柠檬酸钠抗原修复液进行抗原修复,QuickBlock™免疫染色封闭液封闭10 min,滴加一抗后在4℃冰箱中孵育过夜。次日,PBS冲洗切片,滴加二抗后室温孵育50 min,PBS冲洗,用含DAPI抗荧光淬灭封片液封片,在荧光显微镜下观察并拍照。
1.4 统计学方法
采用SPSS 25.0软件进行数据统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理学和W/D变化
假手术组的肺组织结构清晰,肺间质无充血和水肿,肺泡间隔完整,腔内未见炎性细胞浸润;与假手术组相比,LIRI后不同时间肺组织结构均有不同程度的损伤:LIRI后2 h出现肺损伤,肺泡壁轻度增厚,有少量炎性细胞浸润;在LIRI后6 h达到高峰,可见肺组织结构严重破坏,肺泡间隔明显增厚,大小不一,有大量炎性细胞浸润和红细胞渗出;随着LIRI后时间延长肺组织损伤程度逐渐减轻。与假手术组相比,各实验组肺组织损伤评分和肺组织W/D均有所升高(均P<0.05);其中LIRI后6 h组肺损伤评分和W/D高于其他实验组(均P<0.05),见图1。

图1 肺组织病理学和W/D变化
2.2 小鼠BALF中炎性因子表达水平的变化
与假手术组相比,在LIRI发生后各实验组小鼠BALF中IL-1β和TNF-α 的表达均逐渐升高(均P<0.05),均在LIRI后6 h组达到高峰(均P<0.05),随后逐渐下降,见图2。

图2 小鼠BALF中IL-1β和TNF-α表达变化
2.3 小鼠肺组织中Gal3 mRNA表达水平的变化
与假手术组比较,在各实验组中Gal3的mRNA相对表达水平呈现先升高后降低的趋势,在LIRI后6 h组达到高峰后逐渐降低(均P<0.05),见图3。

图3 小鼠肺组织中Gal3 mRNA表达量变化
2.4 小鼠肺组织中Gal3 蛋白表达水平的变化
与假手术组比较,各实验组中Gal3蛋白表达水平升高(均P<0.05),在LIRI后6 h组达到高峰,然后逐渐降低(均P<0.05),见图4。

图4 小鼠肺组织中Gal3蛋白表达量变化
2.5 小鼠肺组织中Gal3 免疫荧光表达水平的变化
与假手术组相比,各实验组表达量增多,在LIRI后6 h组达到峰值,随后逐渐减弱,见图5。
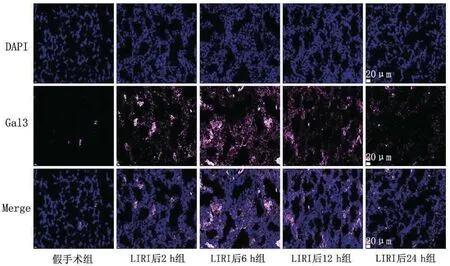
图5 小鼠肺组织中Gal3表达量免疫荧光染色图(×400)
3 讨论
LIRI是肺移植、心脏搭桥、心肺复苏等疾病的主要并发症之一[13],其致病机制复杂,主要特征是微血管通透性增加、肺血管阻力增加,引起一系列强烈的免疫反应,释放大量细胞因子,导致爆发性炎性反应,造成肺水肿和氧合受损,最终导致组织损伤[4,14]。本研究结果表明,LIRI发生后肺组织结构严重破坏,肺泡壁增厚,肺间质水肿,不同程度的红细胞渗出和炎性细胞浸润,肺损伤病理学评分升高,肺组织W/D增加,同时BALF中IL-1β和TNF-α 水平升高。
Gal3是半乳凝集素家族的重要成员之一,能够通过凝集素—碳水化合物相互作用寡聚化并参与细胞表面和细胞外基质聚糖的多价相互作用,从而影响细胞功能,在各种器官的许多生物活动中起重要作用,是炎症反应和免疫系统的重要调节剂[15]。Gal3被认为是一种稳定的生物标记物,在正常情况下其在体内表达水平与体重、年龄、性别无关,很容易从受损细胞和炎症细胞分泌到细胞表面和生物体液(如血清和尿液)中,因此Gal3可作为多种疾病早期潜在的生物标志物,用于疾病诊断或预后情况预测[16-17]。研究表明,Gal3在博来霉素和LPS诱导的急性肺损伤中的表达升高,下调Gal3表达后可减轻急性肺损伤和炎症反应[18],提示Gal3可能在LIRI中发挥重要作用。
越来越多的证据表明,Gal3参与了器官缺血性疾病的发生和发展,Gal3在肾功能衰竭和急性心肌梗死中的表达均上调,敲低Gal3可以减组织损伤和细胞的炎症反应[19-20]。本研究发现,LIRI会导致肺组织严重损伤,肺组织充血水肿,炎性因子表达升高。采用RT-qPCR法、Western blotting法和免疫荧光染色法检测Gal3的表达,结果表明,在LIRI发生后Gal3升高,并在LIRI后6 h达到高峰,随后呈下降趋势,与肺组织损伤和炎症反应的变化一致。提示高水平的Gal3可能与LIRI早期免疫调控有关。
综上,在小鼠LIRI中Gal3的表达水平升高,肺组织损伤严重,炎性因子分泌增多,Gal3可能参与调控小鼠LIRI病理变化和炎症反应的发生和发展。
