白僵菌固体发酵菌丝生长阶段温度与CO2变化
2022-04-28蔡守平杨际伟曾丽琼林和再何学友
蔡守平,杨际伟,曾丽琼,林和再,兰 翔,谢 峥,何学友
(1.福建省林业科学研究院、国家林业局南方山地用材林培育重点实验室,福建 福州 350012;2.福建省科技厅农牧业科研中试中心,福建 福州 350012; 3.漳浦县林业局,福建 漳浦,363200;4.古田县林业局,福建 古田 352200)
白僵菌具有致病力强、寄主谱广及对环境友好等特点,在农林害虫生物防治中得到广泛应用,具有十分广阔的市场前景[1-2]。规模化大量生产白僵菌分生孢子是大面积应用的基础,目前菌厂白僵菌孢子生产普遍采用的技术是液固双相发酵法[3-6],即首先经液体发酵获得白僵菌液体菌种(菌丝体或芽生孢子),再接种到固体培养料上,扩大培养规模,获得大量分生孢子。固体发酵阶段受到菌株特性、固体培养料组成、发酵方式等多种因素影响[5-6],不同学者对白僵菌固体发酵参数的研究结果存在一定的差异。白僵菌固体发酵过程可分为菌丝生长阶段和产孢阶段[3-4],菌丝生长量是决定产孢量的直接因素,且菌丝生长阶段早期会产生大量的“发酵热”,调控难度大,是固体发酵成功与否的关键阶段[7]。本研究在研制了一套适宜于白僵菌固体发酵的发酵箱的基础上,进一步开展固体发酵中试试验,对白僵菌菌丝生长阶段的温度、CO2变化情况进行监测、调控,为规模化生产提供技术参考。
1 材料与方法
1.1 白僵菌固体发酵箱的研制
白僵菌固体发酵箱结构见图1。发酵箱为304不锈钢材质,长方体立式结构,箱体长×宽×高为1.5 m×0.8 m×2.3 m。正面为钢化玻璃材质对开门,方便观察内部情况。箱体内部主要包括支撑架与托盘、传感器组及循环组件。发酵箱整体密封性较好,箱体内部支撑架为10层×2列固定支架,用于放置发酵浅盘,层间距为18 cm。传感器组件、循环组件与放置于发酵室的物联网控制主机有线连接,构成智能监控技术系统,实现实验环境远程智能监测、预警与控制功能。传感器组包括空气温湿度传感器、二氧化碳浓度传感器和固体培养料温度传感器。空气温湿度传感器安装于发酵室内,二氧化碳浓度传感器和培养料温度传感器安装于发酵箱中。发酵箱内装有网络摄像机,用于定期拍摄固体培养料的变化情况。发酵箱放置于发酵室。

发酵盘自下向上编号为1~10号,1~3层为发酵箱下层,4~7层为发酵箱中层,8~10层为发酵箱上层;温度传感器分别位于1层、6层、10层,分别测定发酵箱下部、中部、上部的发酵基质温度。
循环组件置于发酵箱内。为解决固体发酵箱内上、下层之间的培养料温度梯度和菌丝生长不均一的问题,经多次采用“U”型、“L”型的空气循环装置对比试验,最终选择循环效果好的“L”型,即通过从发酵箱上部至底部引入2条“L”型管道延伸至底部,顶部安装换气扇,将上层空气通过管道泵至下层。用于实现发酵箱内空气的内循环和发酵箱内空气与发酵箱外空气的外循环。
1.2 白僵菌固体发酵
1.2.1 液体菌种的培养
1)斜面菌种。供试菌株选择菌丝生长快、产孢量较高的球孢白僵菌(BeauveriabassianaBbFZ-51)菌株,系福建省林业科学研究院森林保护研究所研究人员分离、保存。试管斜面菌种用PDA培养基在25 ℃条件下纯化培养备用。
2)三角瓶液体菌种培养基。配制SDY培养基1 L装入1000 mL三角瓶中,每瓶装500 mL培养基,瓶口纱布包扎后置于121 ℃蒸汽高压灭菌30 min,冷却后备用。
3)接种。在无菌操作台中,从试管菌种斜面上挑取孢子接入三角瓶液体培养基中,放入(25±1) ℃恒温振荡培养箱中振荡(120 r·min-1)培养72 h,培养成白色粘稠菌丝体液待用。
4)发酵罐液体发酵。液体发酵采用30 L的液体发酵罐(镇江日泰生物工程设备有限公司生产),发酵罐液体培养基成分为2%白砂糖+4%黄豆粉,装液量20 L,经121 ℃蒸汽高压灭菌1 h后冷却,接入振荡培养好的三角瓶液体菌液,液体发酵罐罐温设置为25 ℃,发酵培养48 h后得到的发酵液供固体培养料接种用。
1.2.2 固体发酵中试
1)固体培养料配制。按麦麸∶谷壳∶水重量为4∶1∶4比例,分别将麦麸和谷壳称量,混合均匀后加水再拌匀、装袋,每袋重约2 kg,放入高压灭菌锅121 ℃蒸汽高压灭菌50 min,冷却后备用。
2)接种。在预先空间灭菌的密闭房间内进行,按20%的接种量(V/W),将培养好的发酵罐液体菌种倒入固体培养料中,搅拌机拌匀后分装入消毒过的培养盘(40 cm×60 cm)中,培养料厚度约2.5 cm,每盘重量约2 kg,接种完毕后移入置于发酵箱每层支架上,关闭发酵箱门,开始固体发酵。
1.3 温度监测与控制
发酵室内布置2个发酵箱,同时开展固体发酵。固体发酵开始后,通过空气温湿度传感器记录发酵室内的温湿度,智能调控加热器运行状态使室温保持在20 ℃。2个发酵箱分别做如下处理:1号发酵箱(未开启空气内循环)使用固体培养料温度传感器实时记录固体培养料的温度,分别于发酵箱上、中、下层(依次位于箱内第10、6、1层的培养盘料内)分别插入1个温度传感器,上部和下部分别设置1个CO2浓度传感器,固体培养料温度和CO2浓度每30 min各记录1次;发酵箱中的上层设置1个摄像头,设置每30 min定时拍摄1次,记录培养盘固体培养料的状态变化。2号发酵箱(开启空气内循环)基础操作同1号发酵箱,但启动空气循环系统,空气泵(内循环)设定常开状态;散热扇(外循环)关联空气温度传感器,箱内空气温度超过32 ℃时启动。
2 结果与分析
2.1 白僵菌固体发酵生长及温度、CO2的变化
白僵菌固体发酵菌丝生长过程见图2,温度变化见图3,CO2变化见图4。从图2~图4可以看出,固体培养料接种白僵菌菌液后置于发酵箱内,菌丝生长和温度变化分为发酵准备期(延滞期)、菌丝初始生长期(升温期)、菌丝旺盛生长期(稳定期)、产孢期等4个阶段。

图2 白僵菌菌丝生长阶段固体培养料变化

图3 白僵菌固体发酵过程中温度变化
2.1.1 发酵准备期(延滞期) 发酵时段为0~24 h,发酵箱内培养盘固体培养料没有太多变化,仅在24 h时开始有一些白色菌丝点在培养料表面形成,此阶段箱内固体料的温度变化幅度不明显,仅呈小幅上升的趋势,维持在22 ℃(发酵室内温度设定为20 ℃),没有出现明显的温度梯度,即上、中、下层发酵料温差别不大;而发酵箱内CO2浓度则呈现逐渐升高的状态,从2000 mg·m-3逐渐上升到5000 mg·m-3。
2.1.2 菌丝初始生长期(升温期) 发酵时段为24~48 h,24 h固体料开始出现一些白色菌丝,并在固体料表面及内部扩展;至48 h时,固体培养料表面形成一层白色薄菌丝层。此阶段固体培养料的温度呈急剧上升阶段,尤其是中、上层料温上升更为明显,48 h时中层发酵温度为31 ℃,上层温度为29.9 ℃,下层温度为25.9 ℃,形成明显的温度梯度;本阶段发酵箱内上层CO2浓度也快速升高,从5000 mg·m-3上升至13000 mg·m-3,而下层CO2浓度呈波动上升,升速较慢,从5000 mg·m-3升到6500 mg·m-3,表明CO2浓度亦呈明显的浓度梯度(图4)。
2.1.3 菌丝旺盛生长期(稳定期) 发酵时段为48~96 h,固体培养料上菌丝明显增多,逐渐覆盖整个培养料,至72 h时,固体培养料表面被厚厚的菌丝层覆盖,72 h后菌丝层厚度逐渐增加,肉眼观察变化不大;但上、下层菌丝的均匀度存在明显差异,中上层较为均匀,能覆盖整个固体培养料,而下层有部分固体培养料则会出现菌丝生长较慢的现象(图5)。该阶段固体培养料的发酵温度随发酵时间推移而逐渐降低,中上层温度48 h时为31 ℃,72 h时降到27 ℃,96 h时降为25 ℃,下层发酵温度48 h时为25.9 ℃,72 h时降至23 ℃,96 h时降至22 ℃,中上层与下层的温度梯度依然十分明显;CO2浓度则因发酵箱内湿度大,导致二氧化碳传感器受到结露影响,无法准确记录。
2.1.4 产孢期 发酵时段为96 h以后(共需7~10 d),该阶段表层菌丝开始逐渐产生分生孢子,进入产孢周期。固体料温依然呈现缓慢下降的趋势,逐渐下降接近或略高于发酵室内的温度,上中层与下层的温度差异也进一步缩小。
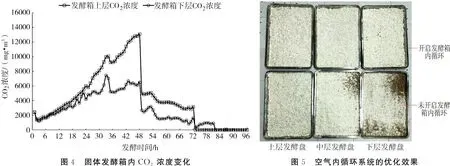
2.2 空气循环对白僵菌固体发酵的影响
引入空气循环系统后,固体发酵情况见图6和图7。空气循环对固体发酵过程没有影响,菌丝生长阶段与未加入循环系统保持一致。从图6可以看出,空气循环后,显著消除了上、下层培养料发酵的温度梯度,使上、下层的温度差异大幅度缩小;24~48 h为显著升温阶段;48 h时上层温度为30.3 ℃,下层温度为29.2 ℃。循环系统的加入也显著改善了CO2浓度梯度的现象,前30 h发酵箱上下层CO2浓度基本保持一致;30 h后CO2浓度显著升高;至42 h时发酵箱上层CO2浓度为16000 mg·m-3,下层浓度为13000 mg·m-3,上下层浓度差较未引入循环系统显著缩小(图7)。通过图5可以看出,在循环系统加入后,上、下层固体培养料中的白僵菌菌丝生长较为均匀,没有出现中下层菌丝不能布满的情况。

图6 空气内循环对培养料发酵温度的影响
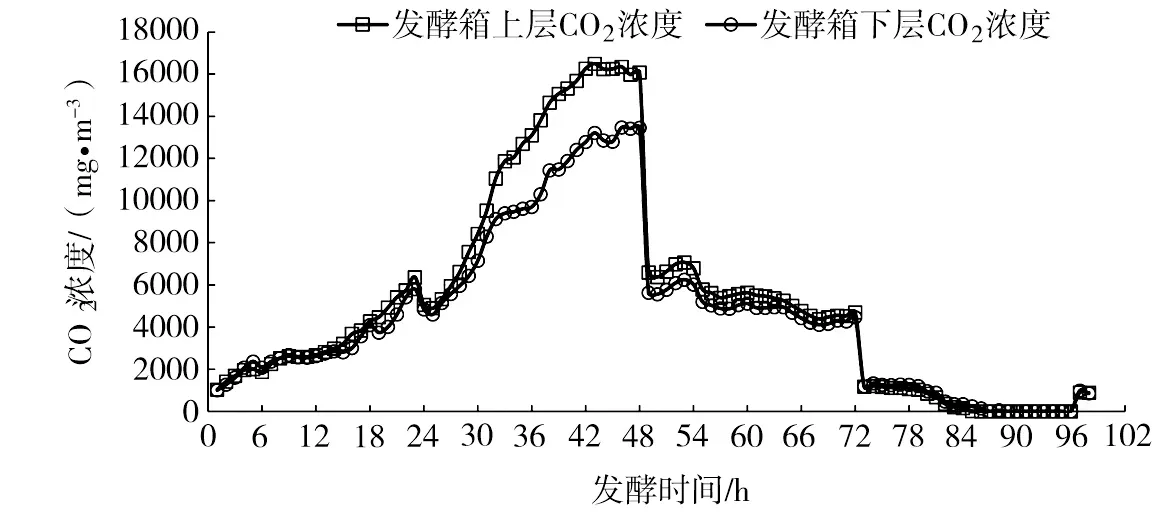
图7 空气内循环对发酵箱CO2浓度的影响
3 小结与讨论
3.1 小结
本研究采用发酵箱进行球孢白僵菌固体发酵中试及智能自动监测,揭示了白僵菌在箱内不同部位发酵准备期(延滞期)、菌丝初始生长期(升温期)、菌丝旺盛生长期(稳定期)和产孢期各阶段的菌丝生长、固体培养料温度、箱内CO2浓度变化规律,表明上、下层料温、CO2浓度差异梯度大,尤其升温期因发酵产生的大量“发酵热”致温度变化幅度最大。本试验通过加入空气内循环系统较好地调控了不同层间料温和箱内CO2浓度差异较大的现象,能有效促进发酵箱内上、中、下层培养料中菌丝生长且布满均匀,利于发酵后期白僵菌产孢,为白僵菌大规模生产工艺改进和完善提供了技术参考。
3.2 讨论
白僵菌生长不同时期对环境温湿度要求不尽相同,因此要根据白僵菌的生长特点在不同的发酵阶段采取不同的环境调控模式[3-4]。本研究发现白僵菌固体发酵前24 h为发酵准备期(延滞期),该阶段培养料温度和发酵箱内CO2浓度上升不显著,说明生物活动并不活跃。升温期料温和箱内CO2浓度急剧上升,有文献报道该阶段为对数生长期,但试验观察本阶段菌丝并不明显,可能是由于该阶段主要是发酵过程中的一些代谢活动非常活跃致使温度和CO2浓度升高。48~96 h是白僵菌菌丝生长最旺盛的阶段,此阶段发酵温度却是逐渐下降的,所以白僵菌固体发酵过程中 “产热”机制有待进一步研究。
白僵菌固体发酵阶段除受菌株特性、固体培养料的物理状态(成分、含水率、通气性)及接种量的影响外,发酵环境条件控制对固体发酵成功与否也至关重要。发酵空间、发酵量、环境温湿度、空气循环与热交换等都直接影响固体发酵的效率[6-8]。传统的开放式浅盘发酵周期长、环境条件难控制,其中发酵过程中的温度梯度是由于发酵过程中产热,而热空气单位质量比较轻,导致发酵空间中上层温度显著高于下层,温度梯度的产生往往会导致中上层发酵盘的温度过高甚至出现“烧盘”的现象,温度的升高同时还会导致固体基质湿度散发过快以及影响微生物生长[8];而下层往往由于温度达不到最佳发酵温度而产生生长缓慢的情况,在开放空间中如通过常规的通风装置来促进空气循环,又容易导致空气湿度快速下降。采用发酵箱进行固体发酵,发酵过程空气湿度不易散失,并引入空气循环装置,显著消除了温度梯度现象,促进了菌丝生长均匀性,提高了发酵效率。由于白僵菌菌丝生长阶段与产孢阶段对环境温湿度要求并不一致,对如何自动调控发酵箱内的温湿度等相关参数,最大程度促进白僵菌产孢,也有待进一步研究。
发酵过程因生物代谢活动,必然带来CO2的释放,代谢强度也会在CO2的释放速率上得到反映[9],一些学者认为CO2浓度可以作为生物量的间接指标[10-11]。也有学者研究表明,真菌生长不同阶段对CO2的敏感性和需求也不一样,过高的CO2浓度往往会抑制真菌的生长[12]。本试验通过监测固体发酵箱中的CO2累积浓度可以看出,白僵菌固体发酵过程中的CO2释放量非常大,CO2的累积对白僵菌菌丝生长和产孢的影响有待进一步研究;同时,我们认为有必要加入发酵箱内外空气交换装置来降低发酵箱内的CO2浓度,但是空气交换必然带来温度和湿度的散失[10],所以空气的交换量和频度有待进一步研究。试验中,为适应高湿环境,采用了红外吸收型CO2传感器,能够耐受一定的高湿环境,但发酵箱持续的高湿环境仍然使传感器元器件在试验后期产生结露,进而影响数据采集,导致后期数据出现断崖式下降的现象,这是工业传感产品在持续高湿环境下应用的普遍问题之一。因此如何避免或祛除传感器结露带来的影响,进而获得准确的监测数据,是研究解决CO2对白僵菌固态发酵过程影响的重要技术问题。
