氯化钴诱导缺氧环境对肝癌MHCC97-H细胞的影响
2022-04-28苏晓茹贵志芳柯强郑高明潘峰
苏晓茹 贵志芳 柯强 郑高明 潘峰


[摘要] 目的 探讨CoCl2诱导缺氧环境对肝癌MHCC97-H细胞产生的影响,研究CoCl2处理下MHCC97-H细胞中相关蛋白质表达水平变化及细胞活力和细胞凋亡情况。方法 分别在对照组(21% O2)和实验组(20 μmol/L CoCl2)处理下培养MHCC97-H细胞,用Western-blot法检测细胞中蛋白质表达(HIF2α、G9a、Reptin),于0 h、6 h、24 h、48 h、72 h用CCK8法检测细胞增殖,于6 h、24 h时用流式细胞仪检测细胞凋亡。结果 与对照组相比,CoCl2处理的MHCC97-H细胞中HIF2α、G9a、Reptin蛋白质表达显著升高(P<0.05),细胞活力降低,72 h细胞活力显著低于对照组(P<0.05),24 h后细胞凋亡显著增加(P<0.05)。 结论 CoCl2处理可对肝癌MHCC97-H细胞产生明显影响,20 μmol/L CoCl2即可导致细胞内相关蛋白质表达水平显著变化,影响细胞的活力和凋亡。
[关键词] 氯化钴;肝癌MHCC97-H细胞;细胞活力;细胞凋亡
[中图分类号] R73 [文献标识码] A [文章编号] 1673-9701(2022)09-0026-04
Effect of cobalt chloride-induced hypoxic environment on hepatocarcinoma MHCC97-H cells
SU Xiaoru GUI Zhifang KE Qiang ZHENG Gaoming PAN Feng
Department of Laboratory Medicine, the Affiliated Hospital of Hangzhou Normal University, Hangzhou 310015, China
[Abstract] Objective To investigate the effects of CoCl2-induced hypoxic environment on the hepatocellular carcinoma MHCC97-H cells, and to study the changes of related protein expression levels, cell viability, and apoptosis in MHCC97-H cells treated with CoCl2. Methods MHCC97-H cells were cultured under the treatment of the control group (21% O2) and the experimental group (20 μmol/L CoCl2). The protein expression (HIF2α, G9a, Reptin) in the cells was detected by the Western-blot method. Cell proliferation was detected by the CCK8 method at 0 h, 6 h, 24 h, 48 h, and 72 h. Cell apoptosis was detected by flow cytometry at 6 h, 24 h. Results Compared with the control group, HIF2α, G9a, and Reptin protein expression was significantly increased (P<0.05), cell viability was decreased, cell viability was significantly lower (P<0.05) at 72 hours, and apoptosis was significantly increased (P<0.05) after 24 hours in CoCl2-treated MHCC97-H cells. Conclusion CoCl2 treatment can have a significant effect on hepatocarcinoma MHCC97-H cells. 20 μmol/L CoCl2 can cause significant changes in the expression of related proteins in the cells and affect cell viability and apoptosis.
[Key words] Cobalt chloride; Hepatocarcinoma MHCC97-H cell; Cell viability; Apoptosis
原發性肝癌是常见的消化系统恶性肿瘤,主要包括肝细胞肝癌(hepatocellular carcinoma, HCC)和肝内胆管癌两种组织学类型,其中HCC占肝脏恶性肿瘤的75%~85%,是我国较为常见的恶性肿瘤,发病率高、预后差,严重威胁人类的生命健康[1-3]。手术治疗仍为首选手段,但效果并不十分理想,术后5年复发率高达50%~70%[4],如何降低HCC转移及术后复发一直是肿瘤领域的研究热点[5-6]。
缺氧是HCC最常见的微环境,与肿瘤的转移、浸润等均密切相关[7-9]。研究缺氧环境癌细胞的生长特性有助于了解转移、浸润的本质。用CoCl2诱导缺氧,适于快速建立稳定的体外细胞缺氧模型。而不同肿瘤细胞对CoCl2反应剂量可能不同[10-11]。目前关于肝癌MHCC97-H细胞对CoCl2反应剂量的报道较少。本研究旨在探讨CoCl2诱导缺氧对MHCC97-H细胞产生的影响,探讨细胞中相关蛋白质水平变化及细胞活力和细胞凋亡情况,为未来利用CoCl2构建MHCC97-H相关缺氧模型奠定基础。
1 材料与方法
1.1实验细胞和试剂
人肝癌细胞系MHCC97-H购于上海酶研生物科技有限公司(批号:CC-Y1613)。FBS(批号:E600001)、DMEM培养基(批号:E600003)、氯化钴(批号:A600316)、CCK-8试剂盒(批号:E606335)、Annexin V 凋亡检测试剂盒(批号:E606336)均来自BBI生命科学有限公司,HIF2α抗体(批号:ab207607)、G9a抗体(批号:ab185050)、Reptin抗体(批号:ab196027)均来自艾博抗(上海)贸易有限公司。
1.2 细胞培养
细胞用10% FBS加DMEM高糖培养基培养,置于37℃,5% CO2浓度培养箱中,生长到90%以上时传代。将对数生长期的细胞在96孔板中配置100 μL 2×104个/ml的细胞悬液。设对照组(21% O2)和实验组(20 μmol/L CoCl2),每组5个复孔。
1.3 Western blot检测
按实验分组培养细胞24 h,加100 μL裂解液使细胞裂解。取10 μL裂解物加入10 μL 2×SDS-PAGE loading buffer,100℃,5 min,冰上冷却3 min。室温12 000 g离心10 min去除不溶性沉淀,提取总蛋白并测定蛋白浓度。
用10% SDS-PAGE电泳分离样本。结束后,将PVDF膜在甲醇中浸泡1 min,用Transfer Buffer浸泡凝胶、滤纸和在甲醇中浸泡过的PVDF膜10 min,制备转移三明治。使用Semi-Dry Cell进行半干电泳转移。转移完毕,用1×Ponseau S solution染色并标记蛋白质条带位置。用Blocking Buffer封闭转印膜2 h。加入稀释一抗,4℃过夜。加入稀释的二抗,室温孵育2 h。用Super Signal West Pico Chemiluminent Substrates进行化学发光检测,对X线片曝光。经显影定影后,用凝胶成像分析系统拍照,用Gel-Pro Analyzer軟件分析。
1.4细胞活力检测
细胞预先培养24 h(37℃,5% CO2)。对照组(21% O2)加正常培养液,实验组加20 μmol/L CoCl2,将培养板在培养箱孵育一段时间(6 h、24 h、48 h、72 h)。按照试剂盒说明书,向每孔加10 μLCCK8溶液,在培养箱孵育1 h。用酶标仪测定450 nm处吸光度,计算细胞活力并绘制生长曲线。
1.5细胞凋亡检测
采用 PBS 洗细胞培养板两次,用胰酶消化,1000 rpm 离心5 min,弃去培养液,各管加10 ml PBS,轻柔地悬浮细胞,计数1×105细胞,放入100 μl 1× Binding Buffer,加入ANNEXIN V 5 μl孵育20 min,加PI 3 μl 孵育10 min,室温避光,加入400 μl Binding Buffer,流式细胞仪分析细胞凋亡情况。
1.6 统计学处理
以上实验重复至少三次,计量资料以均数±标准差(x±s)表示,使用Graphpad prism 6软件进行数据分析,用Bonferroni′s 多重比较检验分析方法(Bonferroni′s multiple comparisons test),P<0.05为差异有统计学意义。
2 结果
2.1 实验组与对照组MHCC97-H细胞形态观察
按照实验分组培养肝癌MHCC97-H细胞,24 h后,显微镜下观察:对照组MHCC97-H细胞贴壁良好,细胞的胞浆丰富,呈多边形,相邻细胞多紧密融合成片,而实验组培养基中漂浮细胞较多,细胞则变得相对稀疏,见图1。
2.2实验组与对照组MHCC97-H细胞相关蛋白质表达情况
按照实验分组培养肝癌MHCC97-H细胞,24 h后提取总蛋白,Westernblot方法检测细胞中HIF2α、G9a、Reptin表达,结果表明,与对照组相比,CoCl2处理的MHCC97-H细胞中HIF2α,G9a和Reptin蛋白表达均显著升高(P<0.05),尤其HIF2α表达量极显著,见图2~3)。
2.3实验组与对照组MHCC97-H细胞活力比较
按照实验分组培养肝癌MHCC97-H细胞,分别选取0 h、6 h、24 h、48 h、72 h检测细胞的吸光度,结果显示,与对照组相比,实验组MHCC97-H细胞活力降低,72 h细胞活力显著低于对照组(P<0.05),且随着时间延长,两组间差异逐渐增大,见图4。
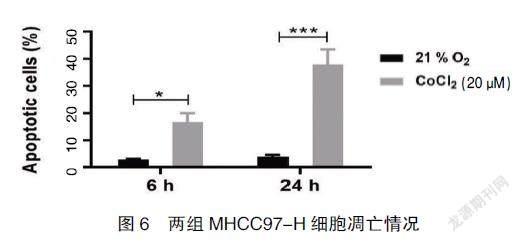
2.4实验组与对照组MHCC97-H细胞凋亡情况
按照实验分组培养MHCC97-H细胞,分别在6 h、24 h用流式细胞仪分析细胞凋亡情况,结果表明:与对照组相比,实验组MHCC97-H细胞凋亡增加,随着时间延长,24 h后细胞凋亡显著增加(P<0.05)。见图5、图6。
3 讨论
HCC是中国癌症相关死亡的第二大原因。HCC的转移率和复发率高,预后较差[12-13],阐明其转移、复发的调控机制仍非常重要。由于肿瘤细胞生长迅速,癌细胞多处于缺氧环境中,缺氧激活缺氧诱导因子,改变细胞的代谢方式,与肿瘤的转移、浸润等均密切相关[14]。因此,探究缺氧环境下肿瘤细胞的生长特性至关重要。人肝癌细胞系取材于原发肝癌组织,并不改变其生物学特性,广泛应用于肝癌细胞的生物学特性、浸润转移机制等方面的研究。CoCl2是常见的化学模拟缺氧的物质,可利用CoCl2构建肝癌细胞缺氧模型。然而目前关于肝癌MHCC97-H细胞对CoCl2反应剂量的报道较少。
研究发现,不同类型肿瘤细胞所需CoCl2浓度可能不相同,在乳腺癌细胞中CoCl2对乳腺癌MCF-7细胞的最佳浓度是150 μmol/L,而对MDA-MB-231细胞的最佳浓度仅为25 μmol/L[11]。翁苓苓等[10]研究了0~800 μmol/L CoCl2处理,对HepG2、Hep3B、SMMC-7721、Bel-7402肝癌细胞的影响,结果表明,CoCl2在 200 μmol/L内对肝癌细胞的生长无明显作用。其认为200 μmol/L是CoCl2诱导肝癌细胞化学性缺氧的最佳浓度。而本文发现,肝癌MHCC97-H细胞对CoCl2的反应性不同于以上四种细胞株,20 μmol/L CoCl2即对MHCC97-H细胞产生明显影响,导致细胞内HIF2α,G9a和Reptin蛋白表达显著升高、细胞活力降低、细胞凋亡增加。
有研究表明,CoCl2作用机制与氧浓度无关,其比常规缺氧模型更稳定,能调节缺氧相关基因的表达,具有与缺氧相同的调节作用[10]。也有研究指出,CoCl2主要通过钴的积累导致HIF1α表达来模拟缺氧[15],而本研究发现,CoCl2诱导缺氧同样会导致细胞内HIF2α表达显著增多。据报道,HIF2在肝癌细胞中普遍表达[16],比HIF1α更易促进肿瘤生长[17]。此外,Reptin是一种ATP酶,参与染色质的重塑和DNA的损伤修复等[18]。研究发现,Reptin沉默与DNA损伤会协同降低肝癌细胞的活力[19]。而本研究发现,CoCl2诱导的缺氧导致肝癌MHCC97-H细胞活力降低,此时Reptin表达是显著增高的,这可能是因Grigoletto 等[19]选用肝癌HuH7细胞,与本研究所用细胞系不同导致,这意味着Reptin与肝癌细胞活力的关系可能因细胞系的不同而不同,值得深入研究。
此外,有文献报道,G9a增多是缺氧依赖的,缺氧条件下Reptin第67位赖氨酸被G9a甲基化,甲基化Reptin结合到HIF1α的启动子上,负向调节缺氧相关基因的转录活性[20],而本研究表明,CoCl2诱导的缺氧环境下MHCC97-H细胞内G9a表达增多,且Reptin表达增多,可能会导致更多Reptin被G9a甲基化,同时由于HIF2α表达也增多,甲基化Reptin就可能结合到HIF2α的启动子上,参与调节HIF2α下游相关基因的转录活性,从而导致细胞活力降低、细胞凋亡增加,以上提示肝癌中HIF2α和Reptin的联系值得研究。
本研究为未来利用CoCl2构建肝癌MHCC97-H细胞缺氧相关模型奠定基础,并为探究肝癌中HIF2α和Reptin的关系提供了依据,然而由于条件有限,并未研究CoCl2浓度与MHCC97-H细胞间的剂量依赖关系。这也将是笔者后续的研究重点之一。
[参考文献]
[1] 杨鹏,滕红丽,罗雪兰,等. miR-24对肝癌MHCC97H细胞增殖、凋亡及迁移能力的影响[J].广西医科大学学报,2019,36(9):1397-1402.
[2] 胡维晟,潘伟滨,林海端,等.miR-497促进肝癌MHCC97L细胞增殖和迁移[J].海南医学院学报,2020,26(5):325-329.
[3] Allemani C,Mattsuday T,Di Carlo V,et al. Global surv-eillance of treends in cancer survival 2000-14(Kon-CORD-3):Analysis of individual recodes for 37 513 025 patients diagnosed with one of 18 cancers form 322pop-ulation-based registries in 71 contries[J].Lancet,2018, 391(10125):1023-1075.
[4] Yang JD, Heimbach JK. New advances in the diagnosis and management of hepatocellular carcinoma[J].BMJ,2020, 371: m3544.
[5] 夏勇,杨田,王葵.肝细胞癌肝切除术后复发预防和治疗中国专家共识(2020版)[J].中国实用外科杂志,2021, 41(1):20-30.
[6] 韩明,周军,魏海梁,等.肝癌术后转移复发的新型生物标志物的研究新进展[J].广西医科大学学报,2020,37(12): 2288-2294.
[7] 李志國,杨先照,李小科,等.缺氧微环境与肝病发生发展的关系[J].临床肝胆病杂志,2020,36(8):1891-1895.
[8] 覃小珊,张彩灵,黄赞松.肿瘤微环境对肝细胞癌血管生成的影响[J].世界华人消化杂志,2020,28(12): 493-500.
[9] 孟永斌,程彬彬,杜娟,等.缺氧促进肝细胞癌发生发展机制的研究进展[J].中国普通外科杂志,2020,29(1):97-103.
[10] 翁苓苓,高玲,张闽光.化学模拟肝癌体外缺氧模型的建立及对HIF-1α、VEGF基因的影响[J].肝脏,2019,24(9): 1049-1052.
[11] Rana NK, Singh P, Koch B. Simulated hypoxia induce cell proliferation and alter the expression pattern of hypoxia associated genes involved in angiogenesis and apoptosis[J].Biological Research, 2019, 52(1):12.
[12] 刘咏真,康静波,杜锐,等.缺氧诱导基因2诱导甘油三酯堆积稳态失衡促进肝癌发生的研究[J].转化医学杂志, 2020, 9(3):137-141,146.
[13] Colagrande S,Inghilesi AL,Aburas S,et al. Challenges of advanced hepatocellular carcinoma[J].World J Gastroen-tero, 2016, 22(34): 7645-7659.
[14] Albadari N, Deng S, Li W. The transcriptional factors HIF-1 and HIF-2 and their novel inhibitors in cancer therapy[J].Expert Opin Drug Discov,2019,4(7):667-682.
[15] Yoo Seung-Yeon, Yoo Ji-Young, Kim Han-Byeol, et al. Neuregulin-1 protects neuronal cells against damage due to -induced hypoxia by suppressing hypoxia-inducible factor-1α and P53 in SH-SY5Y cells[J]. International Neurourology Journal,2019,23(Suppl 2): S111-118.
[16] Menrad H,Werno C,Schmid T, et al. Roles of hypoxia-inducible factor-1alpha(HIF-1alpha) versus HIF-2alpha in the survival of hepatocellular tumor spheroids[J]. Hepatology, 2010, 51(6):2183-2192.
[17] Yang SL, Liu LP, Niu L, et al. Downregulation and pro-a poptotic effect of hypoxia-inducible factor 2 alpha in hepatocellular carcinoma[J].Oncotarget,2016,7(23):34571-34581.
[18] Raymond AA, Benhamouche S, Neaud V, et al. Reptin regulates DNA double strand breaks repair in human hepat-ocellular carcinoma[J].PLoS One,2015,10(4):e0123 333.
[19] Grigoletto A, Neaud V, Allain-Courtois N, et al. The ATPase activity of Reptin is required for its effects on tumor cell growth and viability in hepatocellular carcinoma[J].Mol Cancer Res 2013,11(2):133-139.
[20] Lee JS, Kim Y, Kim IS, et al. Negative regulation of hypoxic responses via induced Reptin methylation [J]. Mol Cell, 2010, 39(1):71-85.
(收稿日期:2021-08-22)
