宫内放置曼月乐对乳腺癌术后服用他莫昔芬患者子宫内膜的影响及安全性的Meta分析
2022-04-27邹妮倩许青青赵新月司徒红林
邹妮倩 许青青 赵新月 司徒红林
(1 广州中医药大学第二临床医学院,广东省广州市 510405,电子邮箱:20192110690@stu.gzucm.edu.cn;2 广东省中医院乳腺科,广州市 510120)
乳腺癌是严重威胁女性健康的恶性肿瘤,其发病率已跃居恶性肿瘤之首,成为全球第一大癌。其中激素受体阳性乳腺癌患者占70%,因此内分泌治疗是乳腺癌重要的治疗方式之一,其可降低激素受体阳性乳腺癌的复发风险[1]。他莫昔芬作为雌激素受体阳性乳腺癌患者术后辅助治疗最常用的内分泌治疗药物,对乳腺组织具有抗雌激素作用,而对骨骼、子宫等具有类雌激素作用[2-3]。子宫内膜在雌激素作用下会发生子宫内膜增生、子宫内膜息肉、子宫内膜萎缩及子宫内膜癌等病理改变。曼月乐,即左炔诺孕酮宫内缓释节育系统(levonorgestrel-releasing intrauterine system,LNG-IUS),其释放的左炔诺孕酮在内膜局部的浓度比外周血循环中高1 000倍[4];高浓度的左炔诺孕酮通过抑制雌激素受体、孕激素受体的合成,使得内膜对血循环的雌激素敏感性下降,从而发挥拮抗内膜增生的作用[5]。激素是影响乳腺癌发病的重要因素,曼月乐作为外源性的孕激素,其对接受他莫昔芬治疗的乳腺癌患者的保护作用和安全性仍不确定。本研究旨在评估宫内曼月乐对乳腺癌术后口服他莫昔芬的患者子宫内膜的影响及安全性,为该病的临床治疗提供参考。
1 资料与方法
1.1 文献检索 计算机检索中国知网、中国生物医学文献数据库、万方数据库、中文科技期刊全文数据库、PubMed、Embase、Web of Science、Cochrane Library,检索时限为各数据库建库至2021年6月25日。中文检索词包括乳腺癌、他莫昔芬、三苯氧胺、曼月乐、左炔诺孕酮宫内缓释系统、左炔诺孕酮宫内节育器及随机对照试验等;英文检索词为breast neoplasms、tamoxifen、levonorgestrel及其各自的自由词,以及randomized controlled trial、controlled clinical trial、randomized等。
1.2 文献纳入标准与标准
1.2.1 纳入标准:(1)研究类型为临床随机对照试验;(2)研究对象为经病理证实为乳腺癌且需口服他莫昔芬辅助治疗的女性患者,年龄、种族、语言不限;(3)试验组的干预措施为口服他莫昔芬治疗联合宫内放置曼月乐,对照组为单纯口服他莫昔芬治疗;(4)结局指标为子宫内膜增生率、子宫内膜息肉发生率、子宫肌瘤发生率、异常阴道出血率、乳腺癌复发率及乳腺癌相关病死率。
1.2.2 排除标准:(1)回顾性研究;(2)会议及科技成果类文献、病例报告、综述和Meta分析等论述类文献;(3)动物试验、基础试验;(4)无法找到全文的文献;(5)重复发表的文献,重复文献仅保留信息最全的一篇。
1.3 文献筛选、资料提取与质量评价 由2名研究员浏览文献的题目、摘要及全文,按照纳入标准和排除标准独立筛选文献、提取数据并进行核对。意见分歧时双方进行讨论,若仍无法达成一致时则由第3名研究者决定。提取的数据包括文献发表年份、作者、随访时间、干预措施、样本量、结局指标。纳入文献采用Cochrane Handbook中提供的ROB评价标准,从随机序列产生、随机方案分配隐藏、对受试者及干预者施盲、对结局评价者施盲、结局数据完整性、选择性报告结果、其他偏倚7个方面进行文献偏倚评价。
1.4 统计学分析 采用RevMan 5.4.1软件对提取数据进行Meta分析。二分类变量以比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)作为效应指标。采用Q检验和I2检验进行异质性检验,若P>0.1且I2<50%,则认为各研究间的同质性较好,采用固定效应模型进行分析;反之则表明各研究间存在异质性,重新核查确认数据无误后,进行亚组分析和敏感性分析明确异质性来源,如仍然无法明确异质性来源时,改用随机效应模型进行合并分析。Meta分析以P≤0.05为差异具有统计学意义。
2 结 果
2.1 文献检索结果及基本特征 初步检索共检出文献1 324篇,其中重复文献480篇。阅读文献标题及摘要后剔除804篇,阅读全文后剔除28篇,最终纳入文献12篇[6-17]。具体筛选流程见图1,文献的基本特征见表1。

图1 文献筛选流程及结果
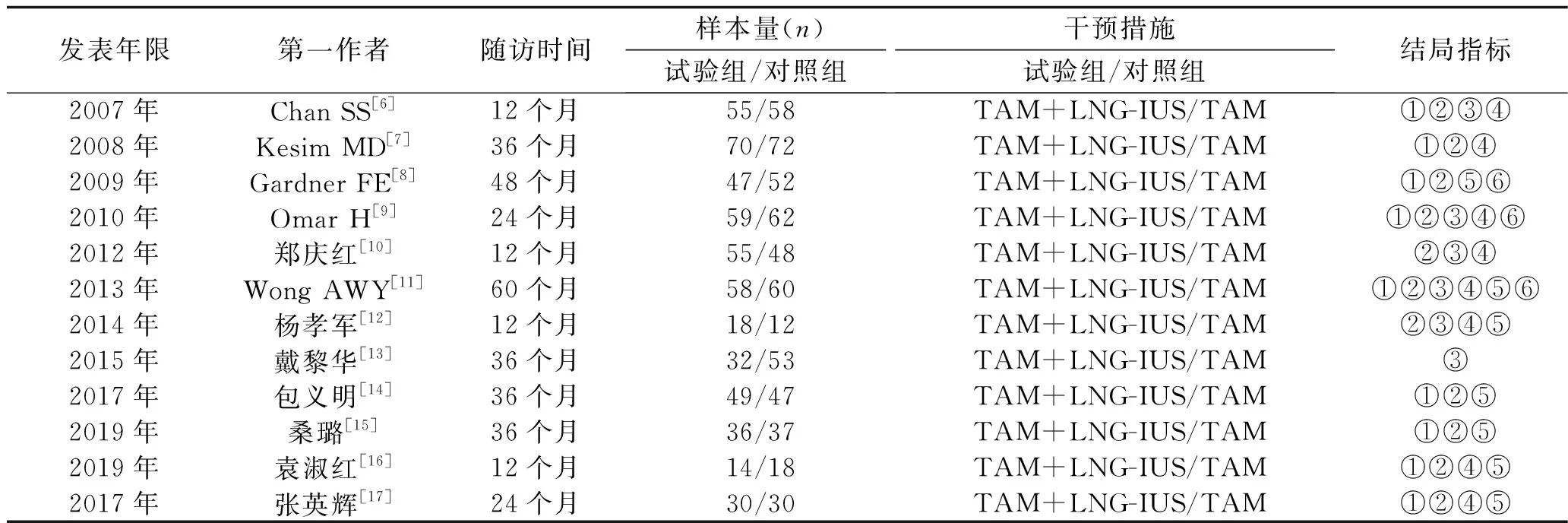
表1 纳入文献的基本特征
2.2 纳入文献的质量评价结果 12篇文献中,3篇文献[12-13,17]采用随机数字表法、1篇文献[15]采用计算机随机生成序列、5篇文献[6-9,11]采用密封信封法进行分组,随机分配方法评估均为低风险;另外3篇文献[10,14,16]仅提及随机分组未提及具体随机方法,故评估为不确定风险。7篇文献[10,12-17]均未提及分配隐藏,评估为不确定风险;5篇文献[6-9,11]采用密封信封法,故评估为低风险。各项研究的干预措施差异明显,难以对研究者及受试者实施盲法,但结局受盲法的影响较小,故均评估为低风险。5篇文献[6-7,9,11-12]的结局指标实施盲法,评估为低风险;7篇文献[8,10,13-17]未提及结局指标实施盲法,评估为不确定风险。5篇文献[10,12-13,16-17]无失访及退出情况,评估为低风险,其余7篇文献均报告了失访及退出人数,但未详细报告失访及退出原因,评估为不确定风险。所有文献均报告了相关结局指标,故均评估为低风险。质量评价表见图2、图3。
2.3 Meta分析结果
2.3.1 子宫内膜增生率:共有9篇文献[6-9,11,14-17]分析了子宫内膜增生率,共包含854例患者,其中试验组418例、对照组436例。异质性检验结果显示各研究间同质性较好(P=0.99,I2=0%),故使用固定效应模型进行分析。结果显示,试验组子宫内膜增生发生率低于对照组[OR=0.23(95%CI:0.11,0.49),P<0.001]。见图4。

图2 文献偏倚风险条形图(绿色为低风险,黄色为不确定风险)

图3 偏倚风险汇总图

图4 试验组与对照组子宫内膜增生率的Meta分析森林图
2.3.2 子宫内膜息肉发生率:共有10项研究[6-12,15-17]分析了子宫内膜息肉发生率,根据随访时间的长短,可分为随访12个月、24~60个月两个亚组进行分析。其中,随访12个月组纳入6项研究[6,8,10,12,15-16]共450例患者,试验组及对照组均为225例;随访24~60个月组纳入4项研究[7,9,11,17]共441例患者,其中试验组217例、对照组224例。异质性检验结果显示,随访12个月组、随访24~60个月组各研究的同质性均较好(P=0.80,I2=0%;P=0.73,I2=0%),故均采用固定效应模型进行分析。结果显示,随访12个月时[OR=0.15(95%CI:0.07,0.35),P<0.001]、随访24~60个月时[OR=0.15(95%CI:0.07,0.32),P<0.001],试验组子宫内膜增生率均低于对照组。见图5。

图5 试验组与对照组子宫内膜息肉发生率的Meta分析森林图
2.3.3 异常阴道出血发生率:共有8项研究[6-7,9-12,16-17]分析了异常阴道出血发生率,根据不同研究随访时间的长短,可分为随访6个月、12个月及24个月3个亚组。随访6个月组纳入6项研究,共480例患者,其中试验组242例、对照组238例;随访12个月组纳入8项研究,共719例患者,其中试验组359例、对照组360例;随访24个月组纳入2项研究,共181例患者,其中试验组89例、对照组92例。随访6个月、12个月及24个月3个亚组的异质性检验结果均提示各研究间的同质性较好(P=0.73,I2=0%;P=0.18,I2=34%;P=0.89,I2=0%),故均采用固定效应模型进行分析。结果显示,随访6个月[OR=14.56(95%CI:6.47,32.77),P<0.001]、随访12个月[OR=4.32(95%CI:2.48,7.54),P<0.001],试验组的异常阴道出血发生率均高于对照组,差异均具有统计学意义;随访24个月,试验组的异常阴道出血发生率高于对照组,但差异无统计学意义[OR=3.84(95%CI:0.90,16.26),P=0.07]。见图6。

图6 试验组与对照组异常阴道出血发生率的Meta分析森林图
2.3.4 子宫肌瘤发生率:共有6项研究[6,9-13]分析了子宫肌瘤发生率,共纳入570例患者,其中试验组277例、对照组293例。异质性检验结果显示各研究间的同质性较好(P=1.00,I2=0%),故采用固定效应模型进行分析。结果显示,试验组与对照组子宫肌瘤发生率的差异无统计学意义[OR=0.49(95%CI:0.17,1.47),P=0.20]。见图7。
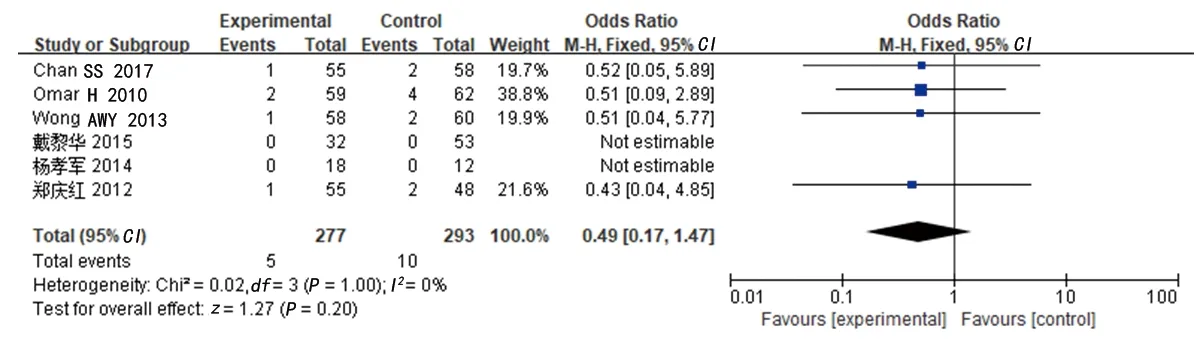
图7 试验组与对照组子宫肌瘤发生率的Meta分析森林图
2.3.5 乳腺癌复发率:共有7项研究[8,11-12,14-17]分析了乳腺癌复发率,共纳入508例患者,其中试验组252例、对照组256例。异质性检验结果显示各研究间的同质性较好(P=0.73,I2=0%),故采用固定效应模型进行分析。结果显示试验组与对照组的乳腺癌复发率差异无统计学意义[OR=1.75(95%CI:0.64,4.80),P=0.28]。见图8。
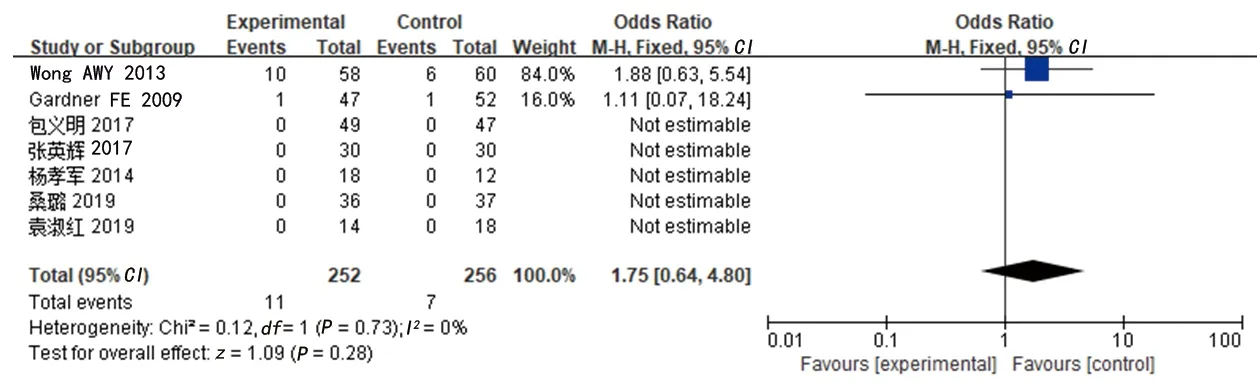
图8 试验组与对照组乳腺癌复发率的Meta分析森林图
2.3.6 乳腺癌相关病死率:共有3项研究[8-9,11]分析了乳腺癌相关死亡率,共纳入338例患者,其中试验组164例、对照组174例。异质性检验结果显示各研究间的同质性较好(P=0.76,I2=0%),故采用固定效应模型进行分析。结果显示试验组与对照组的乳腺癌相关病死率差异无统计学意义[OR=1.06(95%CI:0.39,2.83),P=0.91]。见图9。
图9 试验组与对照组乳腺癌相关死亡率的Meta分析森林图
3 讨 论
乳腺癌是女性最常见的癌症,术后5年辅助内分泌治疗可降低肿瘤复发、远处转移、对侧乳腺癌发生率及激素受体阳性乳腺癌的相关病死率[18]。选择性雌激素受体调节剂是乳腺癌患者,尤其是绝经前乳腺癌患者内分泌治疗的主要药物之一[19]。他莫昔芬是乳腺癌治疗中最常用的选择性雌激素受体调节剂类药物。他莫昔芬治疗5年可使雌激素受体阳性的乳腺癌年病死率降低31%,对侧乳腺癌发生风险降低约50%[20-21]。他莫昔芬在乳腺组织中的抗雌激素特性和在其他组织(骨、子宫等)中的类雌激素特性,使得服用他莫昔芬的乳腺癌女性获益的同时,也导致了一定的潜在风险。他莫昔芬对骨骼具有类雌激素作用,研究表明绝经后女性长期服用他莫昔芬可增加躯干骨的骨密度,同时也有利于维持外周骨骨密度处于稳定状态[22],而绝经前使用他莫昔芬则会对抗内源性雌激素的潜在活性从而降低骨密度[23]。还有研究结果显示,他莫昔芬辅助治疗增加会血栓事件的发生,且与使用他莫昔芬治疗5年相比,延长他莫昔芬治疗时间会使肺栓塞的发生概率增加[24-25]。他莫昔芬的类雌激素作用可使子宫内膜增厚,同时增加子宫内膜增生、子宫内膜息肉、卵巢囊肿及子宫内膜癌的发生率[26]。研究显示,采用他莫昔芬治疗的子宫内膜癌、畸胎瘤、卵巢癌患者的病死率高于采用阿那曲唑治疗的患者[27]。
LNG-IUS置入宫腔后,在宫腔内持续释放的左炔诺孕酮使子宫内膜腺体萎缩并出现间质蜕膜样改变,且可通过负调节雌激素受体阻断雌激素作用,从而使子宫内膜萎缩变薄,抑制子宫内膜增生,减少子宫内膜病变[28]。一项研究显示,乳腺癌术后服用他莫昔芬治疗的患者采用LNG-IUS治疗后1年,子宫内膜表现出蜕膜化的组织学特征,且存在蜕膜化标记物胰岛素样生长因子结合蛋白1,表明LNG-IUS可通过引起子宫内膜蜕膜化从而保护子宫内膜[29]。但LNG-IUS放置术后半年内,由于左炔诺孕酮的释放未达稳态,宫腔局部药物浓度高、血管脆性增加容易出现阴道异常出血,且单一孕激素治疗可因缺乏雌激素修复而导致阴道流血时间较长[30]。乳腺癌内分泌治疗均以雌激素受体蛋白为靶点,而孕激素受体并不作为治疗靶点,但目前越来越多的证据表明孕激素受体信号转导对乳腺癌的发展起着重要作用,提示其或可作为预防治疗的靶点[31]。一项研究显示,单独使用雌激素的正常女性发生乳腺癌的风险每年增加约1%,而使用雌激素+孕激素的正常女性发生乳腺癌的风险每年约增加80%[32]。因此,曼月乐作为一种外源性的孕激素是否会与孕激素受体结合,从而增加乳腺癌发病风险,目前仍需要进一步的流行病学研究来评估。
本研究共纳入12篇文献,共1 072例乳腺癌患者,Meta分析结果显示,与单纯口服他莫昔芬治疗相比,乳腺癌术后口服他莫昔芬联合宫内放置曼月乐可以降低子宫内膜增生和子宫内膜息肉的发生率,但增加异常阴道出血发生率,这与Roberts等[33]的研究结果相似。本研究结果还显示,子宫肌瘤发生率、乳腺癌复发率及乳腺癌相关病死率与是否放置曼月乐无关,但尚不能完全排除上述指标与曼月乐之间的因果关系,因此乳腺癌患者放置曼月乐的安全性仍未确定。一项回顾性研究结果显示,LNG-IUS使用者乳腺癌的复发率为21.5%,单纯使用他莫昔芬者乳腺癌的复发率为16.6%[RR=1.86(95%CI:0.86,4.00),P>0.05],提示使用LNG-IUS并未增加乳腺癌的复发率[34],与本研究结果相似。然而,根据世界卫生组织意见,乳腺癌患者使用曼月乐存在不可接受的健康风险,而对于5年内有乳腺癌病史的患者,放置曼月乐的风险大于收益[35]。
综上所述,与单纯口服他莫昔芬治疗相比,乳腺癌术后口服他莫昔芬同时宫内放置曼月乐可降低患者子宫内膜增生率和子宫内膜息肉的发生率,但会提高阴道异常出血率,而对子宫肌瘤发生率、乳腺癌复发率及乳腺癌相关死亡率可能无明显影响。本研究存在一定局限性:(1)分析各结局指标的文献均不足10篇,数量较少导致检验效能不足,难以通过漏斗图进行发表偏倚分析。(2)所纳入的研究中,部分研究未进行分配隐藏,干预措施差异明显,难以对研究者及受试者实施盲法,可能存在选择、实施偏倚;部分研究对失访及退出原因描述不详细;样本量均较小且随访时间有限,在一定程度上影响结果可信度。因此,今后还需更多高质量、大样本的临床研究进一步验证本研究结论。
