城市河道底泥中微生物组成及其转化氮、硫污染物的潜力*
2022-04-27张肖静位登辉张红丽马冰冰
张肖静 位登辉 张红丽 马冰冰 张 涵
(郑州轻工业大学材料与化学工程学院,河南 郑州 450002)
城市河道是城市生态系统的重要组成部分,承担着提供水源、防洪排涝、调节气候、降低环境污染的重要任务[1-2]。然而,近年来随着城市及工业的快速发展,大量污染物进入城市河道引起水体黑臭现象,严重影响了城市发展和人居生活[3],[4]1331。国内外学者对河道黑臭问题进行了大量研究。结果表明,氮、硫是进入城市河道的主要污染物,也是导致水体黑臭、破坏河道生态环境的首要原因[4]1331,[5]。
自国务院公布《水污染防治行动计划》要求2030年彻底消除黑臭水体以来,全国各地广泛开展的整治工作取得了显著成效,河道污染负荷大幅度削减,黑臭现象逐步改善。然而,目前虽然大部分外源污染输入得到了有效控制,河道中累积的内源污染物依然没有得到彻底消除,并不断向水体释放,底泥由污染物的“汇”转变为“源”[6-8],底泥内源氮和硫成为水体氮、硫污染的主要来源,并影响到河道中的氮、硫转化过程[9-11]。底泥中含有大量微生物,积极参与着河道系统的氮、硫循环。因此,明晰城市河道底泥的微生物组成特征,以及各种氮、硫转化过程的潜力,有助于明确污染物削减方法及底泥修复强化手段,对于彻底解决城市河道黑臭问题至关重要。
本研究以淮河流域某城市河道为研究对象,在了解其污染物分布特征的基础上,分析了底泥中的微生物组成,并基于氮、硫转化相关微生物的分布,分别测定了厌氧氨氧化、硫酸盐还原氨氧化、异养反硝化、硫自养反硝化和硫酸盐还原等氮、硫转化过程的潜力,以期为城市河道的氮、硫循环理论提供支撑,从而进一步确定城市河道的生态修复策略。
1 材料与方法
1.1 城市河道底泥概况
所选河道沿程有污水排入,所选区域段全长10.4 km,河道中主要污染物为氨氮、硝酸盐氮、硫酸盐、有机物等,河道沿岸均有居民,生活污水均未经处理直接排入河流,导致河道常年黑臭。在该段河道沿河水流向设置了5个采样点,采样点位分布具体情况见本课题组之前研究[12]52。采用底泥采样器采集表层5 cm以下的底泥样品,带回实验室,分别用于微生物测序和污染物转化速率测定。高通量测序由生工生物工程(上海)股份有限公司在Miseq平台上完成,聚合酶链式反应(PCR)扩增引物为341F/805R,得到的序列与Silva数据库进行比对。
1.2 转化速率测定方法
对夏季5个采样点的泥样分别进行厌氧氨氧化、反硝化、硫酸盐还原等过程的潜在转化速率测定。所有转化速率测定实验均设置空白对照(CK1和CK2),其中CK1加相同质量的底泥,配水以纯水代替,以观察底泥内源污染物的释放情况;CK2只加配水,不添加底泥,以观察在无底泥的情况下污染物是否能转化。5个采样点的底泥分别标为1#~5#,各实验均进行3次,取平均值分析。
以厌氧氨氧化为例,具体步骤:取适量泥样离心后,先用蒸馏水清洗3遍,再分别取3.0 g湿泥样(干质量约1.8 g)放入多个10 mL离心管内,加入无氧水至10 mL,在暗处培养48 h。清洗并离心,弃去上清液,加入含有氨氮和亚硝酸盐氮的配水,150 r/min下振荡培养,模拟河道的自然波动。配水中基质浓度根据河水水质和实验数据确定。根据之前的研究报道,河道上覆水、间隙水中氨氮平均值分别为23.0、173.7 mg/L[12]54,因此底泥接触的氨氮为23.0~173.7 mg/L。此外,实验室长期运行的序批式厌氧氨氧化反应器证实,其最佳进水氨氮约为100 mg/L,考虑到该反应器换水比为66%(体积分数),微生物接触到的初始基质质量浓度约为66 mg/L。因此,厌氧氨氧化测定实验中,设置氨氮为66.0 mg/L。转化速率按照式(1)计算。所有反应的配水中加入0.672 g/L NaHCO3、0.033 g/L KH2PO4、0.200 g/L MgSO4·7H2O、0.300 g/LCaCl2和微生物所需的微量元素。各转化速率的配水方案见表1。
(1)
式中:v为转化速率,mg/(g·h);c0、c1为反应前、后的污染物质量浓度,mg/L;m为底泥干质量,g;t为反应时间,h;Q为反应液体积,L。
1.3 分析方法
氨氮采用纳氏试剂分光光度法测定,亚硝酸盐氮采用N-1-萘基乙二胺分光光度法测定,硝酸盐氮采用紫外分光光度法测定,硫酸盐采用铬酸钡分光光度法测定[13];硫化物按照《水质 硫化物的测定 亚甲基蓝分光光度法》(HJ 122—2021)测定。以上采用分光光度计(TU-1810)测定。COD采用COD快速消解及水质测定仪(WWC-PC02)测定。为避免误差,所有实验均进行3次,并取平均值分析。
2 结果与讨论
2.1 底泥中的主要微生物
在门水平,相对丰度占优势的前10种微生物分别为变形菌门(Proteobacteria)、绿湾菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、Patescibacteria、芽单胞菌门(Rokubacteria)、Epsilonbacteraeota和疣微菌门(Verrucomicrobia),相对丰度见表2。不同采样点的微生物分布差异较大,但优势微生物在各采样点同时存在。其中,变形菌门在5个采样点中均占有绝对优势地位,相对丰度为30%左右。多种脱氮相关的微生物,如好氧氨氧化菌、硝化菌和一些反硝化菌均属于变形菌门,能同时转化氮、硫的脱氮硫杆菌也属于变形菌门[14],其较高的丰度预示着底泥中存在丰富的氮循环过程。相对丰度占据第二的绿湾菌门常存在于污泥菌胶团絮状体内部,并以絮体骨架的形式存在,这为底泥的团聚结构提供了骨架支撑。第三优势微生物为拟杆菌门,该菌门具有非常强的营养代谢能力,如复杂有机物、蛋白质和脂类等,并具有水解污泥絮体的作用。厚壁菌门则可能与有机物的降解有关。值得注意的是,不同采样点的底泥样品中均检测到浮霉菌门,相对丰度为1.8%~7.3%,浮霉菌门中最具代表性的微生物为厌氧氨氧化菌,由此推测该河道底泥具有厌氧氨氧化的潜力。此外,多项研究证明,一些能同时转化氨氮和硫酸盐的硫酸盐还原氨氧化菌隶属于疣微菌门[15-16],该菌门同样被检测到,因此底泥中也可能存在硫酸盐型的厌氧氨氧化作用或具备其潜力。疣微菌门相对丰度(0.2%~1.0%)较小,这预示着硫酸盐还原氨氧化在河道底泥氮、硫循环中的贡献度较小。
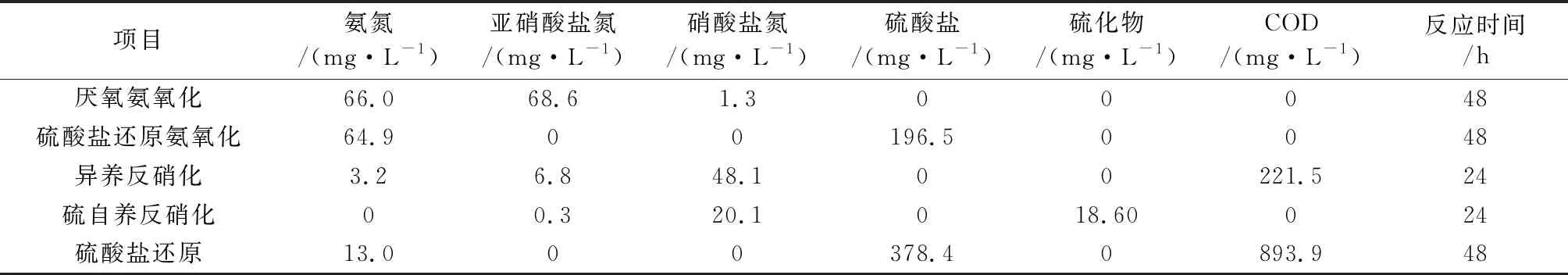
表1 各转化速率的配水方案Table 1 Water distribution scheme for each conversion rate
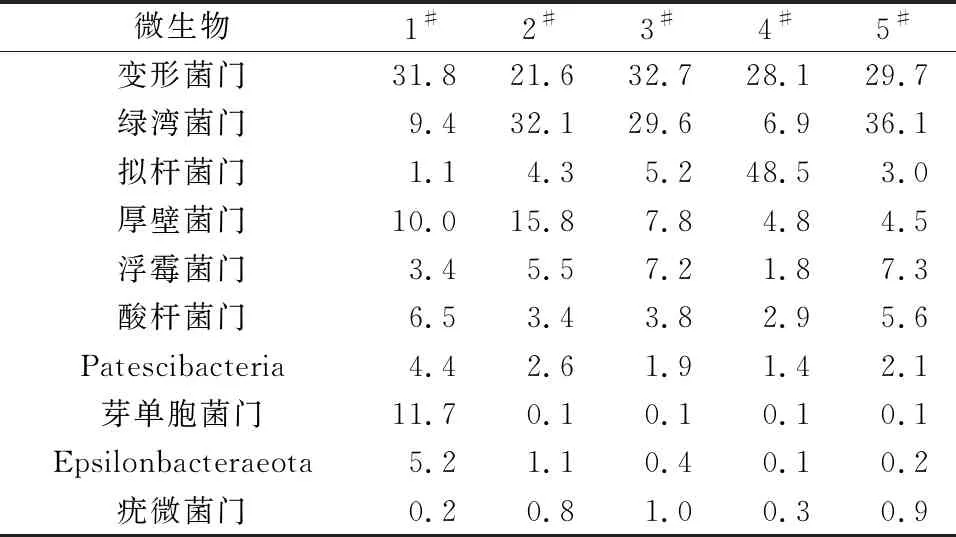
表2 河道底泥中优势微生物(门水平)的相对丰度Table 2 Relative abundance of dominant microorganisms (phylum level) in river sediment %
微生物测序结果表明,河道底泥中存在与异养反硝化、硫自养反硝化、厌氧氨氧化及硫酸盐还原氨氧化等脱氮过程相关的微生物,因此分别对这几个过程的反应潜力进行了测定及分析。
2.2 河道底泥的反硝化潜力
反硝化包括异养和自养反硝化[17],其中硫自养反硝化可将氮、硫污染物同步转化,本研究分别测定了异养和硫自养反硝化的潜力,结果见图1。异养反硝化配水中,硝酸盐氮、亚硝酸盐氮、COD分别为48.1、6.8、221.5 mg/L。经过24 h反应后,CK1的硝酸盐氮、亚硝酸盐氮、COD分别为1.2、0.4、13.9 mg/L,一般认为纯水COD极低,但CK1中COD稍微升高,可能是由于纯水中杂质或测样过程所带来的误差。CK2的硝酸盐氮、亚硝酸盐氮、COD分别为47.2、5.2、228.6 mg/L,与配水相差不大,其中亚硝酸盐氮从6.8 mg/L降低到5.2 mg/L,说明亚硝酸盐氮不如硝酸盐氮稳定,在空气中发生了微量的转变;硝酸盐氮比配水仅下降了0.9 mg/L,说明在无底泥时不能发生反硝化反应。CK1和CK2均满足空白对照的要求。5个采样点底泥中,硝酸盐氮均大幅度降低,其中4#和5#的硝酸盐氮和亚硝酸盐氮均很低,几乎完全转化,反硝化过程进行得较彻底。1#~3#的硝酸盐氮稍多,2#同时剩余亚硝酸盐氮,说明其反硝化不够彻底。采样点底泥对COD的降解较快,剩余COD为18.4~30.5 mg/L。经计算,采样点的硝酸盐氮、总氮、COD平均转化速率分别为0.009 2、0.010 8、0.045 5 mg/(g·h),COD去除与总氮去除的质量比为4.2。在反硝化过程中,每转化1 g硝酸盐氮需要消耗2.86 g COD,而每还原1 g亚硝酸盐氮需要消耗1.71 g COD。由此可知,底泥消耗的COD并不仅是通过反硝化去除的,有一部分可能是通过异养菌氧化分解。由底泥微生物组成可知,底泥中存在较多的好氧异养菌,可利用氧气将COD氧化分解,这也是导致城市河道中DO较低的原因[4]1333。
图1 异养和硫自养反硝化污染物转化情况Fig.1 Conversion of pollutants in heterotrophic denitrification and sulfur-autotrophic denitrification
对于硫自养反硝化过程,CK1的结果正常,但CK2中硫化物在经过24 h振荡后降低为7.3 mg/L,这说明硫化物在空气中即可被氧化,损失率大于50%,该现象在之前的研究[18-19]中也有报道。基于此进行了验证实验,发现硫化物溶液在空气中暴露一段时间后有白色沉淀生成,推测其被氧化为单质硫,而单质硫可进一步被氧化为硫酸盐,也可直接被自养反硝化菌利用。经过24 h反应后,1#~5#采样点的硫化物分别降低至0.25、0.43、0.74、0.14、0 mg/L;硝酸盐氮降低为12.0~14.4 mg/L,没有亚硝酸盐氮积累,说明硝酸盐氮全部被转化为氮气排放。硝酸盐氮、总氮的平均转化速率均为0.001 5 mg/(g·h),说明总氮的去除主要是通过硝酸盐氮还原完成。硫化物的平均转化速率为0.004 2 mg/(g·h),但这里面包括硫化物被氧化的部分。根据报道,硫化物与硝酸盐反应转化为硫酸盐的摩尔比为0.625,单质硫与硝酸盐反应转化为硫酸盐的摩尔比为1.1[20-22]。而本研究消耗的硫化物与硝酸盐的平均摩尔比为1.27,远大于上述两个比例。这说明,配水中一部分硫化物被直接氧化为硫酸盐,并未参与硝酸盐氮的还原。反应后出水中硫酸盐约增加了50 mg/L(约0.52 mol),而配水中的硫化物则为0.58 mol,这些结果证明硫化物最终都被转化为硫酸盐。若以CK2中硫化物浓度作为初始浓度计算硫化物的消耗量,则其与硝酸盐氮消耗量的摩尔比为0.50,因此推测部分硫化物被空气氧化成单质硫后,进一步被反硝化菌利用。该结果证明了河道底泥具备硫自养反硝化的潜力,然而异养、硫自养反硝化的总氮平均转化速率分别为0.010 8、0.001 5 mg/(g·h),说明底泥中以异养反硝化为主。硫自养反硝化在底泥内源污染物降解方面具有较好的应用前景[23],对修复黑臭河道具有重要的意义。若要实现硫化物和硝酸盐的同步去除,则需要进一步强化硫自养反硝化过程,这是今后值得关注的重点问题。此外,河道底泥中是否存在其他转化硫化物的过程,仍然需要进一步的深入研究。
无论是异养还是硫自养反硝化,采样点之间的总氮去除速率相差不多,这说明在同一条河道中,即使微生物的相对丰度存在差异,但对于主要污染物的转化潜力相差不大。在河流系统的氮循环中,不仅反硝化起着重要的作用,厌氧氨氧化也有重要的贡献,因此进一步测定了底泥的厌氧氨氧化潜力。
2.3 河道底泥的厌氧氨氧化潜力
厌氧氨氧化(亚硝酸盐型)和硫酸盐还原氨氧化(硫酸盐型)的测定结果见图2。测定厌氧氨氧化潜力的3次实验中,不同采样点底泥对污染物的转化有一定差异,尤其是4#和5#采样点的氨氮消耗较少、亚硝酸盐氮消耗较多,这有可能是发生了内源反硝化。反硝化菌利用内源碳源(如溶解性微生物产物等),可将一部分亚硝酸盐氮还原为氮气[24]。2#和3#采样点则出现了较明显的硝酸盐氮增加,虽然厌氧氨氧化反应同样会生成部分硝酸盐氮,但比例较小,因此推测是由于底泥中存在硝化菌,将部分氨氮氧化为硝酸盐氮,同时也反过来提高了氨氮转化速率。但总体而言,各采样点的氨氮转化速率分布较均匀,平均转化速率为0.003 2 mg/(g·h);亚硝酸盐氮转化速率的差异较大,平均转化速率为0.004 0 mg/(g·h);总氮平均转化速率为0.007 1 mg/(g·h),约为氨氮和亚硝酸盐氮的平均转化速率之和,这说明总氮的去除是通过氨氮和亚硝酸盐氮的共同转化而实现的。值得注意的是,采样点的亚硝酸盐氮与氨氮的平均转化速率比为1.25,无限接近厌氧氨氧化的理论比值1.32[25]。这个结果可证实该底泥具备厌氧氨氧化的潜力,氨氮和亚硝酸盐氮主要由厌氧氨氧化反应去除。据报道,厌氧氨氧化对河流生态系统中氮素脱除的贡献率最高达到38.7%~81.6%[26-28],而本研究也同样证实了其对河道底泥氮循环的重要性。

图2 不同厌氧氨氧化途径污染物转化情况Fig.2 Conversion of pollutants in different anaerobic ammonia oxidation pathways
测定硫酸盐还原氨氧化潜力的实验中,5个采样点氨氮和硫酸盐的转化速率相差不大,说明底泥中此类微生物的分布较均匀,采样点污泥中出现了不同程度的亚硝酸盐氮积累,这可能是由于氨氮被氧化导致的。氨氮、总氮、硫酸盐平均转化速率分别为0.002 5、0.002 0、0.006 9 mg/(g·h)。总氮平均转化速率小于氨氮,这是由于底泥中一部分氨氮被好氧氨氧化菌氧化,生成了微量的亚硝酸盐氮或硝酸盐氮,没有直接通过硫酸盐还原氨氧化作用转化为氮气。氨氮与硫酸盐转化量摩尔比约为2.48,非常接近硫酸盐还原氨氧化的理论比值2[29]。证实了底泥具备硫酸盐还原氨氧化的潜力,存在同时将氨氮和硫酸盐去除的可能性。
厌氧和硫酸盐还原氨氧化的总氮平均转化速率分别为0.007 1、0.002 0 mg/(g·h),说明亚硝酸盐型的厌氧氨氧化潜力远大于硫酸盐型。硫酸盐还原氨氧化可同时转化氨氮和硫酸盐[30-31],在河道底泥修复中具有广阔的应用前景,可进一步增强诱导硫酸盐还原氨氧化菌的活性,来实现底泥中氮、硫污染物的削减。
2.4 河道底泥的硫酸盐还原潜力
硫循环积极参与着河流生态系统的氮循环,除厌氧氨氧化和反硝化过程对河道底泥氮循环有重要的贡献外,硫酸盐还原过程由于将硫酸盐还原为硫化氢,产生硫化物进而被自养反硝化菌利用,因而也间接参与到河道底泥的氮循环过程。硫酸盐还原过程污染物转化情况见图3。配水的氨氮、硫酸盐、COD分别为13.0、378.4、893.9 mg/L。经过48 h反应后,CK1的硫酸盐、COD分别为7.3、74.1 mg/L,CK2则分别为371.1、898.4 mg/L,符合空白对照的要求。5个采样点出水的COD和硫酸盐均较接近,相差不大,氨氮几乎完全被降解。氨氮、硫酸盐、COD平均转化速率分别为0.001 2、0.020 9、0.056 5 mg/(g·h)。硫酸盐换算为硫元素,硫元素平均转化速率则为0.007 0 mg/(g·h),大于硫化物参与自养反硝化的转化速率。由此推测,如果河道底泥中硫酸盐被还原为硫化物,则可进一步参与到基于硫自养反硝化的氮、硫共循环体系中。
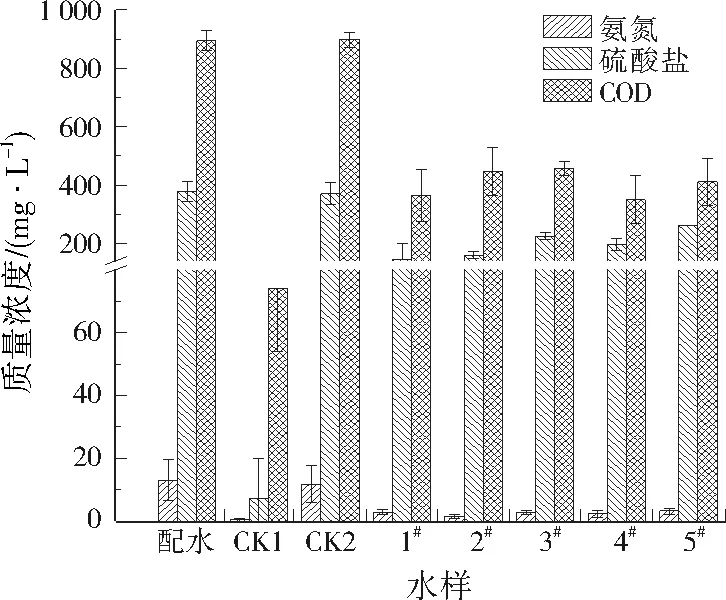
图3 硫酸盐还原过程污染物转化情况Fig.3 Conversion of pollutants in sulfate reduction process
2.5 河道底泥中的氮、硫转化途径及应用前景
氮、硫污染物共存是城市河道中不容忽视的问题,也是导致水体黑臭的主要原因。尤其是底泥内源氮、硫的释放,更是对其同步去除提出了要求。异养反硝化、硫自养反硝化、厌氧氨氧化、硫酸盐还原氨氧化的总氮平均转化速率分别为0.010 8、0.001 5、0.007 1、0.002 0 mg/(g·h),这些过程对总氮转化的贡献分别为50.5%、7.0%、33.2%、9.3%,说明底泥中的氮去除主要以异养反硝化为主,其次为厌氧氨氧化。硫酸盐还原氨氧化和硫自养反硝化这两种有硫参与的脱氮过程对氮循环的贡献率较低。此外,硫自养反硝化的硫化物、硫酸盐还原氨氧化的硫酸盐、硫酸盐还原的硫酸盐的平均转化速率为0.004 2、0.006 9、0.020 9 mg/(g·h),后两者换算为硫元素的平均转化速率分别为0.002 3、0.007 0 mg/(g·h),可见河道底泥中的硫转化以硫酸盐还原为主,其次为硫自养反硝化。
研究中涉及的几种氮、硫转化途径可互相耦合。一方面,厌氧氨氧化菌将氨氮、亚硝酸盐氮转化为氮气、部分硝酸盐氮,硫自养反硝化菌则可将这部分硝酸盐氮还原,产生的中间产物亚硝酸盐氮可被厌氧氨氧化菌利用,或进一步转化为氮气排放。另一方面,硫化物被氧化为单质硫,或进一步转化为硫酸盐后被硫酸盐还原氨氧化菌利用,该菌又将硫酸盐转化为单质硫。单质硫沉淀于底泥中,也可进一步参与自养反硝化,从而形成了氮、硫共循环。然而,该河道底泥中硫酸盐还原氨氧化和硫自养反硝化的潜力均较小,因此如要彻底解决城市河道污染问题,需要进一步强化硫酸盐还原氨氧化或硫自养反硝化的潜力,从而促进氮、硫污染物的高效转化。
3 结 论
(1) 该城市河道底泥中微生物以变形菌门为主,相对丰度为30%左右,同时包含与氮、硫循环密切相关的浮霉菌门、疣微菌门等。
(2) 该河道底泥具有反硝化、厌氧氨氧化、硫酸盐还原等氮、硫转化的潜力。异养反硝化、硫自养反硝化、厌氧氨氧化、硫酸盐还原氨氧化的总氮平均转化速率分别为0.010 8、0.001 5、0.007 1、0.002 0 mg/(g·h),这些过程对总氮转化的贡献分别为50.5%、7.0%、33.2%、9.3%。
(3) 有待进一步强化底泥硫酸盐还原氨氧化或硫自养反硝化的潜力,从而促进氮、硫污染物的高效转化。
