中美现行药典无菌检查法比对
2022-04-27李玉立江志杰刘文杰张光华
李玉立,江志杰,刘文杰,张光华
(北京市药品检验研究院·北京市疫苗检验中心·国家药品监督管理局仿制药研究与评价重点实验室·中药成分分析与生物评价北京市重点实验室,北京 102206)
无菌检查法是针对无菌工艺产品和最终灭菌产品的无菌性而建立的检查法,1936 年版《美国药典》第十一章开始引用单个培养基的直接接种法进行无菌检查,1953年版《中国药典》收载了“药品的灭菌检查法”[1]。鉴于《中国药典》无菌检查法与国际通用标准在检查理念、培养体系、方法要求等诸多方面存在显著差异,《中国药典》于2015年版开始借鉴国外药典先进技术经验,以新的控制理念为指导,在检测范围及环境要求、培养体系、方法适用性等方面作了较大修订,逐步与国际通用标准一致[2]。2020 年版《中国药典(四部)》参考人用药品注册技术要求国际协调会(ICH)协调案和相关国内外标准,结合我国医药产业实际情况和技术进步要求,进一步细化了无菌检查法的通用性和规范性要求,明确了环境监控的范围,修订了培养基的保存和使用时限及无菌检查法的关键操作步骤等[3-4],从而使该版《中国药典(四部)》的无菌检查法[5]与ICH 协调案框架下的《美国药典》《欧洲药典》《英国药典》《日本药典》进一步接轨。由于以上4 部国外药典已通过ICH 完成协调,主要技术基本一致,因此,现仅以网络最新(截至发稿时)版《美国药典·国家处方集》(USP-NF2021)无菌检查法所载内容及要求为参考,并将2020年版《中国药典(四部)》与之进行比对,为相关从业人员无菌操作及质量控制等工作提供借鉴。
1 USP-NF2021 无菌检查法主要内容
USP-NF2021 通则<71>无菌检查法章节及主要内容见表1,表中注1~注14 为与2020 年版《中国药典(四部)》存在差异的版块,后续进行详细比对。

表1 USP-NF2021无菌检查法主要内容Tab.1 Main contents of sterility test methods in USP-NF2021
2 中美现行药典比对
2.1 方法的差异
2020年版《中国药典(四部)》与USP-NF2021无菌检查法方法的差异见表2。

表2 中美现行药典无菌检查法方法差异Tab.2 Differences of sterility test methods between Chinese Pharmacopeia and United States Pharmacopeia
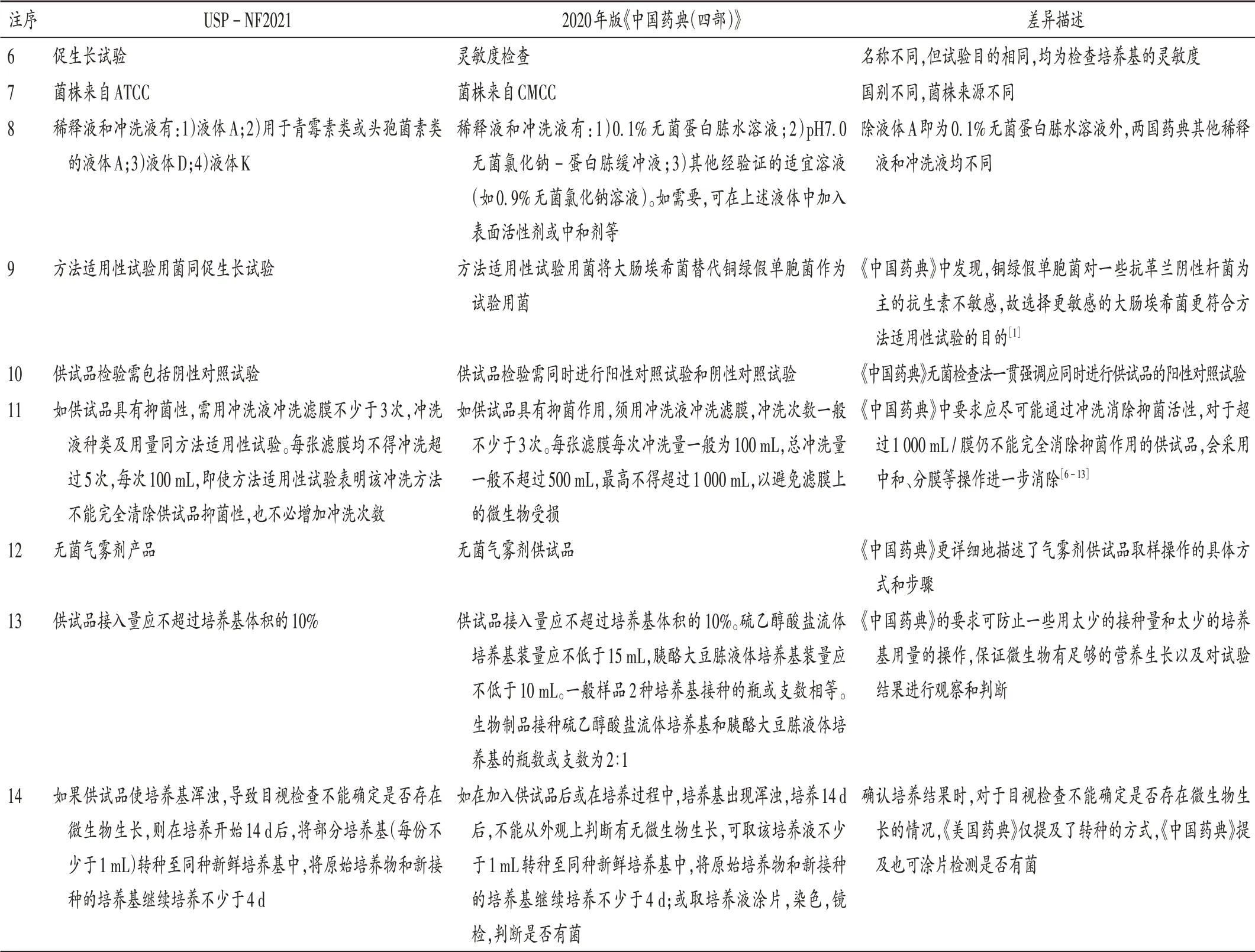
续表2 中美现行药典无菌检查法方法差异Continued Tab.2 Differences of sterility test methods between Chinese Pharmacopeia and United States Pharmacopeia
2.2 要求的差异
阳性对照试验:USP-NF2021 规定,在方法验证时进行阳性对照试验,常规检验仅求阴性对照试验,未明确要求进行阳性对照试验;2020 年版《中国药典(四部)》要求每批次检验时均需进行阳性对照试验。USPNF2021 认为,通过方法适用性试验即可确认该产品无菌检查方法符合要求,后续常规检验中无须每批次进行阳性对照确认,定期进行确认即可。2020 年版《中国药典(四部)》则规定,应同时进行供试品的阳性对照试验。通过对成品每次无菌检验的阳性试验的确认,其作用相当于一次现时的、小规模的培养基灵敏度检查和方法适用性试验[1],更有助于确认试验条件的符合性和检验结果的准确性。
方法适用性试验:USP - NF2021 要求,对于有抑菌性的供试品,冲洗不超过5 次,试验菌不生长即认为“不污染”,认可供试品的抑菌性对试验菌的抑制作用。2020 年版《中国药典(四部)》则要求,对于有抑菌性的供试品,必须通过增加冲洗次数及加入中和剂等方法去除供试品的抑菌性,使对应试验菌生长。USP - NF2021 认可供试品的抑菌性可抑制对应试验菌,2020 年版《中国药典(四部)》则要求去除供试品的抑菌性以确保抑菌性对潜在其他敏感菌抑制,更注重全面的无菌状态监测。这种差异可能与国内外医药工业体系的成熟度相关,2020 年版《中国药典(四部)》的要求可以更全面地监控产品真实无菌状态。
小剂量注射剂无菌检查[14]:USP - NF2021 不要求对小剂量注射剂进行稀释,而是直接进行薄膜过滤培养。国内对小剂量注射剂的无菌检查均采用0.9%无菌氯化钠溶液等进行稀释后进行薄膜过滤培养。由于国外药典常规检验不进行阳性对照,每批样品冲洗到2个薄膜上进行培养,国内每批样品需进行阳性对照试验,每批样品需冲洗到3个薄膜上进行培养,为了确保每个薄膜样品的一致性,需对小剂量注射剂进行稀释,以使3 个薄膜上的供试品具有较好的均一性,以确保阳性对照试验结果的可靠性。
3 药典无菌检查法修订建议
USP-NF2021与2020年版《中国药典(四部)》的无菌检查部分均未规定冲洗时的流速,基于长期试验操作的经验积累,过快的冲洗流速会损伤微生物,从而导致检验结果不能反映供试品真实的无菌状态。因此,建议未来修订本国药典时,增加对冲洗流速的相关要求,以更准确地体现产品真实的无菌状态。
