壳聚糖及其衍生物在生物医学领域的应用研究进展*
2022-04-27秦晓飞
陈 浩,秦晓飞,冯 昆
(遵义医科大学珠海校区,广东 珠海 519090)
甲壳素是自然界中仅次于纤维素的第二大生物活性多糖,不溶于有机溶剂,具有高度有序的结晶化结构及较低化学活性[1]。甲壳素最早由法国化学家Henri 于1811 年提出,源于希腊语单词“chiton”,意为覆盖、涵盖之意,其基本单元是N- 乙酰氨基-D- 葡萄糖,由β-1,4糖苷键连接[2]。虽然在自然界中含量丰富,但水不溶性极大地限制了其应用。壳聚糖是甲壳素的脱乙酰化产物(常把脱乙酰度大于40%的甲壳素称为壳聚糖,商业中售卖的壳聚糖脱乙酰化程度为70%~90%)[3],具有良好的生物相容性、生物降解性、亲水性、无毒无害性、抗氧化性及与离子、染料结合的性质,可作为抗菌剂、药物载体、组织工程材料等广泛使用。目前多数文献侧重于对壳聚糖单一的修饰或应用,关于壳聚糖的完整报道较少。在此对壳聚糖的来源、修饰改性、生物医学应用进行总结,旨在为后续研究提供参考。
1 壳聚糖的来源
全球每年产生6 × 109~8 × 109kg 虾蟹壳[4],但利用并不充分,不仅造成了资源浪费,也带来环境污染[5]。甲壳动物壳中甲壳素的含量为15%~40%[6],如能得到充分利用,将带来巨大的经济效益和社会效益。
目前,关于自然界中直接获得壳聚糖的报道较少,还有待发掘。渔业废弃物虾蟹壳、鱼鳞等是目前壳聚糖的主要来源[1,7],大多数昆虫(如甲虫、蝗虫、蚕和食虫)及真菌灵芝菌、植物唐菖蒲等中均含有甲壳素。近年来壳聚糖的各种生物来源及其表征方法见表1(表中,FT-IR 为傅里叶变换红外光谱法,XRD 为X 射线衍射法,TGA为热重分析法,DSC为差示扫描量热法,DTA为差示热分析法,SEM 为扫描电镜法,EDS 为X 射线能谱分析法,NMR为核磁共振法)。
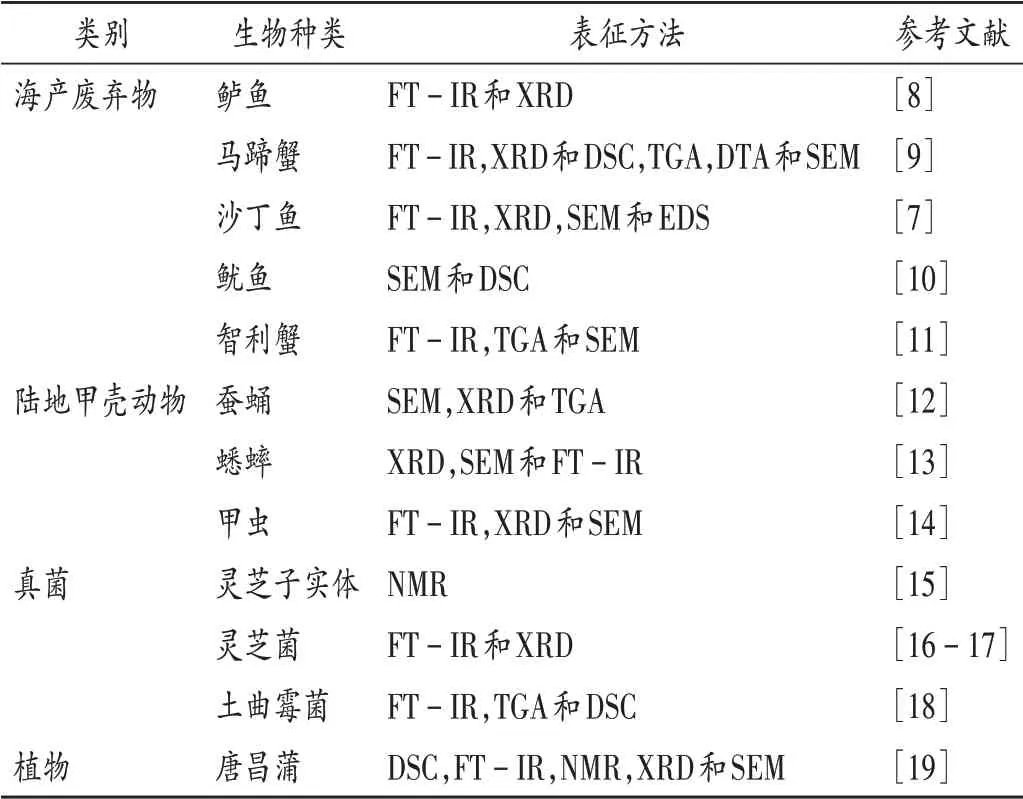
表1 壳聚糖的来源及表征方法Tab.1 Sources and characterization methods of chitosan
海产废弃物利用率低,所致环境污染问题严重。利用海产废弃物生产壳聚糖不仅能减少资源浪费,提高经济效益,还能保护环境,是目前壳聚糖的主要来源[3]。此外,陆地甲壳动物的外骨骼、真菌及部分植物也是壳聚糖的重要来源,且不同来源的壳聚糖的理化性质不尽相同,应用方式也存在差异,更多的壳聚糖来源还有待发现。
2 壳聚糖的修饰改性
2.1 理论基础
壳聚糖为线性阳离子多糖,呈白色片状或粉末状固体,无毒,不溶于普通有机溶剂。甲壳素脱乙酰化后使壳聚糖分子中含有游离的氨基,故壳聚糖能溶于酸性水溶液,且有阳离子特性,能与聚阳离子相互作用,形成聚电解质的配合物[8]。壳聚糖的脱乙酰化程度越高,分子链中氨基的质子化程度越高,溶解越容易,壳聚糖的相对分子质量越大,其聚合物链内和分子间氢键就越多,分子间相互纠缠,难以溶解[20]。壳聚糖中存在α,β 和γ 3种不同的晶体结构,与甲壳素的晶体结构相同。
尽管壳聚糖来源广泛,但其自身固有理化性质也限制了对其的利用,故对其修饰改性必不可少[21],壳聚糖独特的结构为其修饰改性提供了丰富的思路。壳聚糖结构中存在3个活性基团:C—2位的氨基、C—3位的初级羟基和C—6位的次级羟基,初级羟基空间位阻较小可自由旋转,而次级羟基空间位阻较大,不能转动[20]。因此3 个活性基团的活跃顺序为氨基> 初级羟基>次级羟基[22]。壳聚糖可在氨基和羟基上进行酰化、烷基化、羧化、四元化、接枝共聚等化学改性和物理改性。通过对壳聚糖进行物理化学修饰,以获得具有更好的溶解度、生物相容性、抑菌活性及其他活性优异的衍生物,同时还能改善壳聚糖的热稳定性、流变性和抗氧化性等。
2.2 常见方法
2.2.1 化学方法
酰化:壳聚糖的酰化是指壳聚糖与有机酸及其衍生物发生反应,在分子链上引入脂肪基团或芳香基团[23]。酰化是壳聚糖最常见的修饰方法,能破坏其分子内和分子间的氢键,降低结晶度,提高水溶性。与氨基发生酰化形成酰胺的反应称为N-酰化,当C—2位存在保护基团时,酰化反应发生在C— 6 位的羟基上,这称为O-酰化。O-酰化壳聚糖破坏了壳聚糖的氢键结构,提高了壳聚糖的脂溶性和疏水性,而使其可溶解于吡啶、氯仿等有机溶剂中[24]。O-酰化壳聚糖常见于高分子材料的薄膜中,可以提高材料的疏水性和稳定性。N- 酰化壳聚糖衍生物具有良好的生物相容性、抗凝血性和血液相容性,且不会引起机体的炎性反应[25]。N-酰化壳聚糖的溶解度取决于取代度和侧链长度。研究表明,当取代度小于50%时,壳聚糖的取代度越大,溶解度也越大,且其侧链越长,结晶度越高,溶解度越低[26]。N-酰化壳聚糖的溶解度较高,故可作为疏水性药物的载体;结晶度较高,能提高纤维韧性和热稳定性,故可用于制备聚氯乙烯纤维薄膜材料[25]。壳聚糖的酰化改性通常用来提高其溶解度,增加与材料结合的能力。
烷基化:原理与酰基化相同,均为破坏壳聚糖的氢键以提高其溶解度[27]。不同的是,烷基为疏水基团,其溶解度在引入过长的烷基时不增反减,表明壳聚糖烷基化衍生物的溶解度可通过调节烷基的长度来控制[28]。在壳聚糖的3 个活性位点中,C — 2 位的基团具有很强的亲核孤对电子,因此更易发生N- 烷基化反应。WEI 等[29]设计并合成了一系列以6-O-氯代乙酰壳聚糖为原料的壳聚糖衍生物,发现随着烷基链的延长,季铵盐壳聚糖衍生物对真菌的抗菌性能下降。壳聚糖烷基化衍生物还能用于药物传递载体材料和制备生物膜等。壳聚糖的N-烷基化反应,不仅改变了自身的溶解度,也改变了壳聚糖的活性。
羧化:主要利用氯代链烷酸或乙醛酸与壳聚糖基上C—2位的氨基或C—6位的羟基发生反应,生成含羧基的壳聚糖[30],以此来提高壳聚糖的溶解性、保湿性和成膜性,扩大壳聚糖的应用范围。目前,壳聚糖的羧化反应多以羧甲基化的形式进行。C—6位的羟基最易取代,其次是C — 3 位的羟基,难度最大的是C— 2 位的氨基。N- 羧甲基化、O- 羧甲基化或N,O- 羧甲基化壳聚糖可通过不同的反应条件和试剂制备[31]。O- 羧甲基化壳聚糖反应在一氯乙酸和氢氧化钠的存在下,以异丙醇/ 水为溶剂,在室温或冰浴中发生。N- 羧甲基化和N,O- 羧甲基化主要发生在温度升高时。N-羧甲基化和N,N-羧甲基化可通过壳聚糖与乙醛酸反应,并使用氰基硼氢化钠还原制备[32]。壳聚糖的羧化反应是大多数壳聚糖修饰的第一步,且较易发生,从而提高其活性。
四元化:壳聚糖中含游离氨基,故可制备为季铵盐衍生物。壳聚糖季铵化的方法主要有直接季铵盐取代法、N-烷基化法和环氧衍生物开环法,均是在氨基上引入具有较大的空间位阻及较强亲水性的季铵盐基团。因此,四元化的壳聚糖溶解度明显提高[33]。季铵盐壳聚糖衍生物还具有良好的生物相容性、生物降解性、抗菌性能、无毒性,以及优秀的黏附性能和穿透黏液层与上皮结合的能力,在生物医学、能源等方面广泛应用。
接枝共聚:壳聚糖分子中前述3个活性基团均可作为接枝反应位点,与酚类化合物、聚醚链、烷基链等结合后,引入相应基团[34]。当通过化学改性引入各种侧链时,位点特异性的定量引入成为难点,而壳聚糖3 个位点的反应活性差异很小,反应产物的分离纯化也很困难,限制了壳聚糖的应用[35]。因此,合适的反应试剂、温和的反应条件和高效的分离方法已成为壳聚糖接枝改性的研究热点。常用的引发剂有过硫酸钾、过硫酸铵、硝酸铈铵、硫酸亚铁铵等。ORTIZ 等[36]以硝酸铈铵为引发剂,制备了马来酸琼脂糖乙烯基接枝共聚物,提高了产物的含氮量。
其他:壳聚糖修饰改性的其他化学方法还有酯化、硫醇化、羟基烷基化、磺化等[37]。壳聚糖的改性均是围绕壳聚糖的溶解度、与材料的结合能力、生物活性进行修饰,期望得到活性更高、应用范围广泛、安全无毒的壳聚糖衍生物。
2.2.2 物理方法
目前主要使用化学方法对壳聚糖改性,但随着研究的深入,其物理改性方法也越发受到重视。例如,机械研磨可产生高度均匀的纳米结构材料,可优化材料的力学性能[38];辐照主要用于引发接枝共聚,比化学方法简单,且无须催化剂的参与[39];超声可有效破坏多糖聚合物的分子间或分子内氢键,使得聚合物断裂,分子量降低。物理改性过程中无有毒试剂参与,最大优势是安全无毒。
2.2.3 酶法
酶法反应条件温和,且能避免化学试剂的使用[40]。
3 壳聚糖及其衍生物的应用
3.1 抑菌剂
壳聚糖由于自身优秀的抗菌性能、来源广、产率高等优势,被认为是理想的抗菌材料。目前关于其糖抗菌机制[20](图1)有以下推论:1)作为螯合剂,选择性地结合金属离子,抑制微量元素和营养素的吸收,从而抑制毒素的产生和微生物的生长;2)活化结合细胞壁成分,使细菌因细胞壁分解而死亡;3)所带正电荷能与带负电荷的微生物细胞膜相互作用,导致细菌生物膜破裂,引发蛋白质等细胞成分外泄,导致细菌死亡;4)进入微生物细胞核中与DNA 相结合,干扰和抑制蛋白质的合成[20,41]。
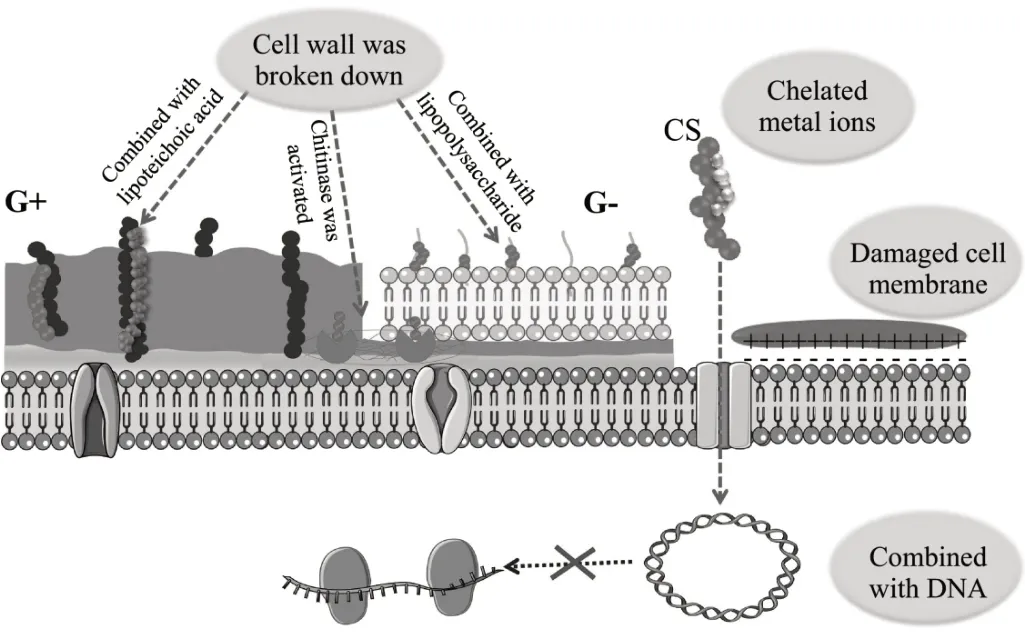
图1 壳聚糖的抑菌机制Fig.1 Antibacterial mechanism of chitosan
中性或碱性壳聚糖悬浮液的抑菌活性低于酸性壳聚糖溶液。壳聚糖的最佳抑菌pH 为6.0,且随壳聚糖脱乙酰化程度的增加而增大[42]。与低分子壳聚糖一样,高分子壳聚糖的抑菌活性也是由其分子侧链在酸性溶液中氨基质子化和阳离子化而产生的,其长分子链有利于包覆和结合细菌,间接提高了抗菌活性,细菌首先被壳聚糖抑制,然后细胞壁逐渐断裂和分解,导致细胞死亡[43]。壳聚糖中的电荷密度也是影响抗菌活性的关键因素,这和壳聚糖与细菌细胞膜脂质双层电荷表面的强静电作用有关[44]。YAN 等[45]制备的新型壳聚糖衍生物显示出对大肠杆菌和金黄色葡萄球菌的良好抑菌活性,能破坏细胞膜的完整性,同时也证明壳聚糖能降低细胞表面的疏水性、细胞活力和细胞内蛋白表达。
壳聚糖及其衍生物抗菌活性好,被广泛应用于制备抗菌材料、组织工程材料等。壳聚糖支架材料正是研究的热点之一。壳聚糖及其衍生物因其抗菌活性也被制备为各种制剂如纳米粒、薄膜、水凝胶、复合敷料等[46]。ALQAHTANI 等[47]用离子凝胶法制备了壳聚糖纳米粒,表现出对淋球菌的抑菌活性,同时对HeLa细胞无明显的细胞毒作用,具有治疗淋病的潜力。
抗菌剂是目前壳聚糖应用的研究热点之一(见表2)。关于壳聚糖抑菌剂的研究较多,但大多停留在实验室阶段,实际应用还有待进一步研究。

表2 壳聚糖及其衍生物的抑菌作用Tab.2 Antibacterial function of chitosan and its derivatives
3.2 药物载体
利用最新的纳米技术开发聚合物给药系统在医药领域引起关注。壳聚糖是一种很有前途的天然聚合物[65],可用于纳米给药系统。壳聚糖具有抑菌作用、杀菌作用、止血性、抗溃疡、抗炎、抗氧化、抗糖尿病和神经保护作用,其结构与胶原相似,可用于模拟细胞外基质[66]。以壳聚糖为基础的药物递送系统,可用于蛋白质/肽、生长因子、抗炎药、抗生素、抗癌药物、疫苗[67]等的传递,也可用于基因治疗[68]。
壳聚糖的一个重要特点是其黏附力强,原因是聚合物链上带正电荷的氨基与富含唾液酸和磺酸的带负电荷的黏蛋白残基之间的静电相互作用[69]。壳聚糖基纳米载体具有体积小、比表面积大、黏附性能好等优点,能促进药物进入细胞,增强药物稳定性,实现药物的控释、缓释或降低药物的细胞毒性[70-71]。壳聚糖无论是单用还是作为复合材料使用,均适合于制备不同类型的载药制剂,如纳米粒、水凝胶、复合材料、微球、创面材料等[72-73],相关研究进展见表3。壳聚糖基药物载体有缓释控释作用,间接提高了药效,同时还具有靶向性及提高黏附能力的特性。
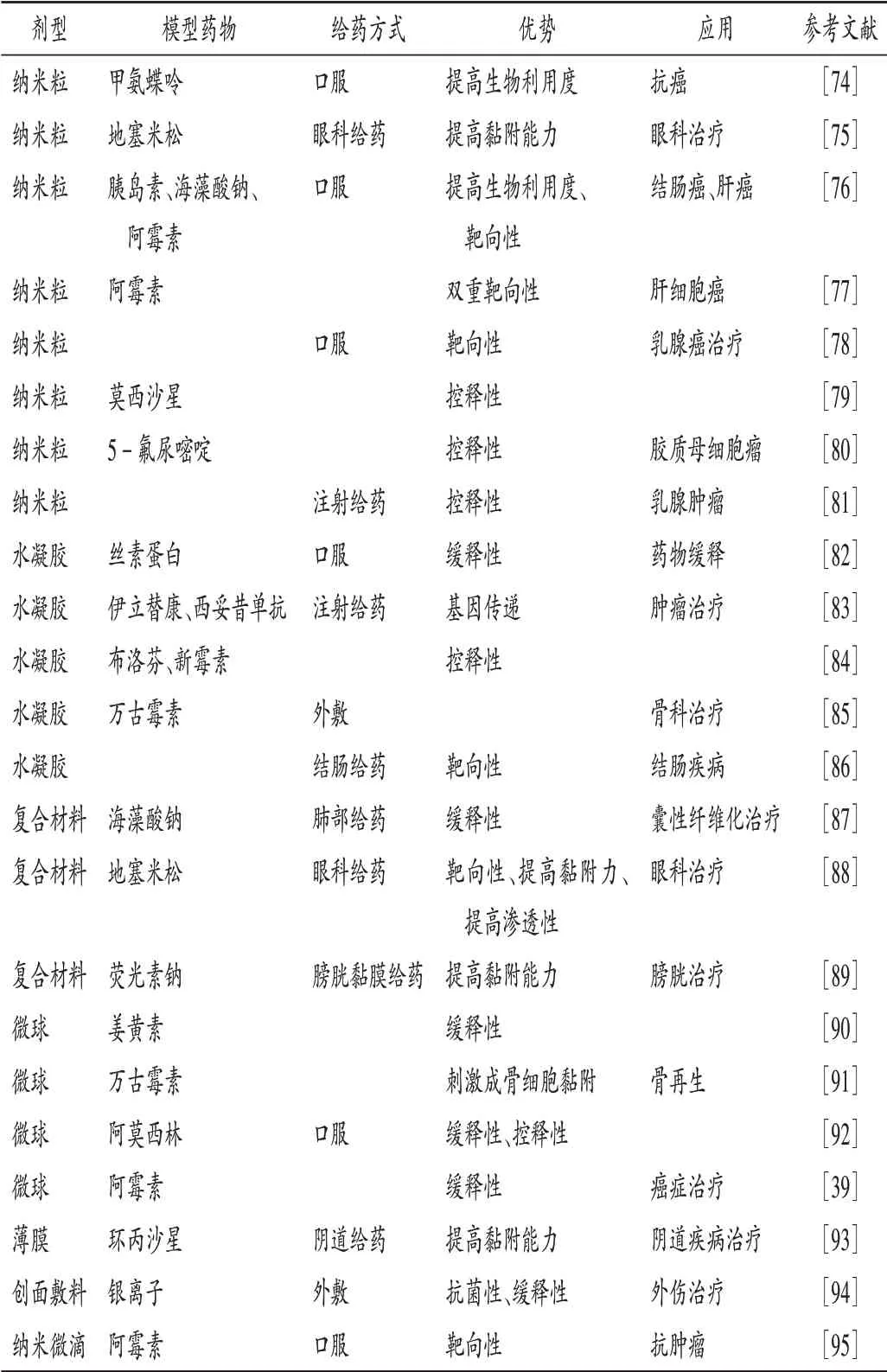
表3 壳聚糖载药制剂研究进展Tab.3 Research progress of chitosan drug loaded preparations
3.3 组织工程材料
生物材料在组织工程中的研究越发深入。生物工程材料是在金属或高分子材料的基础上形成不同的结构,并能引起特定组织的特定反应,因此它们需要有良好的物理、生物和力学性能[96]。壳聚糖基材料不仅具有良好的生物相容性和生物可降解性,还具有能形成不同结构、与多种生物活性材料结合等优异性能,是理想的生物活性材料[97]。目前壳聚糖基组织工程材料主要应用于软骨组织工程、骨组织工程、椎间盘组织工程、血管组织工程、角膜再生、皮肤组织工程、牙周组织工程等[98]。壳聚糖基组织工程材料在皮肤、血管、角膜、骨等组织和器官中的应用,预示着其在修复、固定和再生方面的应用前景。但相互作用过程机制研究较少,形成的复合物结构复杂程度不够,还有待更深入的研究。
MAHARJAN 等[99]将再生纤维素纳米纤维引入壳聚糖水凝胶制备了再生纤维/ 壳聚糖复合支架,结果表明,该支架有更高的抗压强度,能增强前成骨细胞活性、附着能力和增殖能力,具有良好的成骨分化能力。SHAABANI 等[100]开发了一种新型亲水性半导电壳聚糖衍生物,将其作为新型成骨剂,表现出良好的形状记忆性能和形状恢复率,有良好的自愈合价值。这些多功能工程材料均为组织工程中有广泛应用前途的生物材料。
4 结语
甲壳素与壳聚糖在自然界中含量丰富,深受人们的关注。目前,壳聚糖的主要来源仍是海产废弃物,如虾蟹壳等。同时,人们也致力于开发壳聚糖的其他来源,如陆地甲壳动物的外骨骼、蚕茧及真菌和植物来源,但此部分研究有待进一步开展。壳聚糖的修饰改性主要以其溶解性、药理活性、抑菌活性及与材料结合的能力作为改性方向,旨在扩大壳聚糖的应用范围。壳聚糖作为抑菌剂、药物载体和组织工程材料得到广泛使用,但在生物医学应用中的机制探索层次较浅,复杂程度较低,要实现实际应用还需更深入地研究。
