基于CT影像组学评估射频消融术治疗晚期肺腺癌疗效
2022-04-27魏雅萍
刘 涵 方 桦 魏雅萍
首都医科大学附属复兴医院肿瘤科(北京 100038)
肺癌是全球最常见的癌症之一,且发病率及死亡率均位居世界首位。肺癌有不同类型,其中非小细胞肺癌比较常见,占比约为83%[1]。肺腺癌是非小细胞肺癌的主要组织学亚型,主要通过淋巴及血行转移传播[2]。目前,肺癌治疗主要措施是外科手术,但临床上大部分肺腺癌患者在首次确诊时已为晚期或发生转移,临床治疗效果及预后均较差。射频消融术(radio frequency ablation,RFA)是近年来兴起的微创治疗新技术,主要治疗中晚期或因各种原因无法手术的原发性或转移性肺癌,其安全性和有效性得到广大临床医生和患者的肯定[3]。目前临床上主要通过CT检查进行肺癌诊断,但该方法仍无法准确及时对肿瘤治疗疗效进行预测评价。影像组学主要是利用相关软件对影像学影像进行更进一步挖掘,将肉眼不可见的图像信息转换为可见的计算机信息,并结合诊断医师的主观诊断,进行高通量运算,从而获取更有价值的影像学信息[4]。本研究使用影像组学技术,获取CT图像的纹理特征,建立影像组学模型,探讨该模型对RFA治疗晚期肺腺癌疗效的评估价值。
1 资料与方法
1.1 病例资料收集我院2016年6月至2019年5月期间收治的80例晚期肺腺癌患者为研究对象。
纳入标准:病理分型为肺腺癌,肿瘤分期Ⅲ期~Ⅳ期;单侧肺病灶数小于3个,且病灶3~6cm;美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分≤2分,预期生存>3个月。排除标准:(1)全身感染性疾病或其他部位原发性肿瘤患者;凝血功能障碍或肝肾功能异常患者;严重高血压、肺心病、糖尿病等慢性疾病患者。本研究已经我院伦理委员会批准,患者及家属知情同意,并签署同意书。
1.2 患者基线资料记录患者性别、年龄、身体质量指数(body mass index,BMI)、吸烟史及舒张压(diastolic blood pressure,DBP)、收缩压(systolic blood pressure,SBP)和心率(heart rate,HR)等一般临床资料。
1.3 RFA治疗所有患者术前4h禁食、禁水。给予患者吸氧、心电监护、贴电极片。CT扫描并进行三维重建,显示病变部位和周围组织关系。根据事先测得的角度和方向迅速将射频针置于病变部位,操作时避开肋骨、大血管与肺大泡。射频针进入,针尖处于最佳位置,推下射频针尾端,再次扫描电极在病灶中所处位置,调整电极到适当位置,杀死肿瘤生长最活跃的边缘部分。开始消融。一般消融温度设定为90℃,并依据病灶大小设定消融时间。消融后,观察患者情况,并进行CT复查,明确患者是否存在气胸、出血等并发症。
1.4 疗效评定及分组根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)[5]评价患者疗效。具体评定标准见表1。

表1 疗效评定
将完全缓解和部分缓解病例纳入缓解组(40例),病情稳定和病情进展的病例纳入未缓解组(40例)。
1.5 影像资料
1.5.1 获取图像 使用西门子64层螺旋CT扫描仪对所有受试对象进行平扫。选取RFA术前的CT检查图像,使用ITKSNAP(version 3.6.0,来源:http://www.itksnap.org)分割肺腺癌感兴趣区,避开坏死囊变区,选择病灶最大层面,勾画时距离病灶边缘约5mm。为确保肿块勾画一致性,首先由1名主治医师(A)分割病灶2次,再由另一名副主任医师(B)确认1次,2名医师均有8年以上胸部影像诊断经验。
1.5.2 影像特征提取 分割感兴趣区后,为了提高纹理特征计算的速度并降低噪音干扰,以1mm×1mm×1mm规格对图像进行重采样,并调整图像灰度值到64个灰阶。然后使用AK(analysis-Kit,GE healthcare)分割图像中的病灶,获取游长矩阵特征(run Length,RL)和灰度共生矩阵(gray level cooccurrence matrix,GLCM)等定量影像组学特征。GLCM表示CT图像上灰度值的分布。RL表示每个游程中包含点数数量。每个病灶提取出396个二维特征。由于每例受试者有3个感兴趣区,同样每例受试者有3组特征值。
1.5.3 影像组学特征筛选及分析 将所有受试者按照比例7∶3分为验证组和训练组,利用训练组进行特征筛选并构建模型,再使用验证组对模型进行验证。观测者内与观测者间均进行一致性检验以保证影像组学特征的重复性。计算A勾画的两次感兴趣区提取的特征之间的组内相关系数(interclass correlation coefficient,ICC)以及A第一次勾画与B勾画的感兴趣区提取的特征之间的(ICC),保留ICC>0.75的特征,并选择A第一次勾画感兴趣区提取的体征用于后续分析。使用Spearman相关分析,剔除ICC>0.9的特征。然后通过套索方法(the least absolute shrinkage and selection operator method,LASSO)对剩余的特征降维,筛选LASSO模型误差最小的超参数λ,利用系数不为0的特征计算影像组学评分(radscore)。Radscore为特征与对应系数乘积之和。
1.5.4 决策曲线(decision curve analysis,DCA) 本研究通过DCA方法计算阈值范围来评估建立的诊断预后模型。计算公式如下:

其中a-c表示未进行有效治疗的结果,即与真实阳性结果相比,假阴性结果造成的伤害。d-b表示不必要治疗的影响。Pt表示预期收益等于预期治疗效果。
1.6 统计学方法利用R软件(version 3.5.1)进行统计分析及作图;计数资料和计量资料分别以百分比和(±s)表示,组间比较分别使用χ2检验和独立样本t检验。利用wilcoxon检验分析不同分类及不同集合之间的纹理特征。利用方差分析及LASSO降维对缓解组和未缓解组提取的纹理特征进行分析,获得组间显著纹理特征,通过受试者工作特征曲线(receiver operating characteristic curve,ROC)评价验证组和训练组的评估效能。P<0.05表示差异具有统计学意义。
2 结 果
2.1 基本资料缓解组和未缓解组的基本资料差异均无统计学意义(P>0.05),说明2组间患者的基线资料不存在影响后续试验结果的重要因素,具有可比性,见表2。
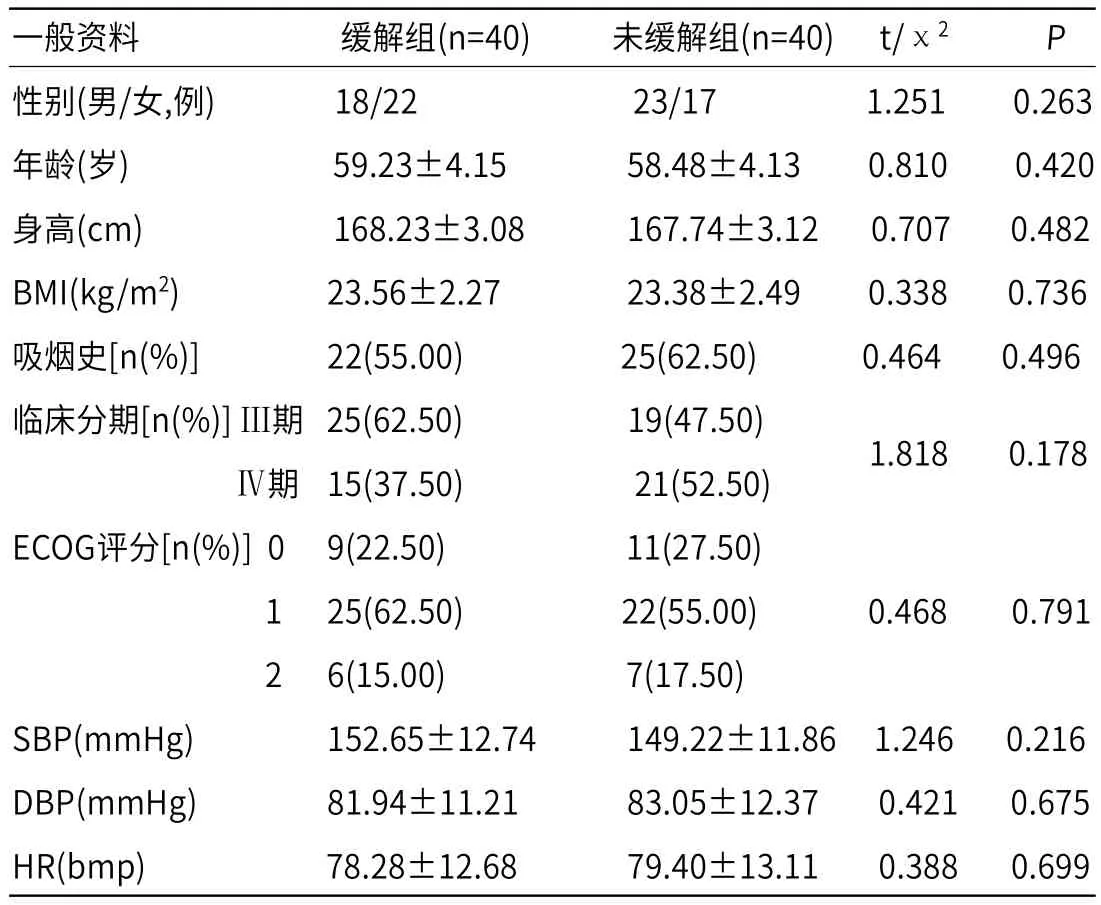
表2 基本资料
2.2 影像组学特征的一致性检验基于医师A两次测量的组内ICC值为0.812~0.951,基于医师A第一次测量和医师B之间的组间ICC值为0.794~0.934,提示特征提取在组内和组间有较高的一致性。
2.3 影像组学模型构建缓解组和未缓解组患者数量以smote过采样技术进行平衡,以7∶3比例将所有受试者分为训练组和验证组,其中训练组(56例)包括缓解组和未缓解组患者各28例,验证组(24例)包括缓解组和未缓解组患者各12例。去冗余后,使用LASSO建模,获得最简单模型lambda值,LASSO选择变量,最终从396个影像组学特征中选出12个具有显著预测价值的特征,见图1。
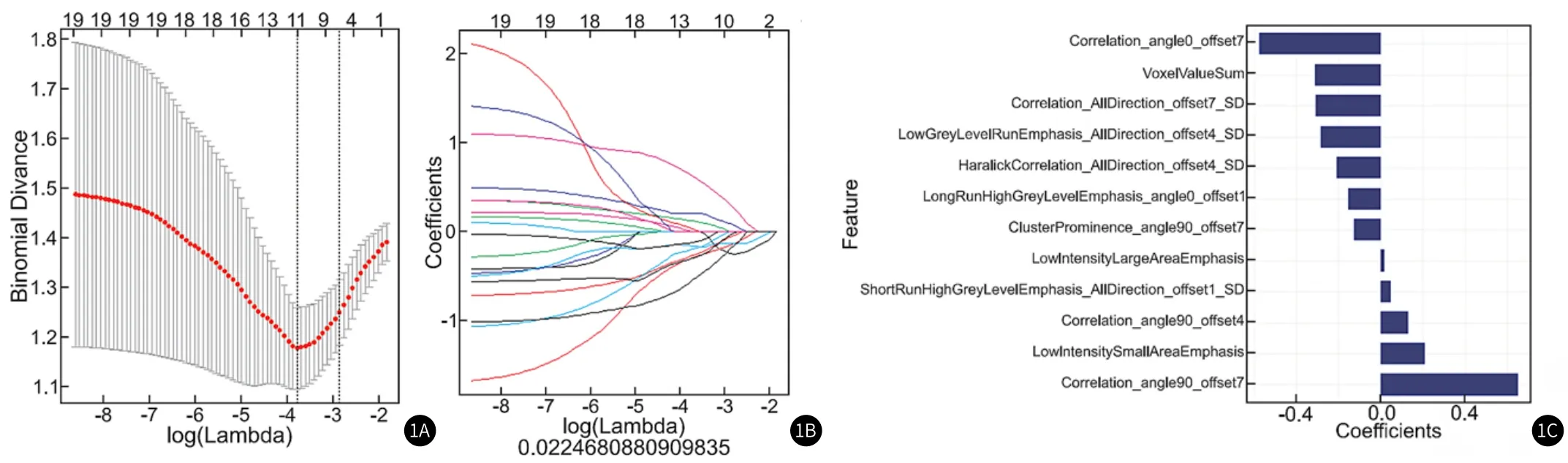
图1 影像组学模型的构建。1A:Lasso模型中调节参数lambda的选择,横轴为logλ,纵轴为曲线下面积,每个λ对应一个曲线下面积;1B:横轴为logλ,纵轴为396个影像组学特征;1C:选取的12个纹理特征。
2.4 训练组和验证组基本资料比较训练组和验证组的性别、年龄、BMI、吸烟史等差异均无统计学意义(P>0.05),具有可比性,见表3。

表3 训练组和验证组间基本资料比较
2.5 组间差异分布首先经预测概率计算Radscore值,然后根据阈值获得分类结果,通过wilcoxon检验发现,缓解组和未缓解组间的影像组学评分差异具有统计学意义(P<0.05),见图2。

图2 缓解组与未缓解组间Radscore值差异分布。图3 影像组学模型评估。图4 晚期肺腺癌预测模型决策曲线
2.6 影像组学模型评估在缓解组和未缓解组之间建立诊断模型,在训练组中AUC=0.846 (95%CI:0.735~0.924),灵敏度和特异度分别为70.68%和80.57%;在验证组中AUC=0.725(95%CI:0.712~0.893),灵敏度和特异度分别为72.55%和82.29%。图3、表4。

表4 肺腺癌预后评估模型的诊断正确率
2.7 影像组学模型临床应用价值建立晚期肺腺癌预测模型决策曲线,横坐标为阈值概率,绿色曲线代表接受干预的肺腺癌患者,蓝色曲线代表无任何干预的肺腺癌患者,红色曲线代表阈值在0.17~0.75范围内。该模型的净收益大于另外两种情况,提示在0.17~0.75范围内利用该影像组学模型分类更加安全,见图4。
3 讨 论
每年全球有约180万肺癌新增病例,其病死率在世界各国均位居首位且逐年递增[1]。对于不耐受手术的早期肺癌患者以及需降低瘤负荷和缓解病情的晚期肺癌患者,CT引导下RFA是一种值得考虑的局部治疗手段。RFA是近年来兴起的一种针对肿瘤治疗的新技术。其以一定频率的射频电流使靶肿瘤内的极性分子发生高速振荡产生热能,从而杀死癌细胞[6]。大量临床研究发现,RFA治疗具有操作时间短、耐受性较强,并发症较低,疗效显著等优势,当患者被确诊为晚期肿瘤后,已错过完全切除肿瘤的时机,更多的患者选择RFA治疗[7]。以往RFA技术主要针对肝肾及骨骼等实体瘤,随着对RFA技术研究的深入,大量研究发现,肺部正常组织通过肺部大血管血液循环进行呼气,散热较快,相比较而言,肺部病变部位血流量较小,散热困难,使得病变部位温度升高快,形成一个储热库,因此肺部肿瘤适合RFA治疗[8]。冯沛贝等[9]研究发现传统CT引导下RFA治疗肺腺癌疗效佳,安全性高,可延长患者生存期。
在癌症诊疗中使用的传统CT检查一般为定性的,且定量测量仅局限于一维或二维长轴测量来估计肿瘤大小,无法反映肿瘤形态和行为的复杂性,不能有效进行疗效和预后的早期评估[10]。而CT图像除包括肉眼可见的描述性特征,还包括大量潜在影响特征,若能获得这些影像数据,对于引导疾病诊疗及预测疾病预后将有重要意义[11]。影像组学通过自动化数据的特征化算法从感兴趣区获取定量特征,进一步分析肿瘤异质性[12]。国外已有研究报道,影像组学和临床参数联合诊断模型的评估能力明显优于临床参数模型[13]。也有研究证实利用肺癌患者化疗前CT图像的影像组学特征构建的模型可准确预测化疗后肿瘤情况[14]。本研究通过训练组数据发现RFA治疗前的影像组学特征提取及建模对晚期肺腺癌RFA治疗疗效有一定的预测价值,并进一步通过验证组数据进行确认。
本研究使用套索方法获取并筛选了灰度共生矩阵及游程矩阵的12种纹理特征,其中5个纹理特征属于共生矩阵,可说明图像的相邻像素灰度级的相似点,相似性越高,恶性程度越低;另外7个纹理特征属于游程矩阵,可说明纹理方向性及粗糙程度。本研究通过该12种纹理特征建立了晚期肺腺癌预测模型决策曲线,在0.17~0.75范围内,此模型的净收益均较好,对临床评估预后有很大实用性。此外,本研究建立的影像组学模型在评估RFA治疗疗效时,训练组和验证组的ROC曲线AUC均在0.7~0.9范围内,具有良好的诊断价值,而且可通过影像组学模型获得更全面的信息,为预后诊疗提供更有价值的信息。
综上所述,晚期肺腺癌患者的CT影像组学可对RFA诊疗预后进行预测评估,便于指导临床实践,对患者实现个性化诊疗,值得临床推荐。
