中枢神经系统血管外皮细胞瘤与脑膜瘤CT、MRI鉴别诊断价值研究*
2022-04-27杨彬彬李
张 涛 彭 华 杨彬彬李 峥
川北医学院附属医院神经外科(四川 南充 637000)
血管外皮细胞瘤是一种罕见的中枢神经系统肿瘤,好发部位依次为下肢、盆腔、腹膜后及头颈部[1]。发生于中枢神经系统的血管外皮细胞瘤较为少见,仅占中枢神经系统肿瘤的1%[2]。该病自然病程可以很长,但也可发生局部复发和远处转移,最为常见的是骨、肺、肝转移,导致患者预后较差[3]。中枢神经系统血管外皮细胞瘤(hemangiopericytoma,HPC)早期由于症状不明显,缺乏特异性,常容易与脑膜瘤混淆,将其看作脑膜瘤的一种特殊类型,导致术前较难确诊,目前主要依赖于影像学检查[4-5]。其中包括CT检查、超声、MRI检查等。CT、MRI检查由于其具有高密度分辨率和高软组织分辨率等优势在临床诊断HPC中具有一定的地位[6]。本研究总结2016年4月至2019年9月手术或病理学活检证实的HPC 18例及脑膜瘤47例,分析CT、MRI鉴别诊断两种疾病的临床价值。
1 资料与方法
1.1 一般资料选取本院2016年4月至2019年9月手术或病理学活检证实的HPC18例及脑膜瘤47例患者作为研究对象。18例HPC患者中,男性10例,女性8例,年龄10~66岁,平均年龄(40.13±6.78)岁。47例脑膜瘤患者中,男性18例,女性29例,年龄22~74岁,平均年龄(50.39±9.61)岁。两组临床症状可见嗅觉障碍、癫痫发作、言语不清、头晕、头痛等。
纳入标准:无MRI、CT检查禁忌证;资料齐全,无缺损;均在本院进行手术;患者知情,并签署同意书;未安装心脏起搏器。排除标准:中途退出者;凝血功能差者;先天性免疫功能障碍。
1.2 方法仪器:美国GE64排螺旋CT机,德国西门子1.5T MRI。扫描参数:(1)CT参数:管电压120KV,管电流400mA,扫描层厚为5mm,间距为5mm,薄层重建层厚2.5mm,螺距1.0mm。(2)MRI扫描参数:SE序列T1WI参数,射频脉冲重复时间(TR)600ms,回波时间(TE)25ms,层厚6mm。T2WI序列参数,TR/TE为4000ms/101ms,层厚6mm。DWI序列参数:扫描层数为36层,TR/TE为3100ms/100ms,层厚6mm。FLAIR序列参数:扫描层数为22层,TR/TE为5500ms/110ms,层厚6mm。先进行常规CT平扫,平扫完成后利用造影剂进行增强扫描。CT造影剂选用碘海醇试剂,注射剂量100mL,注射速率3.5mL/s。MRI造影剂Gd-DTPA试剂,注射剂量0.1mmol·kg-1,流速3mL/s。
1.3 观察指标MRI、CT扫描图像由两名医师采用双盲法进行阅片,获得统一意见。分析肿瘤位置、形态、坏死、强化程度等特征。
1.4 统计学方法采用SPSS 18.0软件进行统计分析,计量资料以(±s)描述;计数资料以n(%)表示,并采用χ2检验;以P<0.05为差异具有统计学意义。
2 结 果
2.1 肿瘤大小、形态、位置18例HPC患者,颅内病灶10例,其中颅底4例,矢状窦2例,大脑镰旁1例,小脑幕2例,额叶1例;椎管内病灶8例,C7~T1水平髓外硬膜下4例,其余34例位于C2-3水平髓内。肿瘤直径大小:最大直径7.3cm,最小直径2.6cm。肿瘤形态:分叶状9例,不规则形5例,椭圆形2例,扁圆形2例。47例脑膜瘤患者,额部5例、顶部6例、颞部11例、枕部4例、额部大脑镰旁5例、顶部大脑镰旁9例、鞍区7例。肿瘤直径大小:最大直径6.8cm,最小直径2.3cm。肿瘤形态:类圆形29例,不规则形18例。
2.2 HPC与脑膜瘤的MRI及CT表现特征比较HPC肿瘤外形以波浪状分叶多见,脑膜“尾”征较少见,肿瘤内多见囊变坏死、血管流空信号,增强扫描强化明显,DWI上以等低信号为主、多无钙化;脑膜瘤上述影像学征象则与HPC相反,两者肿瘤外形以波浪状分叶,肿瘤内多见囊变坏死、血管流空信号、增强扫描、临近颅骨无增生、DWI信号6个因素比较差异显著(P<0.05),而脑膜“尾”征、钙化2个因素比较无明显差异(P>0.05),详情见表1。

表1 HPC与脑膜瘤的MRI及CT表现特征比较[n(%)]
2.3 病例分析见图1~图8。
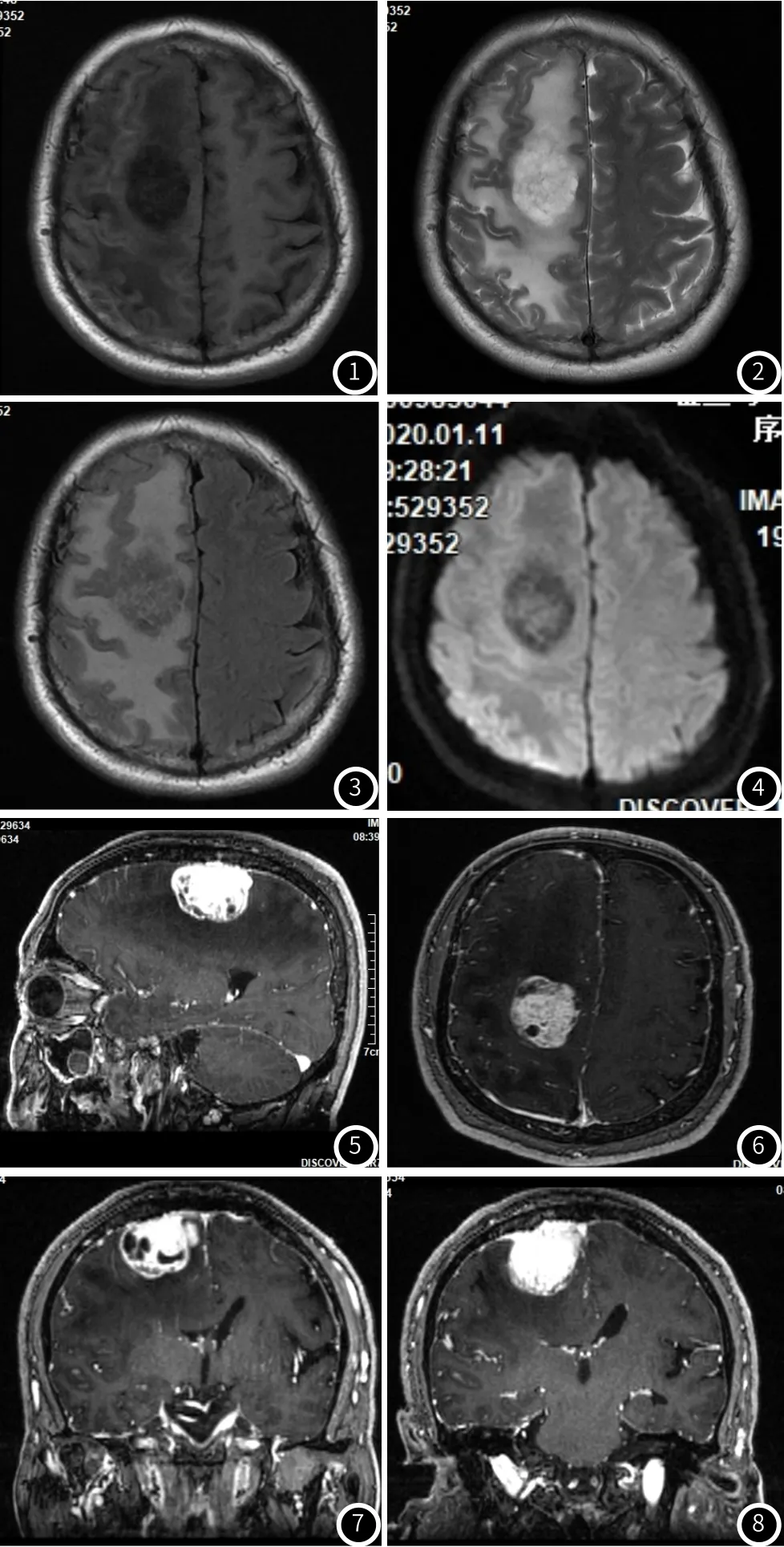
图1 ~8 患者男,57岁,以“家人发现患者左手不灵活6月余”为主诉入院 影像诊断 :右额部血管外皮细胞瘤 MRI平扫示:右额部可见团块状长T1(图1)长T2(图2)信号,其内信号不均,边界尚清,FLAIR序列(图3)及DWI(图4)呈稍高信号。周边可见大片状长T1长T2信号,右侧侧脑室受压,中线结构向左移位。MRI增强示:右额部团块状长T1信号明显强化(图5~图8),病灶内部信号不均,其内可见多个类圆形未强化区。病灶宽基底与脑膜相连,邻近脑膜可见不规则强化。周边水肿未见明显强化。
3 讨 论
3.1 HPC、脑膜瘤概况与鉴别诊断意义HPC既往认为是脑膜瘤的一种亚型,约占全部软组织肉瘤的3~5%,神经系统80%以头痛为首发症状,60%有呕吐、眩晕、复视等症状[7]。临床上可见于任何年龄,但以中年多见。HPC属于恶性肿瘤,可远处转移,易复发,手术和术后放疗是其主要治疗方法[8]。脑膜瘤是颅内最常见的非胶质原发肿瘤。约占整个颅内肿瘤的15%[9]。HPC与脑膜瘤的治疗方式存在一定差异,故术前鉴别诊断尤其重要。
3.2 CT、MRI影像特征及鉴别诊断分析HPC与脑膜瘤需在影像学上鉴别。由于这两种疾病的好发部位、颅内脑外肿瘤特点相似等原因,导致临床上诊断较困难[10]。本研究主要将鉴别要点归纳为:(1)肿瘤形态是否为分叶状:HPC形态多不规则,以分叶状多见,可呈波浪状;而脑膜瘤以类圆形多见,分叶状较少见。本研究中,18例HPC中15例外形波浪状分叶,而47例脑膜瘤中37例呈类圆形无分叶肿块。分析其原因可能与HPC肿瘤细胞分化程度不一致,且生长快速,具有侵袭性;而脑膜瘤生长较缓慢[11]。(2)坏死囊变:本研究显示,HPC出现囊变坏死几率为77.78%,脑膜瘤出现坏死囊变几率为25.53%,明显低于HPC,导致HPC在MRI上多表现为不均匀信号。而脑膜瘤在MRI上信号多均匀。这也与肿瘤生长方式有关,HPC为恶性肿瘤,血管丰富,常容易导致肿瘤局部供血不足而坏死[12]。(3)HPC由于强化程度高于脑膜瘤,肿瘤内血管流空信号更为常见,这与HPC血管较多,血供较脑膜瘤丰富有关[13]。(4)肿瘤临近颅骨情况:HPC引起临近颅骨增生的几率较脑膜瘤低,陈荣等[14]研究显示HPC的恶性侵袭性生长更容易导致颅骨破坏。而脑膜瘤常用临近颅骨增生的现象,尤其以颅底部位较多见[15]。此外HPC由于囊变坏死多见,血管较丰富,DWI上以等低信号多见;而脑膜瘤囊变坏死少见,水分子弥散自由度降低,DWI上以较高或高信号多见。
综上所述,CT与MRI检查均可有效诊断HPC与脑膜瘤,两者影像学征象具有相似性,但仍各具其特征性。结合患者影像学特征、对比MRI、CT征象可有效提高鉴别诊断准确率。
