MRI影像组学在胶质瘤术前分级评估中的应用
2022-04-27张昌飞杜福川张昌凯
张昌飞 杜福川 张昌凯
海南省中医院放射科(海南 海口 570203)
胶质瘤是大脑和脊髓胶质细胞癌变产生的恶性肿瘤,具有发病率高、复发率高、死亡率高及治愈率低等特点,肿瘤组织生长到一定大小时,可造成患者肢体运动障碍、癫痫、失语及精神失常[1]。临床治疗胶质瘤的主要方法为手术切除、放射治疗和化学治疗,以达到去除肿瘤组织、杀灭肿瘤细胞和延缓肿瘤发展的目的[2]。胶质瘤分为Ⅰ~Ⅳ级,其中Ⅰ~Ⅱ级肿瘤生长缓慢,预后较好,而Ⅲ~Ⅳ级肿瘤生长速度快,浸润性和侵袭性强,预后差[3]。因此,术前对胶质瘤进行精确分级,有利于促进临床决策,改善预后。确诊胶质瘤的“金标准”为外科手术取材组织病理学检查,但该有创性操作不适用于其术前分级评估,目前临床主要依据患者临床表现和肿瘤的影像学特征对胶质瘤进行术前分级[4]。磁共振成像(magnetic resonance imaging,MRI)可明确胶质瘤发生部位、范围及数目,且不同级别的胶质瘤在MRI影像上具有一定的特征性表现,,但无法对胶质瘤精确定位和定性诊断,不能满足术前分级评估的需求[5]。行弥散加权成像(diffusion weighted imaging,DWI)可反映人体组织内水分子运转状态,是肿瘤影像学诊断中应用最广的成像技术[6]。横向T2流体衰减反转恢复序列(transverse T2fluid-attenuated inversion recovery,T2FLAIR)是一种对比增强MRI成像,具有较长的T1值,可有效抑制游离水或正常脑脊液的MR信号形成水抑制图像,常用于脑部和脊髓MRI成像[7]。影像组学是一种医学影像大数据定量分析方法,在探索影像定量特征与病理联系中应用广泛[8]。研究表明,影像组学可以有效的鉴别胶质瘤分级,有助于提高MRI在胶质瘤分级评估与病理测量结果中的一致性[9]。本研究主要探讨分析MRI影像组学在胶质瘤术前分级评估中的应用,旨在为胶质瘤术前诊断分级提供参考。
1 资料与方法
1.1 一般资料回顾性分析2017年6月至2020年6月在本院接受手术治疗的胶质瘤患者50例。纳入标准:符合胶质瘤诊断标准[10],经组织病理学检查确诊;术前两周内行DWI和T2FLAIR扫描;MRI检查后2周内行手术治疗;病历资料完整。排除标准:合并其他脑部疾病者;合并大范围颅内出血者;MRI图像运动伪影严重者;MRSI数据缺失;MRI检查禁忌者。根据2015版中国中枢神经系统胶质瘤诊断与治疗指南[11]将患者分为低级别胶质瘤组(Ⅰ~Ⅱ级)23例和高级别胶质瘤组(Ⅲ~Ⅳ级)27例。低级别胶质瘤组年龄25~75岁,平均年龄(49.35±6.56)岁,男10例,女13例,病程1~5个月,平均病程(2.63±0.51)个月,其中Ⅰ级14例,Ⅱ级9例。高级别胶质瘤组年龄26~75岁,平均年龄(50.07±6.42)岁,男13例,女14例,病程1~6个月,平均病程(2.69±0.57)个月,其中Ⅲ级17例,Ⅳ级10例。两组一般资料无显著差异(P>0.05)。本研究经医院伦理委员会批准通过。
1.2 方法
1.2.1 MRI扫描设备及参数 使用1.5T MRI扫描仪(MR750,通用电气公司)采集所有胶质瘤患者术前图像,基本扫描方案包括DWI、T1加权像(T1weighted image,T1WI)、T2加权像(T2weighted image,T2WI)及T2FLAIR,均选取轴位,扫描范围包含肿瘤实质及边缘强化区。扫描参数设置:(1)DWI:TR=3000,TE=89ms,层厚6mm,层数18,矩阵192×256,视野24cm×24cm,激励次数1。(2)T1WI:TR=1500ms,TE=24ms,层厚6mm,层数18,层间距1mm,矩阵224×320,视野24cm×24cm,激励次数1。(3)T2WI,TE=102ms,TR =4600ms,层厚6mm,层数18,层间距1mm,矩阵224×320,视野24cm×24cm,激励次数1。(4)T2FLAIR:TR=8000ms,TE=165 ms。层厚6mm,层间距1mm,层数18,矩阵192×256,视野24cm×24cm,激励次数1。
1.2.2 MRI图像分割 采用ITK-SNAP软件(www.itksnap.org)对进行MRI图像半自动分割。在胶质瘤DWI图像中勾画感兴趣区(region of interest,ROI):设置提取特征的标准,在代表区域选取含多像素的小面积种子点,测量种子点临近区域的像素,检测其是否满足提取特征标准。勾画ROI时应需避开血管、囊变与坏死区,采用MATLAB软件提取ROI内病灶区域的特征。以动态增强曲线为流出型或平台型表示病灶区达到强化峰值或强化较明显,以动态增强曲线为上升型表示周围正常乳腺实质的强化尚不明显,使病灶与周围正常的乳腺实质对比度达到最佳状态,利于更加精确勾画ROI。
1.2.3 DWI和T2FLAIR图像分析及数据处理 使用MATLAB软件提取DWI图像和T2FLAIR图像中ROI内的胶质瘤区域进特征, 扩散敏感系数b值范围选取为0s/mm2、100s/mm2和3000s/mm2。消除伪影,通过3个不同b值及其ROI区信号强度计算弥散系数(apparent diffusion coeffcient,ADC)、分布扩散系数(distributed diffusion coefficients,DDC)和拉伸因子(α),并取其均值。
1.2.4 组织学病理检查 将术中获取的胶质瘤肿瘤组织进行常规石蜡包埋切片,经由免疫组化染色法处理后,于显微镜下观察瘤体细胞组织学形态。根据2015版中国中枢神经系统胶质瘤诊断与治疗指南进行分级,以Ⅰ~Ⅱ级为低级别胶质瘤,以Ⅲ~Ⅳ级为高级别胶质瘤。
1.3 统计学方法采用SPSS 22.0统计学软件进行数据分析,计量资料采用(±s)表示,组间差异采用两样本独立t检验,分别计算DWI和T2FLAIR诊断胶质瘤级别的敏感度、特异性及准确性。受试者操作特性(receiver operating characteristic,ROC)曲线评估DWI和T2FLAIR诊断胶质瘤级别的价值,以双侧P<0.05认为差异有统计学意义。
2 结 果
2.1 胶质瘤术前MRI影像学特征胶质瘤MRI影像表现随其病理分级不同而出现不同的影像表现。DWI图像中,病理分级为Ⅲ~Ⅳ级高级别胶质瘤边界不清,见图1;而病理分级Ⅰ~Ⅱ级的低级别胶质瘤体边界尚可,见图2。T2WI图像中,高级别胶质瘤见大片水肿信号,存在明显占位效应,增强后强化明显,见图3;低级别胶质瘤信号多呈不均匀,增强后部分无强化或呈不均匀强化,见图4。T2FLAIR图像中,高级别胶质瘤体强化区外皮层信号异常,见图5;低级别胶质瘤体强化区外皮层信号瘤体强化区外皮层信号未见明显异常,见图6。

图1 左颞叶脑胶质瘤,DWI图像,病理分级IV级,瘤体周围边界不清。图2 右额叶脑胶质瘤,DWI图像,病理分级Ⅱ级,瘤体周围边界尚清。图3 左颞叶脑胶质瘤,T2WI图像,病理分级Ⅳ级,肿瘤内强化明显。图4 右额叶脑胶质瘤,T2WI图像,病理分级II级,肿瘤内不均匀强化。图5 左颞叶脑胶质瘤,T2 FLAIR图像,病理分级IV级。图6 右额叶脑胶质瘤,T2FLAIR图像,病理分级II级,瘤体强化区外皮层信号未见明显异常。图7 DWI、T2 FLAIR诊断胶质瘤分级ROC曲线。
2.2 不同级别胶质瘤的DWI参数和T2FLAIR参数比较在DWI和T2FLAIR检查中,高级别胶质瘤组ADC、DDC和α值均明显低于低级别胶质瘤组(P<0.05),见表1。

表1 不同级别胶质瘤的DWI参数和T2FLAIR参数比较
2.3 DWI图像结果与病理结果比较以病理结果为“金标准”,将低级别胶质瘤作为“金标准”阴性,将高级别胶质瘤作为“金标准”阳性。DWI诊断敏感度、准确度为77.78%、76.00%,阳性预测值为77.78%,阴性预测值为73.91%(Kappa=0.517),见表2。

表2 DWI图像结果与病理结果比较
2.4 T2FLAIR图像结果与病理结果比较T2FLAIR诊断敏感度、准确度为88.89%、84.00%,阳性预测值为82.76%,阴性预测值为85.71%(Kappa=0.676),见表3。

表3 T2FLAIR图像结果与病理结果比较
2.5 DWI联合T2FLAIR图像结果与病理结果比较DWI联合T2FLAIR诊断敏感度、准确度为96.29%、90.00%,阳性预测值为86.67%,阴性预测值为95.00%(Kappa=0.796),见表4。

表4 DWI联合T2FLAIR图像结果与病理结果比较
2.6 DWI、T2FLAIR图像结果诊断胶质瘤分级价值ROC分析血清DWI、T2FLAIR图像结果诊断胶质瘤分级的价值,结果显示,DWI、T2FLAIR图像结果诊断胶质瘤分级的曲线下面积(area under the curve,AUC)分别为0.758和0.836,DWI联合T2FLAIR诊断胶质瘤分级的AUC为0.895,具有最佳诊断效能(P<0.05),见图7和表5。
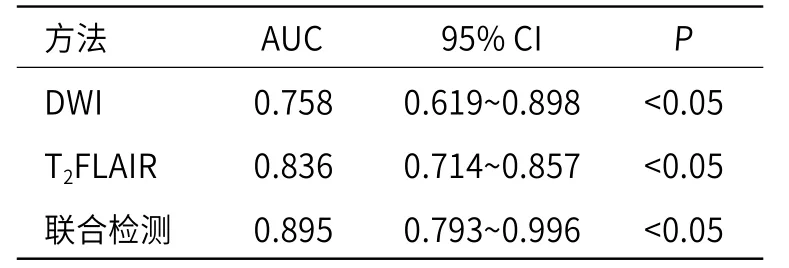
表5 DWI、T2FLAIR诊断胶质瘤分级预测价值
3 讨 论
胶质瘤是来源于神经上皮细胞的中枢神经系统常见恶性肿瘤,肿瘤细胞分化程度不同,其治疗方案也不同[12]。组织病理学检查是目前胶质瘤诊断和术前分级的“金标准”,但该方法为有创性检查,且病理取样时可能无法准确采取肿瘤分化最差的部分,限制了其在胶质瘤术前分级诊断中的应用[13]。MRI是胶质瘤诊断和术前分级中常用的影像学方法,传统的DWI通常以人体组织内水分子弥散特征来评估胶质瘤级别。但不同级别的胶质瘤可能导致病变组织的水分子弥散速度发生类似的变化,出现相似的DWI影像特征,导致常规MRI影像图像无法对低级别和高级别的胶质瘤进行鉴别[14]。T2FLAIR在常规MRI影像技术级图像基础基础上,对医学影像图像的ROI进行强化扫描,高信号可更准确地描绘胶质瘤肿瘤边界,为其诊断和分级提供影像学组生物标志[15]。本研究重点研究以DWI联合T2FLAIR为主的MRI影像组学在胶质瘤术前分级鉴别中的应用价值,并对其敏感性、特异性进行分析。
本研究结果显示,在DWI和T2FLAIR检查中,高级别胶质瘤组ADC、DDC和α值均明显低于低级别胶质瘤组。DWI可对肿瘤的恶性程度提供定量信息,通过对胶质瘤DWI信号强度的检测,可为胶质瘤术前诊断分级提供参考,但特异性一般。正常脑组织和实性病变组织中水分子多为结合水,而囊性病变中多为游离水。结合水运动速度通常较慢,在常规DWI中,游离水与结合水均呈现高信号,难以区分[16]。在T2FLAIR序列中,游离水呈低信号,结合水呈高信号,从而有效区分游离水和结合水,弥补了常规DWI在胶质瘤分级鉴别中的不足[17]。本研究在DWI和T2FLAIR检查中,考虑到不同级别胶质瘤组织生物学特性较为复杂,在采用传统b值的基础上,引入了DDC值和α值两个新的参数分别反映ADC值连续分布情况和信号衰减的组织扩散异质性。通常情况下,级别越高的胶质瘤,其ADC值、DDC值和α值越低。郝凤玲等[18]研究显示,高级别胶质瘤ADC、D、f、DDC、α值低于低级别胶质瘤,与本研究结果基本一致,说明与DWI与T2FLAIR检查在胶质瘤术前分级检查中均具有更好的应用效果。
本研究对DWI、T2FLAIR单独检查及DWI联合T2FLAIR的影像学组诊断胶质瘤级别进行Kappa一致性分析,并分别计算了敏感度、特异性及准确性,结果显示MRI影像学组具最高的敏感度、特异性及准确性,与组织病理结果的一致性最高。进一步采用ROC曲线对DWI、T2FLAIR及DWI联合T2FLAIR诊断胶质瘤级别的评估价值进行分析,结果显示,DWI联合T2FLAIR诊断胶质瘤分级的AUC为0.895,明显高于DWI、T2FLAIR单独检查的AUC,说明DWI联合T2FLAIR对胶质瘤分级具有最佳诊断效能。FLAIR以胶质瘤患者胶质瘤患者肿瘤边缘强化为主,但部分高级别胶质瘤患者可能出现肿瘤边界不清,导致其检查结果出现假阴性,需采用DWI检查中的对比剂影响结果进行矫正。而FLAIR图像与DWI结合所显示的强化边缘外临近区域异常信号是高级别胶质瘤的特异性征象,有利于对低级别胶质瘤与高级别胶质瘤进行鉴别[19]。邵华等[20]研究结果显示,FLAIR在评估预后较差的胶质瘤上具有较高的灵敏度、特异度、准确度和诊断效能。张格等[21]研究发现,结合弥散张量成像和动脉自选成像等多模态成像模式的MRI检查可提高胶质瘤术前分级的准确性,具有较好的应用价值。以上结果与本研究结果部分一致,有差异的部分可能与本研究未对除T2FLAIR以外的其他MRI影像模式对胶质瘤分级的诊断价值进行分析有关,后续可增大样本量进行深入研究。
综上所述,DWI和T2FLAIR对诊断胶质瘤术前分级均有一定的诊断价值,但以DWI联合T2FLAIR检查为主的MRI影像学组诊断价值更高。随着相关研究的进一步深入,胶质瘤MRI影像学组将会为诊断其术前分级提供更多有价值的信息。
