百菌清对杨树烂皮病的抑制机理初步分析
2022-04-26纪纯阳
纪纯阳
(辽宁省杨树研究所,辽宁 盖州 115213)
杨树作为主要的造林树种,在辽宁省内栽培广泛,品种多样[1]。近些年,因受自然因素和人为因素的影响,导致杨树用材林和防护林病虫害发生严重,直接影响杨树产业的发展[2-3],如何安全有效的防治杨树病虫害,仍是目前需要深入研究的课题。
杨树烂皮病是杨树重要的枝干病害之一[4],病原菌无性阶段为金黄壳囊孢菌Cytospora chrysosperma(Pers.)Fr.,有性阶段为污黑腐皮壳Valsa sordidaNit.[3,5]。杨树生长过程中发生冻害、日灼、干旱等自然灾害时,就会引起杨树树势衰弱、干部创伤,烂皮病大面积发生,甚至枯死,严重时造成杨树大片死亡[6-7]。通常采用化学农药来防治杨树烂皮病,而且抑制机理研究报道很少。本研究选用了一种保护型杀菌剂—百菌清,初步分析其对杨树烂皮病病原菌的抑菌机理,为杨树烂皮病病害科学防治提供一定的理论依据。
1 试验材料
1.1 菌株
杨树烂皮病(88513),购自中国林业科学院林业菌种保存中心。
1.2 药剂
百菌清(有效成分75%,利民化学有限责任公司),丙二醛试剂盒(南京建成A003-1),考马斯亮蓝G-250(国药集团化学试剂有限公司),牛血清白蛋白(BioFroxx)。
1.3 培养基
基础培养基:马铃薯培养基(PDA)。
2 试验方法
2.1 百菌清对杨树烂皮病菌丝生长量和生物量的影响试验
2.1.1 带药培养基的制备
将配置好的PDA 培养基等量分装于大三角瓶中,高压灭菌,在无菌条件下将预先称好的不同质量百菌清药剂加入到冷却至40 ℃左右的培养基中,使药剂在培养基中最终稀释1 000、800、600 和400倍液。固体培养基在加入药剂后混合均匀直接倒入无菌平皿中,冷却后封口备用。液体培养基待接种后完全冷却备用。每组处理5次重复[8-9]。
2.1.2 接种及培养
在无菌条件下,用直径为5 mm的打孔器在预培养菌株平面上打成圆形的菌丝片,取一片菌丝片接种于带药固体培养基的中间,使菌丝表面与固体培养基表面接触,用封口膜封口,放置于25 ℃生物培养箱中倒置暗培养。当对照菌丝生长至平皿边缘时停止生长,采用十字交叉法测量菌丝的生长直径,并做数据统计分析[10-11]。
取两片菌丝片接种于带药液体培养基中,封口并放置于25 ℃摇床中暗培养。以不加药剂为对照组,当对照组长满整个培养基时,终止培养,取出菌丝用无菌蒸馏水冲洗干净,用8层纱布过滤拧干,冷冻干燥后称量干重,并进行数据统计分析[12-13]。
2.2 百菌清对杨树烂皮病菌丝体内丙二醛(MDA)含量的影响试验
采用TBA 法进行MDA 含量测定。取对照和带药处理组的干菌丝0.1 g,加入到冷冻研钵中,再加液氮研磨成粉末状,放于10 mL无菌离心管中,用冷生理盐水稀释至10 mL,4 ℃条件下2 500 r/min超低温离心5 min,取适量上清液按照南京建成A003-1试剂盒说明书进行测定丙二醛的含量[14-15]。
2.3 百菌清对杨树烂皮病菌丝内可溶性蛋白质含量的影响试验
采用考马斯亮蓝G-250染色法测定菌丝内可溶性蛋白质含量[16],以牛血清白蛋白为蛋白标准品。取对照和带药处理组的干菌丝0.1 g 放于冷冻的研钵中,迅速加液氮研磨成粉末状,转移至无菌10 mL离心管中,用冷生理盐水稀释至10 mL,取各样品液0.1 mL,加入0.9 mL无菌去离子水,再加入5mL考马斯亮蓝溶液,混匀后放置2 min,以加等量无菌去离子水为对照,每组3次重复。测量各样品OD595nm,用对照管调零,并通过蛋白标准曲线计算蛋白含量[17-18]。
3 结果与分析
3.1 百菌清对杨树烂皮病菌丝生长及生物量的影响
杨树烂皮病病原菌在PDA 培养基上生长比较慢,8 d 时对照菌丝长至平皿边缘,而带药培养基上的菌丝几乎向外未延伸。此时采用十字交叉法测量各组的菌丝生长直径并进行数据统计分析。结果如表1。1 000 倍稀释液的抑制率为78.81 %±3.46 %b,而600 倍稀释液的抑制率为85.04 %±2.12 %ab。各组间菌丝生长直径和抑制率在P<0.05水平上存在显著性差异。确定不同稀释倍数的百菌清药剂对杨树烂皮病有不同程度的抑制作用。抑制率随稀释倍数的增加(浓度降低)而降低。
杨树烂皮病菌在液体PDA 培养基中培养12 d时,对照组菌丝已长满整个液体发酵培养基。结果如表1。对照组100 mL 发酵液中菌丝干重为76.08±1.89a mg,而处理组菌丝干重明显低于对照组,800倍稀释液处理组100 mL发酵液的菌丝干重为8.79±1.59c mg,而400倍稀释液的为3.84±1.34e mg。可见不同稀释倍数百菌清药剂对杨树烂皮病菌丝生长及生物量都有影响,能显著抑制菌丝的生长。
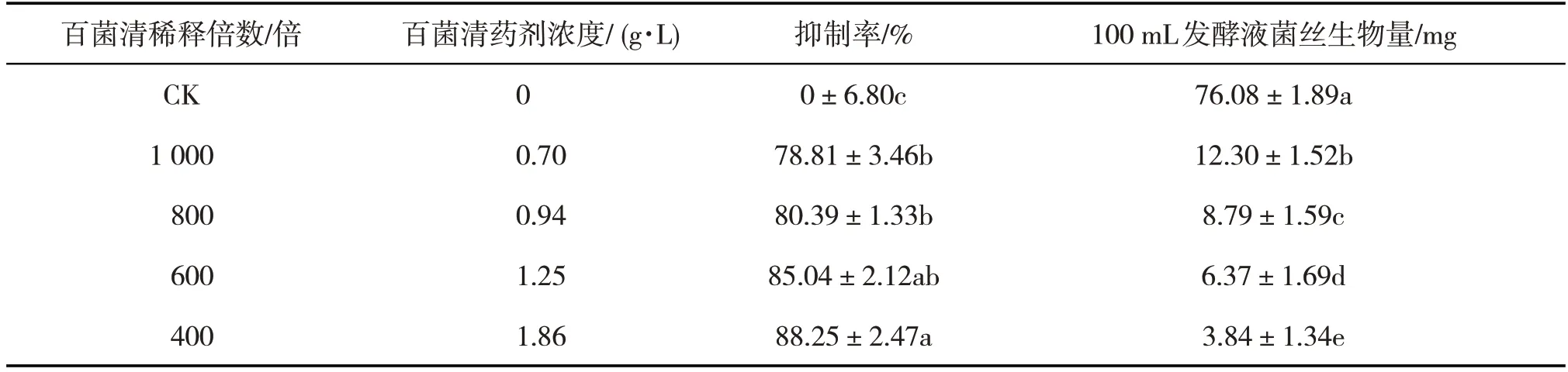
表1 百菌清对杨树烂皮病菌丝生长及生物量的影响结果
3.2 百菌清对杨树烂皮病菌丝体内丙二醛(MDA)含量的影响
MDA 含量是菌丝细胞膜过氧化程度的体现,MDA 含量高,说明细胞膜过氧化程度高,细胞膜受到的伤害严重。百菌清对杨树烂皮病菌丝体内MDA 含量结果见图1。烂皮病菌发酵培养12 d 后,对照组菌丝体内MDA 含量为1.10±0.19 mmol/g,800倍百菌清稀释液的菌丝体内MDA含量为1.91±0.35 mmol/g,而400 倍百菌清稀释液的菌丝体内MDA 含量为2.07±0.41 mmol/g。处理组的MDA 含量明显高于对照组,并随着药剂的稀释倍数的减少(药剂浓度增大)而增多,并在P<0.05 水平上呈现显著性差异。可见杨树烂皮病菌丝受到百菌清药剂胁迫时,膜质过氧化程度加剧,细胞膜受到损伤,导致MDA含量增多。
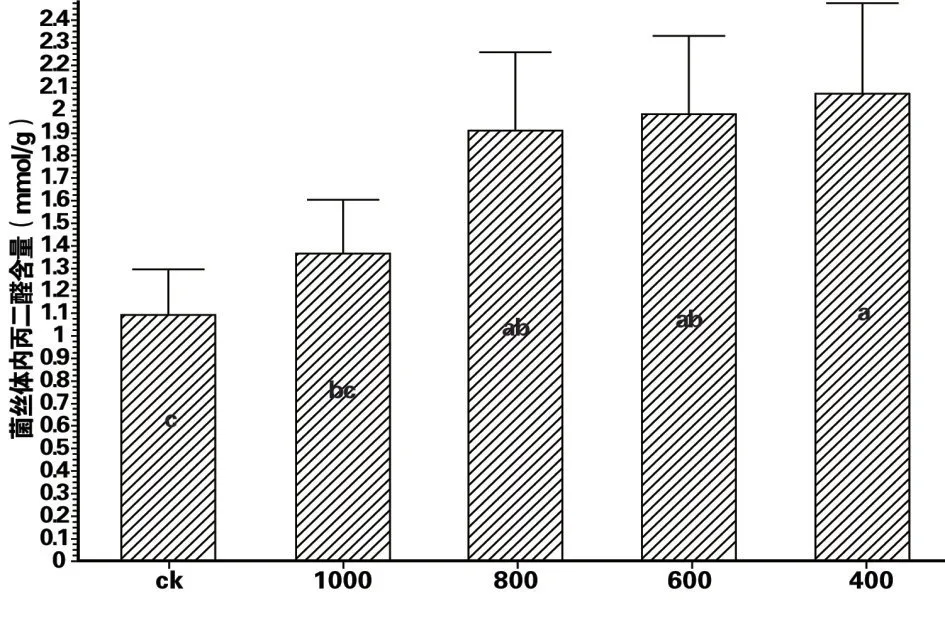
图1 百菌清对杨树烂皮病菌丝体内丙二醛含量的影响
3.3 百菌清对杨树烂皮病菌丝体内可溶性蛋白质含量的影响
蛋白质标准曲线:蛋白质含量(Y)与吸光值OD595(x)的回归方程为:Y=0.006 6x+0.012 3,相关系数R2=0.998 9。根据试验测得的各处理组OD595计算出相应的蛋白质含量。结果见图2。烂皮病菌丝发酵培养12 d后,对照菌丝体内可溶性蛋白质含量为6.29±0.96 μg/mL,800倍百菌清稀释液的菌丝体内可溶性蛋白质含量为1.21±0.57 μg/mL,而400倍百菌清稀释液的菌丝体内可溶性蛋白质含量为0.33±0.14 μg/mL,处理组的可溶性蛋白质含量明显低于对照组,并随着稀释倍数减小菌丝体内可溶性蛋白质含量也随之减少。可见百菌清能明显抑制杨树烂皮病菌丝体内可溶性蛋白质合成,导致可溶性蛋白质含量降低。
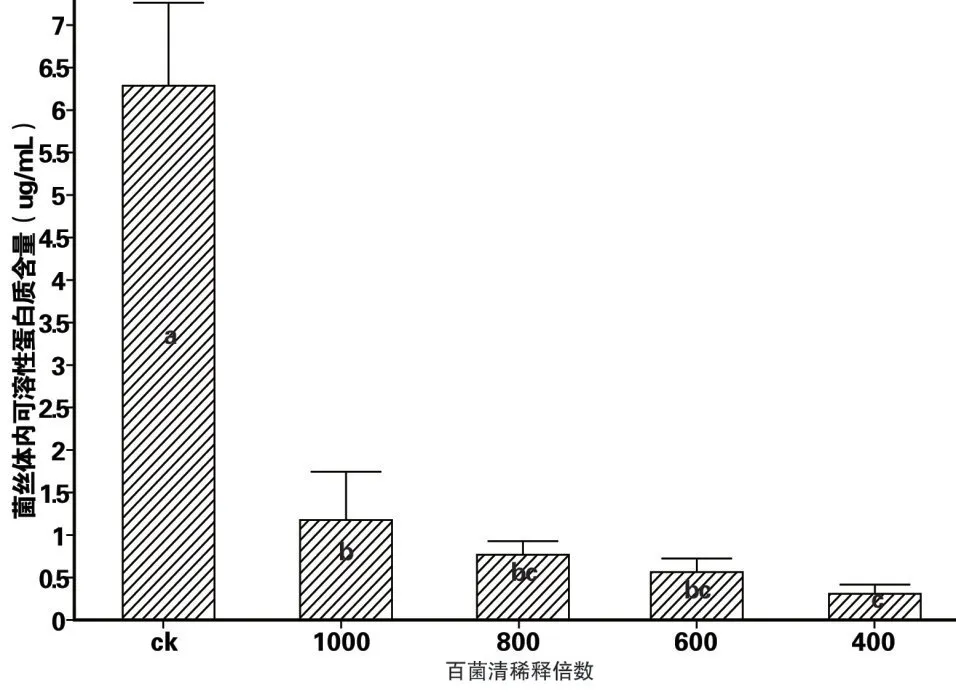
图2 百菌清对杨树烂皮病菌丝体内可溶性蛋白质含量的影响
4 结论与讨论
百菌清作为一种保护性杀菌剂,被广泛应用于林木病害防治。本研究主要从百菌清对杨树烂皮病菌丝的生长和生物量的影响,及对菌丝体内丙二醛和可溶性蛋白质含量四个方面初步分析了百菌清对杨树烂皮病的抑菌机理。通过试验表明,百菌清能明显抑制杨树烂皮病菌丝的生长和生物量;破坏菌丝细胞,使细胞膜脂质过氧化程度增大,细胞受损严重,导致丙二醛含量增大;能显著抑制杨树烂皮病菌丝体内可溶性蛋白质合成,导致体内蛋白质含量降低。
在今后试验中,还要开展更深层次的抑菌机理研究,主要从对菌丝体内各种合成与代谢相关酶活性的影响以及分子水平进行相关研究。期待为杨树烂皮病的防治提供科学依据,为百菌清在林业病虫害防治中的推广与应用提供一定的理论支持。
