藜麦愈伤组织的诱导及增殖试验
2022-04-26加央多拉孙墨可董玉迪王春龙李春花贾云峰郭来春魏黎明
田 娟 加央多拉 张 曼 孙墨可 董玉迪 王春龙 李春花 贾云峰 郭来春 魏黎明
(吉林省白城市农业科学院 吉林白城 137000)
藜麦属于双子叶一年生藜科植物,别称南美藜、藜谷、奎奴亚藜等,是一种安全的碱性食物,在南美洲大陆有几千年的栽培历史[1]。 藜麦是联合国粮农组织推荐的唯一的单体植物就可以满足人体全部基本物质需求的完美全营养食品,被誉为“未来的超级谷物”“营养黄金”“有机谷类之王”[2]。 藜麦适应环境能力较强,能够适应盐碱、寒冷和干旱等恶劣环境[3],在世界各地区的引种栽培面积逐年扩大。 国内接连开展了藜麦新品种选育[4]、栽培技术改进[5-6]、抗逆性[7]、病害防治[8]、生物学特性评价[9]、品质分析[10]及分子研究[11]等工作。 藜麦为异源四倍体(2n=4x=36)[12],自然异交率为 10%~17%, 群体的基因组成多为杂合型,遗传不稳定。 而植物组织培养技术能够保持母本的遗传性状, 解决藜麦优良品种有性繁殖性状分离的问题。 国内外有关藜麦组培快繁的研究报道相对较少。 2005年,Eisa 等[13]以藜麦下胚轴为外植体诱导愈伤组织, 首次实现了体细胞胚再生; 2016年,Hesami等[14]以藜麦下胚轴为外植体诱导愈伤组织,并分化出丛生芽;2021年,王燕芳和宋时奎[15]对藜麦愈伤组织诱导和分化条件进行初探,吴筱林[16]对藜麦离体培养无性繁殖体系进行建立。 本研究以白城市农业科学院系选品系藜麦(编号:2013-BL113)和台湾红藜为材料,对藜麦茎段、子叶不同外植体在不同培养基上对愈伤组织诱导效果进行比较, 同时对茎段的愈伤组织增殖体系进行优化试验, 旨在为藜麦再生组培和快繁体系的建立提供一定技术支撑, 为藜麦优质基因资源的发掘、 功能验证和藜麦分子遗传育种奠定基础。
1 材料与方法
1.1 试验材料
供试藜麦来源于白城市农业科学院, 系选品系(编号为2013-BL113)和台湾红藜。
1.2 藜麦无菌苗的培育
试验于 2020年10月至 2021年5月在白城市农业科学院生物技术实验室进行。 选取成熟籽粒饱满的藜麦种子,用流动的水清洗干净,清洗时间1 min,在超净工作台内,先用75%乙醇消毒30 s,无菌水冲洗 5 min,再用 10% 次氯酸钠(NaClO,有效氯浓度≥10%)处理22 min,用无菌水冲洗5 min。无菌条件下,将消毒过的种子整齐地摆在灭过菌的培养皿中,培养皿里放入2 张滤纸, 倒入无菌水浸湿滤纸, 25℃16 h/8 h 光照周期下培养4~6 d,获得无菌苗备用。
1.3 愈伤组织诱导试验
将无菌苗的茎段和子叶剪成长0.5 cm 的小段,分别斜插入诱导培养基中。 诱导培养基为MS 和C17两种培养基。 加入不同浓度的2,4-D,分别为0.4 mg/L、0.8 mg/L、1.2 mg/L、1.6 mg/L、2.0 mg/L。每个处理重复3 次。在 25℃、16 h/8 h 光照周期下培养 25 d,统计每个品种不同外植体愈伤组织的诱导率及生长情况。诱导率计算公式:诱导率=形成愈伤组织的外植体数/接种外植体数×100%。
1.4 愈伤组织增殖试验
将2013-BL113 和台湾红藜2个品种培养25 d茎的初代愈伤组织,接种到MS 附加不同激素的培养基中进行增殖培养。 每处理接种3 瓶,每瓶接种5 块愈伤组织,每处理总计15 块。20 d 后,取出愈伤组织称量鲜质量, 以愈伤组织增殖率为指标进行最佳培养基筛选。
愈伤组织增殖率=(m2-m1)/m1×100%。式中,m1为初代愈伤组织质量;m2为培养25 d 后的质量。
1.5 数据分析
使用WPS 2019 软件对试验数据进行整理和统计分析,方法参照秦正国等[17]的研究。
2 结果与分析
2.1 愈伤组织诱导结果分析
由表1 可知, 藜麦茎段对基因型和培养基的包容性非常大,很适合用来诱导愈伤组织,在不同培养基上诱导率都达到了100.00%。不同品种之间子叶愈伤组织的诱导率存在很大差异, 相同品种在不同激素浓度下子叶愈伤组织诱导率也不同(附图)。2个藜麦品种的子叶愈伤组织的诱导率相差很大, 台湾红藜子叶在MS 和C17 上都随着2,4-D 浓度升高诱导率先升高后降低, 最佳2,4-D 浓度浓度为1.6 mg/L,诱导率能达到100.00%,2种基本培养基的诱导率都很高, 平均分别能达到96.50%和 95.33%。 2013-BL113 子叶在在MS 和C17 上都随着2,4-D 浓度升高诱导率也是先升高后降低, 但是2,4-D 最佳浓度为1.2 mg/L, 并且2种培养基上诱导率相差很大,平均分别能达到88.83%和51.17%。 由此可见,藜麦愈伤组织诱导敏感性存在品种差异, 虽然用茎段、 子叶均能诱导出愈伤组织, 但茎段对基因型和培养基的包容性非常大, 更适合用作诱导愈伤组织的外植体, 相比C17 培养基, MS 更适合藜麦子叶愈伤组织的诱导。

附图 不同子叶在不同诱导培养基中的出愈示意
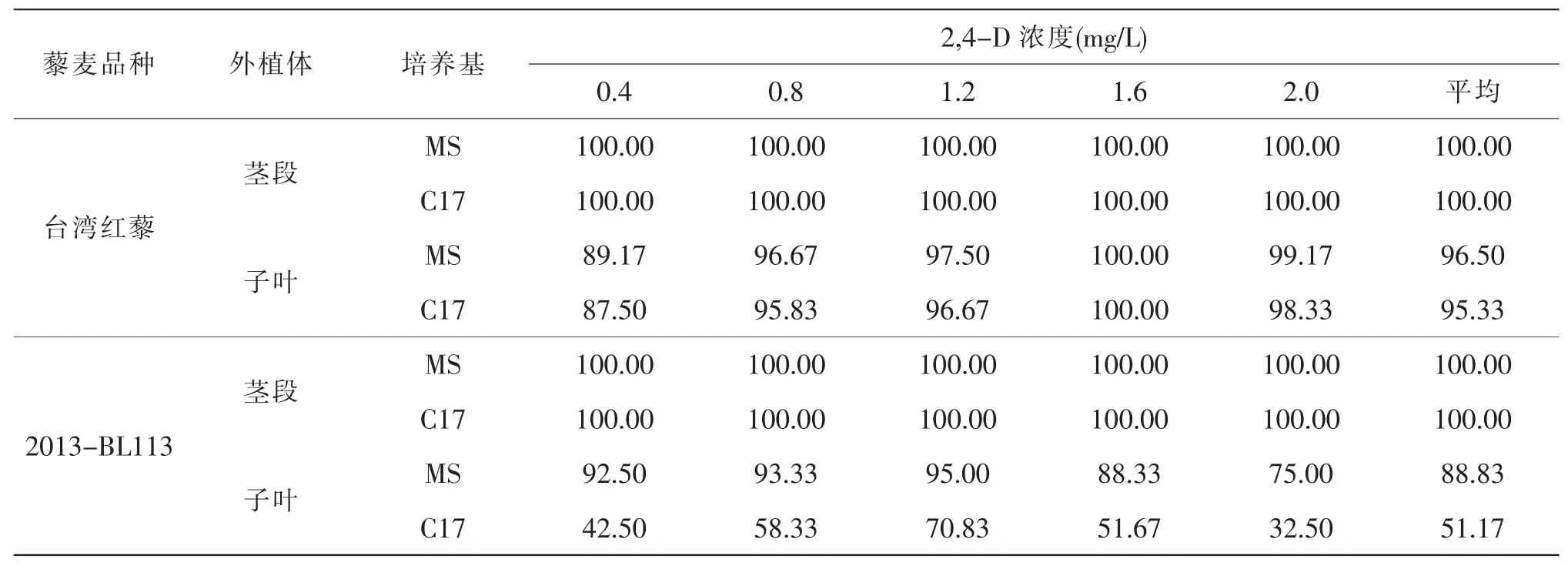
表1 不同外植体在不同培养基中的诱导率(单位:%)
2.2 愈伤组织增殖结果分析
将台湾红藜和2013-BL113 茎段愈伤组织接种到不同激素处理的培养基中培养25 d, 称量接种前后的愈伤组织质量, 可以获得不同激素处理对愈伤组织增殖的影响。 由表2 可知,不同品种愈伤组织增殖率存在很大差异, 平均增殖率为233.18%~424.46%,愈伤组织的增殖率不仅与培养基激素组分有关,也与品种特性有关。 台湾红藜茎段的愈伤组织生长较快,不同处理下增殖率较高,均值达424.46%,2013-BL113 茎段的愈伤组织生长相对较慢,不同处理下增殖率均值为233.18%。台湾红藜的增殖能力优于2013-BL113。 台湾红藜和 2013-BL113 在 2,4-D(A)、6-BA(B)、NAA(C)和 KT(D)四因素三水平正交试验下平均增殖率分别为424.46%和233.18%。 由表 3 可知,台湾红藜主次顺序为 B>D>C>A,最优组合为A1B3C1D3, 增殖率为797.89%。 由表4 可知,2013-BL113 主次顺序为 B>A>D>C, 最优组合为A1B1C1D1,增殖率为300.00%。 2个藜麦品种最优组合不同, 说明不同的藜麦品种有不同的最佳增殖培养基。 但是2个品种B 都为最主要因素,说明 6-BA对藜麦愈伤组织的增殖影响最大。

表2 不同来源愈伤组织在不同培养基中的增殖率

表3 台湾红藜正交试验L9(34)正交表及试验结果

表4 2013-BL113 正交试验L9(34)正交表及试验结果
3 结论与讨论
开展组织培养研究对于藜麦优良种质资源保存、新品种选育及遗传学特征研究等具有十分重要的意义[18]。本研究中藜麦茎段对基因型和培养基的包容性非常大,在不同培养基上2,4-D 浓度在0.4~2.0 mg/L范围内诱导率都达到了100.00%,但不同品种之间子叶愈伤组织的诱导率存在很大差异, 相同品种在不同激素浓度下子叶愈伤组织诱导率也不同, 藜麦茎段更适合用作诱导愈伤组织的外植体。这与俞涵译[19]和曹宁[20]认为对于藜麦而言,子叶和茎段均可作为外植体成功地诱导出愈伤组织并形成再生植株, 但茎段的诱导率明显优的结果是一致的。 在其他作物中也有相似的结果,比如安桂花等对高山红景天[21]、张勃等对紫花苜蓿[22]的研究都认为茎段比子叶更适合作为外植体。
2,4-D 通常是起决定作用的植物生长调节物质,主要作用于诱导愈伤组织形成、促进生根等,在植物组织培养中广泛使用[23]。Kim 研究了在2种基础培养基上,只有2,4-D 的适量浓度才会增加外植体的出愈率, 使用过量或低浓度少量使用都不利于愈伤组织的形成[24]。本研究2个藜麦品种的子叶愈伤组织在不同培养基中在2,4-D 浓度0.4~2.0 mg/L 范围内都随着浓度升高诱导率先升高后降低,同一品种在不同培养基中随着2,4-D 浓度的变化诱导率的变化趋势一致,但是不同品种的最佳2,4-D 浓度不同。 台湾红藜子叶的最佳2,4-D 浓度为1.6 mg/L,2013-BL113子叶2,4-D 最佳浓度为1.2 mg/L,这与俞涵译[19]的研究结果MS+0.5 mg/L 2,4-D 为最佳诱导培养基不同,可能是因为他所用的外植体为藜麦茎段, 本研究外植体为藜麦子叶,并且所选用的藜麦品种也不同。 所以在藜麦子叶诱导愈伤组织时,2,4-D 的浓度要根据基因型不同适量选择,建议浓度在1.2~1.6 mg/L。
常用的基本培养基有多种,田娟等[25]在燕麦成熟胚培养中对比了W14 和MS 2种基本培养基, 结果显示,在其他情况都相同的情况下,基本培养基W14要比MS 出愈率高,并且基本培养基对愈伤组织出愈率的影响差异显著。 本研究中藜麦茎段对培养基的包容性很大,但是子叶就有所不同。 台湾红藜子叶在MS 和C17 培养基中的平均诱导率分别为96.50%和95.33%,2013-BL113 子叶愈伤组织的平均诱导率分别为88.83%和51.17%。 2种基本培养相比较,MS 优于C17。
组培体系中, 愈伤组织增殖速度关系到组培体系效率[26]。 高丽丽等[27]的研究表明,籼稻愈伤组织的增殖与品种特性有。 俞涵译[19]等认为,藜麦不同品种愈伤组织增殖率存在很大差异, 增殖率为52%~268%,愈伤组织的增殖率不仅与品种特性有关,也与培养基激素组分有关,处理Ⅳ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA) 愈伤组织增殖率最高,达到268.3%,处理Ⅳ为最优增殖培养基。本研究不同藜麦品种愈伤组织增殖率存在很大差异, 平均增殖率为233.18%~424.46%,台湾红藜和2013-BL113 在2,4-D(A)、6-BA(B)、NAA(C)和 KT(D)四因素三水平正交试验下平均增殖率分别为424.46%和233.18%。 台湾红藜的最优组合为A1B3C1D3(MS +0.4 mg/L 2,4-D + 2.0 mg/L 6BA +0.1 mg/L NAA+1.2 mg/L KT), 增殖率为 797.89%,2013-BL113 的最优组合为 A1B1C1D1(MS +0.4 mg/L 2,4-D + 1.0 mg/L 6BA+0.1 mg/L NAA+0.4 mg/L KT),增殖率为 300.00%。本研究2个藜麦品种的增殖率远远高于俞涵译选用的藜麦品种的增殖率,可能原因:一是由于基因型的不同;二是对比激素,本研究多添加了6-BA 导致增殖率高。 在本研究中不同的藜麦品种B 都为最主要因素,也说明了6-BA 对藜麦愈伤组织的增殖影响最大。 这与段鹏慧等[28]认为6-BA 对藜麦腋芽的增殖作用较 KT 好结果相似。
