黄瓜次生代谢产物抑制反硝化作用的研究
2022-04-26张新星李睿琦伊章华徐一硕高志岭
张新星,李睿琦,伊章华,徐一硕,高志岭
(河北农业大学 资源与环境科学学院 / 河北省农田生态环境重点实验室,河北 保定 071000)
氮素是作物生长发育所需的重要营养元素,合理施用氮肥是作物高产的关键措施[1-2]。然而,目前我国农田氮肥利用率普遍较低,施入农田的氮肥约有40%~50%通过各种途径流失[3]。在氮素循环转化过程中,氨挥发、硝酸盐的淋洗、硝化和反硝化过程是土壤氮素损失的主要途径。土壤反硝化在不同的土壤环境中可导致25%~90%的氮肥损失[4-5]。反硝化作用不仅会降低氮肥的利用效率,同时产生的氮氧化物对环境也有严重的负面影响。
目前关于土壤氮素循环抑制剂的研究也主要集中在硝化和矿化这两个过程[6-9]。常见的土壤氮素循环抑制剂主要为化学合成抑制剂[8-11],化学合成抑制剂可有效的抑制土壤氮素的转化,有些化学抑制剂还能提高作物的氮素利用率及产量。但是化学合成抑制剂因其成本高,生物稳定性有限等原因,在实际生产中的应用并不广泛[12]。
近年来,随着对植物—微生物—土壤氮循环互作研究的深入,发现植物次生代谢产物中存在抑制土壤硝化及反硝化过程的物质,并将其命名为生物硝化抑制剂(BNI)及生物反硝化抑制剂(BDI[13-14]。与化学抑制剂相比,生物抑制剂是植物自身产生的,具有易获得、成本低、作用时间长且对生态环境友好等特点。植物次生代谢产物通过根系分泌及组织凋落腐解等方式进入土壤,除了可以为根际土壤微生物提供氮源、碳源外,还具有介导植物对矿质元素吸收利用以及帮助植物适应外界环境变化的作用[15-17]。目前已明确臂形草根系分泌的Brachialactone[18]、高粱根系分泌的高粱醌和对羟基苯丙酸甲酯[19]、水稻根系分泌的1,9-葵二醇及卡兰贾树根系分泌的水黄皮素可以通过抑制氨单加氧酶(AMO)、羟胺还原酶(HAO)途径或单独抑制AMO途径来抑制土壤硝化作用;Bardon 等[14,20-21]从Fallopia spp.根系提取物中发现B 型原花青素(PC)可以通过诱导酶的构象变化,特异性的抑制与膜结合的硝酸还原酶活性,并在之后的研究中发现[22-23],PC 可以特异性的抑制土壤反硝化细菌活性,而不影响土壤细菌的总丰度。
生物硝化/反硝化抑制剂的形成及释放受植物种类、环境等多因素的影响,目前关于植物分泌硝化/反硝化抑制剂是否具有普遍性还未知,本研究选择我国大宗蔬菜—黄瓜为研究对象,通过室内培养试验,旨在明确黄瓜根系代谢产物中是否具有潜在的生物反硝化作用抑制物。
1 材料与方法
1.1 供试材料
供试黄瓜品种:‘津优35 号’,氮素利用高效型品种,购于天津科润农业科技股份有限公司。
供试反硝化模式菌株:缺乏N2O 还原酶的铜绿假单胞菌(ATCC13985,Pseudomonas aureofaciens购自美国农业部菌种保存中心)
1.2 溶液的配置
黄瓜山崎营养液:四水合硝酸钙0.95 g/L,硝酸钾0.81 g/L,七水合硫酸镁0.5 g/L,磷酸二氢铵0.155 g/L,硼酸0.003 g/L,七水合硫酸锌0.002 g/L,五水合硫酸钙5×10-5g/L,pH=6.5
LB 培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L。
反硝化DM 培养基[24]:硝酸钾0.72 g/L,磷酸二氢钾1.0 g/L,七水硫酸镁0.2 g/L,六水丁二酸二钠2.8 g/L,pH 7.0。
1.3 黄瓜种子的催芽及种植
挑选籽粒饱满的黄瓜种子,于温水中浸泡3 ~5 h后将种子置于铺有湿润滤纸的培养皿中,放入人工气候箱,恒温(25±1) ℃黑暗培养,发芽后转移到灭菌石英砂中定植,培养条件为白天22 ℃(14 h),晚上18 ℃(10 h),每隔4 d 浇1 次营养液。
1.4 根系代谢物质的提取
1.4.1 根系分泌物的提取 取定植后生长30 d 的黄瓜幼苗,灭菌的去离子水洗净根系后置于锡纸包裹的盛有无菌水的三角瓶中,光照条件下连续收集根系分泌物8 h。收集的水溶液过0.22 μm 滤膜真空抽滤后置于超低温冰箱(-86 ℃)冷冻12 h,冷冻干燥机冻干。
称取50 mg 根系分泌物冻干粉溶解于50 mL 色谱纯的甲醇中,超声提取30 min 后4℃环境下12 000 r/s离心10 min,收集上清液;上清液42℃旋蒸至干后,50 mL 的无菌水复溶,超声提取30 min 后再次离心,将上清液与水不溶组分分开。未溶解组分冷冻干燥后用5 mL 甲醇复溶,得到非水溶性组分。上清液用3 倍体积的二氯甲烷进行超声波提取,分离出二氯甲烷层,30 ℃旋蒸至干,不溶物复溶于5 mL 液相色谱纯甲醇中,得到根系分泌物的中性组分;用1 mol/L 的HCl 将上清液pH 值调为2,相同方法进行提取,得到根系分泌物的酸性性组分。试验前,取5 mL 样品,旋转蒸至干后,5 mL 二氯甲烷复溶,备用。
1.4.2 根系提取物的提取 取定植后生长30 d 的黄瓜幼苗,使用前用灭菌的去离子水将根系洗净,锡纸包裹置于液氮中速冻,后进行冷冻干燥。称取5 g冻干后的根在珠磨机中粉碎,溶解于50 mL 水∶甲醇(50∶50,v/v)中进行30 min 的超声提取,之后对提取液进行真空抽滤,50 mL 纯甲醇对残渣重复进行两次提取,将所有提取液收集到一起并干燥浓缩。使用前,将干燥后的样品重新悬浮于水∶甲醇(50∶50,v/v)中,0.22μm 滤器过滤,得到10 mg/mL 提取物。
1.5 试验方案
1.5.1 细菌培养 将甘油瓶中的铜绿假单胞菌接种于灭菌的LB 肉汤培养基中,28 ℃下培养过夜,将处于指数生长期的细菌进行离心收集菌体处理后,置于0.9%的NaCl 水溶液中重复洗涤3 次,之后复溶于50 mL 0.9%的NaCl 水溶液饥饿培养2 h。培养结束后离心,用反硝化DM 培养基复溶菌体并调整OD600为0.05,备用。
1.5.2 根系分泌物对铜绿假单胞菌代谢活性的影响由于根系分泌物的数量有限,该试验在含有氧化还原染料氯化四唑的Biology MT2 96 孔板中进行,通过氧化还原染料变色程度判断细菌厌氧呼吸代谢活性强度。取97 μL 菌液加入96 孔板中,并以2.5%的添加量将不同浓度的根系分泌物添加到96 孔板中,各处理根系分泌物的最终浓度分别为0.015、0.075、0.15、0.3 mg/mL,为创造反硝化过程发生的厌氧环境,最后在每孔中加入60 μL 矿物油覆盖。将MT2 平板置于28 ℃恒温培养箱中培养,培养12 h 后每隔3 h 用酶标仪(590 nm)测定1 次代谢活性。
1.5.3 根系提取物对细菌反硝化过程的影响 设置根系提取物的浓度分别为0、0.005、0.02、0.1、0.25、0.5 mg/mL,将菌液及根系提取物溶液加入250 mL 带有橡胶塞密闭的灭菌血清中,瓶中空气用氮气代替,瓶内最终细菌OD600值为0.05,总体积为10 mL。培养开始前18 h,每间隔6 h 测定1 次氧化亚氮浓度,之后每隔12 h 测定1 次,连续测定66 h。最后一次气体采样后测定菌液中NO-N、NO-N 含量及OD600数值。N2O 采用气象色谱仪(Agilent6820)进行测定,检测器为ECD,检测温度为330 ℃;NO-N 和NO-N 使用化学分析仪(SmartChem200)进行测定;细菌OD600值采用酶标仪进行测定。
1.6 数据统计分析
采用Microsoft Excel 2016、SPSS 22.0 及origin 2018 进行数据处理和统计分析。
2 结果与分析
2.1 根系分泌物对反硝化细菌厌氧代谢活性的影响
前期研究表明,细菌接种后会有一个迟滞期,10 ~12 h 后铜绿假单胞菌进入对数生长期,因此本研究选取在培养的12 h 开始进行厌氧代谢活性的测定(图1)。
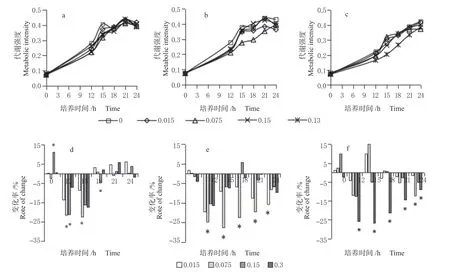
图1 不同组分根系分泌物对铜绿假单胞菌厌氧代谢活性的影响Fig. 1 Effects of different components of root exudates on anaerobic metabolic activity of Pseudomonas aeruginosa
由图1 可知,随着培养的进行,铜绿假单胞菌代谢活性增强,与未添加根系分泌物的空白处理相比,各处理在12 h 测定开始时均表现出不同程度的抑制效果。酸性组分添加量为0.075 及0.15 mg/L 的处理在培养12 h 时与空白对照相比,显著抑制了铜绿假单胞菌的代谢,抑制率分别为21.4%、21.1%;15 h 时0.075 mg/L 处理的抑制效果达到最大22.1%,其余处理与空白对照相比未表现出显著差异 (图1d)。中性组分中0.075 mg/L 的处理在培养的12 ~21 h内表现出持续的显著抑制效果,抑制效率分别为24.51%、27.59%、22.21%及19.46%;培养至24 h 时,0.015 mg/L 处理表现出显著的抑制效果(图1e)。非水溶组分中,0.3 mg/L 处理在整个培养期间均表现出显著的抑制效果,且随着培养时间的增加,抑制效果逐渐降低,各时期的抑制效率分别为25.75%、26.65%、21.31%、14.47%及9.1%;0.075 mg/L 处理在24 h 表现出显著的抑制效果(图1f)。
2.2 根系提取物对铜绿假单胞菌反硝化过程的影响
2.2.1 对细菌OD 值的影响 细菌OD600的高低直接反映了细菌量的多少,由图2 可知,在适宜的培养条件下,与空白对照相比,根系提取物的添加量分别为0.005、0.02、0.1 及0.25 mg/L 的处理在培养结束时细菌的OD600值无显著变化,当根系分泌物的添加量为0.5 mg/L 时,显著促进了铜绿假单胞菌的生长。

图2 根系提取物对细菌生长的影响Fig. 2 Effect of root extract on bacterial growth
2.2.2 对氧化亚氮排放的影响 图3 为根系提取物的添加对N2O 排放量的影响。与细菌的生长曲线一致,在0 ~12 h 内气体的累积排放量增长缓慢,12 ~42 h 进入细菌对数生长期,此时细菌生长旺盛,气体排放量大幅增加,42 h 气体累积排放量趋于稳定。与之相对的排放速率,在0 ~12 h 内快速增加,12 ~30 h 涨幅降低,30 ~66 h 之后逐渐降低趋近于0。随着培养时间的增加,各处理间气体累积排放量的差异逐渐扩大,18 h 之后,添加根系提取物的处理N2O 的累积排放量均显著高于空白对照处理,培养结束时,各处理N2O 累积排放量分别为对照处理的1.27、1.30、2.74 及2.77 倍,说明根系提取物的添加促进了N2O 的生成。

图3 根系提取物对N2O-N 排放的影响Fig. 3 Effect of root extract on N2O cumulative emission
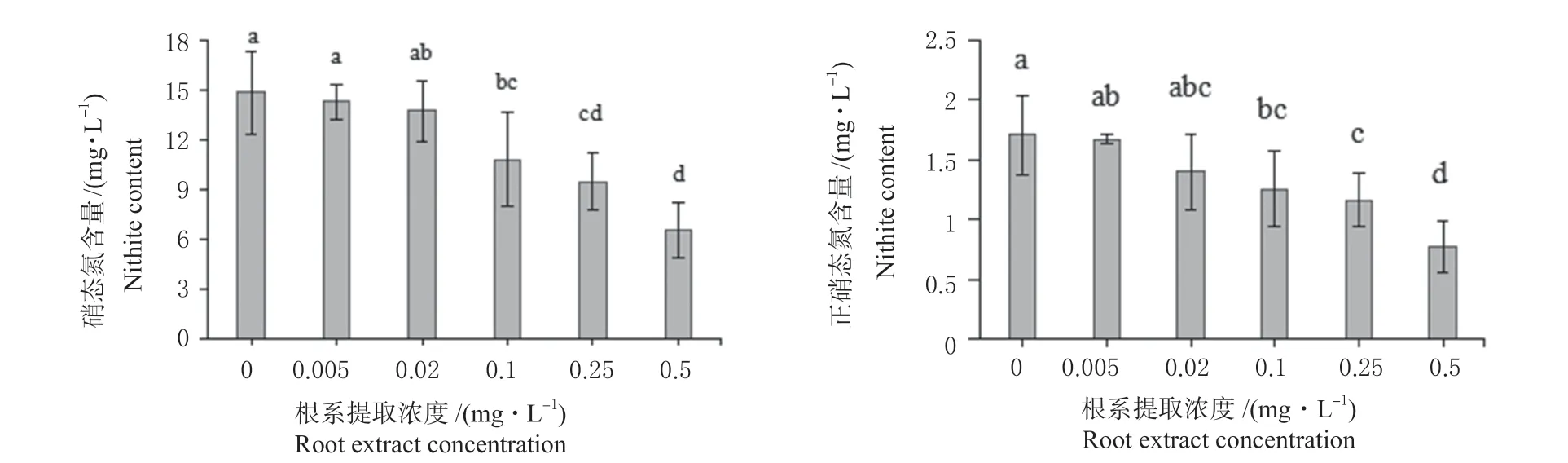
图4 根系提取物对硝态氮及亚硝态氮含量的影响Fig. 4 Effects of root extracts on nitrate and nitrite contents
2.2.4 相关性分析 对添加提取物的量及测定的各指标进行相关性分析,结果如表1 所示。根系分泌物的添加量与N2O 累积排放量及细菌OD600值分别达到了显著和极显著正向强相关;与NO-N及NO-N 的含量均达到了极显著负向强相关。除OD600与N2O 累积排放量之间无显著相关性外,其余各指标间均呈显著或极显著的相关关系。

表1 指标间相关性分析Table 1 Correlation analysis between indicators
3 讨论
大量研究表明,植物次级代谢产物中含有丰富的糖类、氨基酸、维生素等可作为微生物生长所需的碳源及氮源,刺激其生长及代谢活性的增强[25-27],除此之外植物次级代谢产物中某些特殊物质对土壤微生物或土壤养分循环具有特定的功能,例如单宁类物质可通过络合有机氮及土壤胞外酶的作用从而延缓有机氮的矿化,原花青素通过诱导酶的构象变化,特异性的抑制与膜结合的硝酸还原酶活性,从而延缓反硝化过程的发生等。植物次生代谢产物中包含物质种类繁多[15],提取及纯化方法的不同会影响最终提取物中物质含量及组成[28-29],并且根系分泌物及提取物为混合物,发生作用的不是单一组分效应,而是各个组分间相互作用的综合[24],这与本研究中在相同培养条件下,添加不同组分及不同量的黄瓜次级代谢产物均对铜绿假单胞菌的反硝化能力影响具有差异的结果相一致。本研究结果表明黄瓜根系分泌物的酸性、中性及非水溶性组分对铜绿假单胞菌的厌氧代谢活性均表现出不同程度的抑制,说明在提取的混合组分中可能具有潜在生物反硝化抑制物质的存在。合格的生物硝化/反硝化抑制剂可以特异性的抑制参与硝化及反硝化过程的酶的活性,而不影响微生物的组成及数量,由于本研究中只测定了反硝化细菌的厌氧代谢强度,并不能确定该抑制作用是通过抑制了细菌生长还是厌氧代谢酶活发生的,因此需要进一步的试验进行确定。本研究中,根系提取物添加量与培养结束时N2O 累积排放量、NO-N 含量、NO-N 含量及表征细菌数量的OD600间均达到了显著或极显著强相关,而OD600与N2O 累积排放量之间无显著的相关关系,说明根系提取物的添加量在0.005 ~0.25 mg/L 时显著促进了反硝化细菌的厌氧呼吸及反硝化过程的发生,并没促进微生物的生长,当根系提取物添加量为0.5 mg/L 时,显著促进了细菌的生长。在本研究中所采取的根系提取物处理方法下,未观察到反硝化抑制现象的发生。
4 结论
本研究以‘津优35 号’黄瓜根系分泌物及提取物为研究对象进行室内细菌纯培养试验,结果如下:
(1)根系分泌物的不同组分均表现出了不同程度的反硝化抑制能力,中性及非水溶性组分抑制效果较强,且持续时间久,最高抑制效率均出现在培养的第15 h,分别为27.59 %及26.65 %,黄瓜根系分泌物中可能存在潜在的生物反硝化抑制剂;
(2)低浓度根系提取物在不影响细菌生长的前提下显著促进了反硝化过程的进行,高浓度根系提取物既刺激了细菌的生长同时促进了反硝化过程的进行;在本研究所采取的提取方法下,未观察到根系提取物中潜在生物反硝化抑制剂存在的证据。
