基于卷积神经网络的流出道室性期前收缩心电信号人工智能定位诊断的模型构建△
2022-04-26胡鑫荣梁东坡林敏茵王树水
文 龙,胡鑫荣,梁东坡,林敏茵,刘 甜,王树水
[1.广东省心血管病研究所心儿科广东省人民医院(广东省医学科学院),广州 510080;2.美国圣母大学工程学院计算机科学与工程系,美国)
流出道室性期前收缩(outflow tract premature ventricular complex,OTPVC)是最常见的室性期前收缩(premature ventricular complex,PVC),约占所有PVC 的2/3,其中3/4 起源于右心室流出道(right ventricular outflow tract,RVOT),1/4 起源于左心室流出道(left ventricular outflow tract,LVOT)。不同起源部位的OTPVC,其治疗方案的选择和射频消融所需要的技术等不同。对于需射频消融治疗的患者,准确进行OTPVC 的左右侧起源部位定位可节省手术时间、选择合适的血管入路、减少无效消融导致的心肌损伤并降低血管并发症等手术并发症的发生率[1-4],这尤其在儿童射频消融手术中具有重要的临床指导意义。目前12 导联体表心电图是最常用的PVC 起源部位定位诊断方法[4]。但因为RVOT 和LVOT 在心脏中的解剖位置非常靠近,在心电图上都表现为aVL 和aVR 导联的负向QRS 波群等。尽管提出了V2导联移行比[5]、SV2/RV3比值[6]等指标来鉴别OTPVC,但目前的定位诊断准确率仍不理想。近年来,人工智能(artificial intelligence,AI)技术得到了蓬勃发展,在各学科的应用也越来越广泛。机器学习是实现AI 的必经之路,而深度学习神经网络则是机器学习的代表性方法。卷积神经网络(convolutional neural network,CNN)因其强大的图像识别和分类诊断能力,成为了目前应用得最广泛的深度神经网络。CNN 在心律失常[7]等医学领域中已经有所应用,初步展现出了在心电图分析领域的潜力,但目前国内、外将CNN 应用于OTPVC 定位诊断的研究仍非常少。本研究拟构建基于VGGNet、ResNet 和MobileNet 3 种CNN 架构的诊断模型,通过心电信号进行OTPVC的RVOT 和LVOT二分类定位诊断。
1 资料和方法
1.1 一般资料
本研究连续性纳入了从2015年10月至2019年11 月就诊于广东省人民医院,经心电生理检查确诊为OTPVC 的患者。排除标准:(1)伴有明显器质性心脏病[如心肌病、风湿性心脏病、严重冠状动脉粥样硬化性心脏病(冠心病)等];(2)心内电生理检查提示多个PVC 起源部位;(3)心电信号及心电图无PVC 心律。经排除标准筛选后,共421例患者纳入本研究,其中LVOT起源PVC共91例(右冠窦29 例、左冠窦26 例、右冠窦左冠窦之间25 例、左冠窦无冠窦之间1 例、主动脉瓣下流出道10 例),RVOT 起源PVC 共330 例(肺动脉左窦133 例、肺动脉前窦58 例、肺动脉右窦46 例、左窦前窦之间22 例、左窦右窦之间11 例、前窦右窦之间3 例、肺动脉瓣下流出道57 例)。本研究获得了广东省人民医院医学研究伦理委员会的批准(伦理批准号:KY-Q-2021-080-01)。
1.2 心电信号数据采集
心电信号数据均在入组患者行心电生理检查前按体表12 导联心电图标准要求进行采集。本研究均使用GE-MAC5500 心电图机进行数据采集,采样率为500 Hz,采集所得数据使用麦迪克斯MEMRS-ECG 心电网络工作站数据库进行存储。CNN 训练使用的每份心电信号数据包含12 个txt文件,每个txt 文件包含1 个标准导联的数据,即长度为10 s 的5 000 个电压值信息(采样率500 Hz×10 s=5 000 个电压值)。
1.3 心电信号预处理
经心电图机获取的是非常微弱的人体生理低频电信号,最大的幅值不超过5 mV,信号频率在0.05~100 Hz 之间。这些心电信号包含许多的信号干扰,需要对其进行预处理来消除这些干扰。本研究使用低通、带陷和零相移滤波器程序来消除肌电、工频干扰并纠正基线漂移。再对12 导联心电信号进行电压振幅标准化,使所有导联具有相同的标准电压振幅,得到统一格式的心电图信号,如图1 所示。
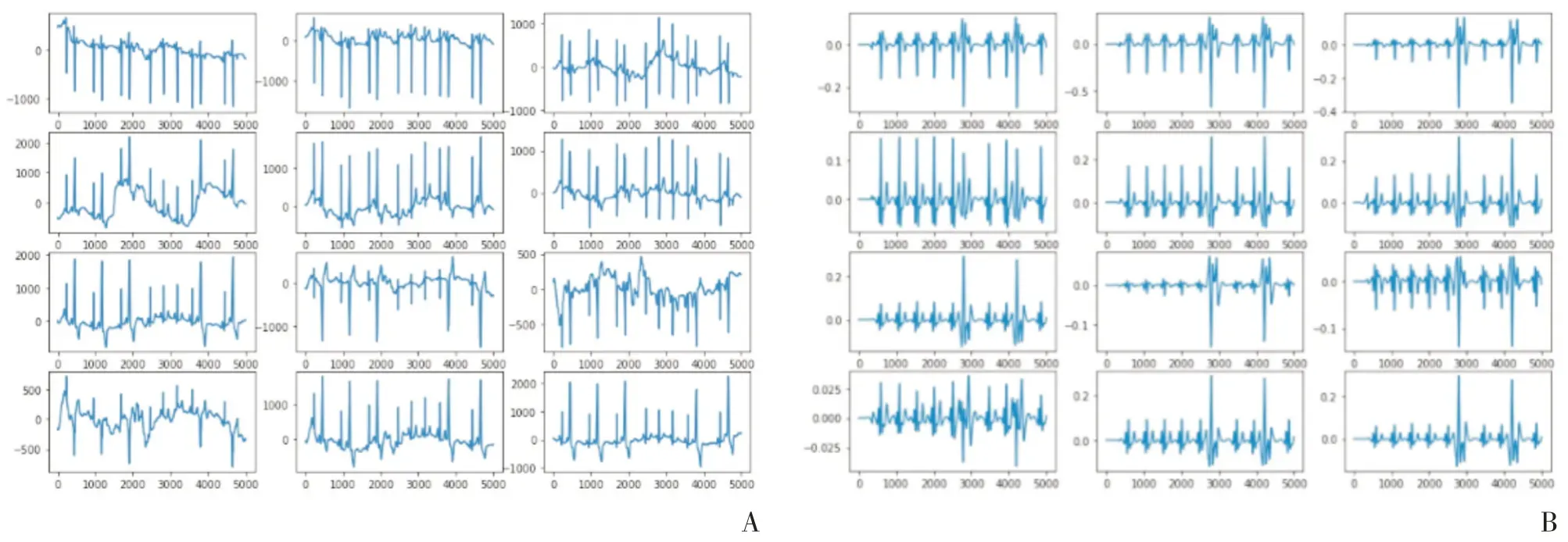
图1 心电信号预处理的可视化图例(A为预处理前的心电信号可视化图像;B为预处理后并标准化的心电信号可视化图像)
1.4 基于VGGNet、ResNet 和MobileNet 的OT⁃PVC 定位诊断模型的构建及比较
本研究分别以VGGNet、ResNet 和MobileNet 3 种CNN 为架构,构建OTPVC 的RVOT 和LVOT二分类定位诊断模型。本研究将VGGNet、ResNet和MobileNet 中的卷积层、池化层和BN 函数分别替换为一维卷积层、一维池化层和一维BN 函数,以实现对心电信号的深度学习。本研究3 种CNN模型均采用五折交叉验证法,将纳入的421 份心电信号按3∶1∶1 的比例分成训练集、验证集和测试集。模型输出对RVOT 和LVOT 的定位诊断概率,以概率>0.5 的部位作为模型对OTPVC 的定位诊断结果,并比较3 种模型的定位诊断效能。
1.5 两名心电生理专科医师对心电图进行OTPVC二分类定位诊断
本研究在421 例患者中,按照LVOT 和RVOT的比例,等比例随机选取了163 份心电图(RVOT共127 份,LVOT 共35 份)用于两名心电生理专科医师(从事心电生理专业工作10 年以上)进行OT⁃PVC 的定位诊断。心电图均为12 导联同步高清心电图,各导联之间图像无重叠,确认两名医师能够完整读取心电图信息。两名医师以V1导联束支阻滞形态和V2导联移行两个心电图特征作为主要标准来进行定位诊断,然后在RVOT 和LVOT 中选择一项作为诊断结果。
1.6 评价指标及统计学分析
计算基于VGGNet、ResNet 和MobileNet 3 种CNN 的OTPVC 诊断模型和两名心电生理专科医师对RVOT 起源PVC 诊断的敏感度(RVOT 诊断正确的患者数/电生理提示RVOT 的患者数)、特异度(LVOT 诊断正确的患者数/电生理提示LVOT 的患者数)和准确度(诊断正确的患者数/总患者数)。并绘制VGGNet、ResNet 和MobileNet 诊断模型的受试者工作特征曲线(receiver operating characteristic curve,ROC),计算ROC 曲线下面积(area under the curve,AUC)。以准确度和AUC 作为诊断效能的总体评价指标,敏感度和特异度分别作为对RVOT和LVOT 诊断效能的评价指标。3 种CNN 模型的AUC 使用Delong Test 来判断两两之间差异有无统计学意义。两名心电生理专科医师的诊断效能使用卡方检验来判断差异有无统计学意义。在3 种模型的ROC 图中,以医师的敏感度和特异度标记对应的点,以该点与ROC 的95%置信区间是否重合来判断差异有无统计学意义。年龄和性别使用t检验判断差异有无统计学意义。以双侧检验P值<0.05 定义为有统计学意义,所有统计分析均使用R 软件(4.1.0 版本)完成,使用的pROC扩展包版本为1.17.0.1,使用的ggplot2 扩展包版本为3.3.3。
2 结果
VGGNet、ResNet 和MobileNet 对RVOT 起源PVC 诊断的敏感度、特异度、准确度和AUC 见表1,ROC 如图2 所示,3 种CNN 模型的AUC 两两之间比较的差异无统计学意义(Z=-0.054,P=0.957;Z=0.028,P=0.978;Z=0.085,P=0.932)。在3种CNN模型中,准确度最高的是Mobile Net为89.31%,ResNet 和VGGNet 稍低,分别为88.84%和87.65%。敏感度较高的是ResNet 和MobileNet,都为95.45%,VGGNet稍低为92.12%。而特异度较高的是VGGNet 为71.43%,MobileNet 和ResNet 稍低,分别为67.03%和64.84%。
两名医师的定位诊断结果如表1 所示,其对OTPVC 的诊断准确度相近,分别为77.78%和79.01%,差异无统计学意义(χ2=0.062,P=0.803)。两名医师与3 种CNN 模型的诊断效能对比如图2所示,两名医师的诊断效能均低于3 种CNN 模型,差异具有统计学意义。在RVOT 诊断方面,两名医师的敏感度分别为93.70%和97.64%,其诊断效能与3 种CNN 模型相同,差异无统计学意义(χ2=7.426,P=0.115)。在LVOT 诊断方面,两名医师的特异度为20%和11.43%,差异无统计学意义(χ2=0.574,P=0.453),但低于3 种CNN 模型,差异有统计学意义(χ2==9.375,P=0.002)。
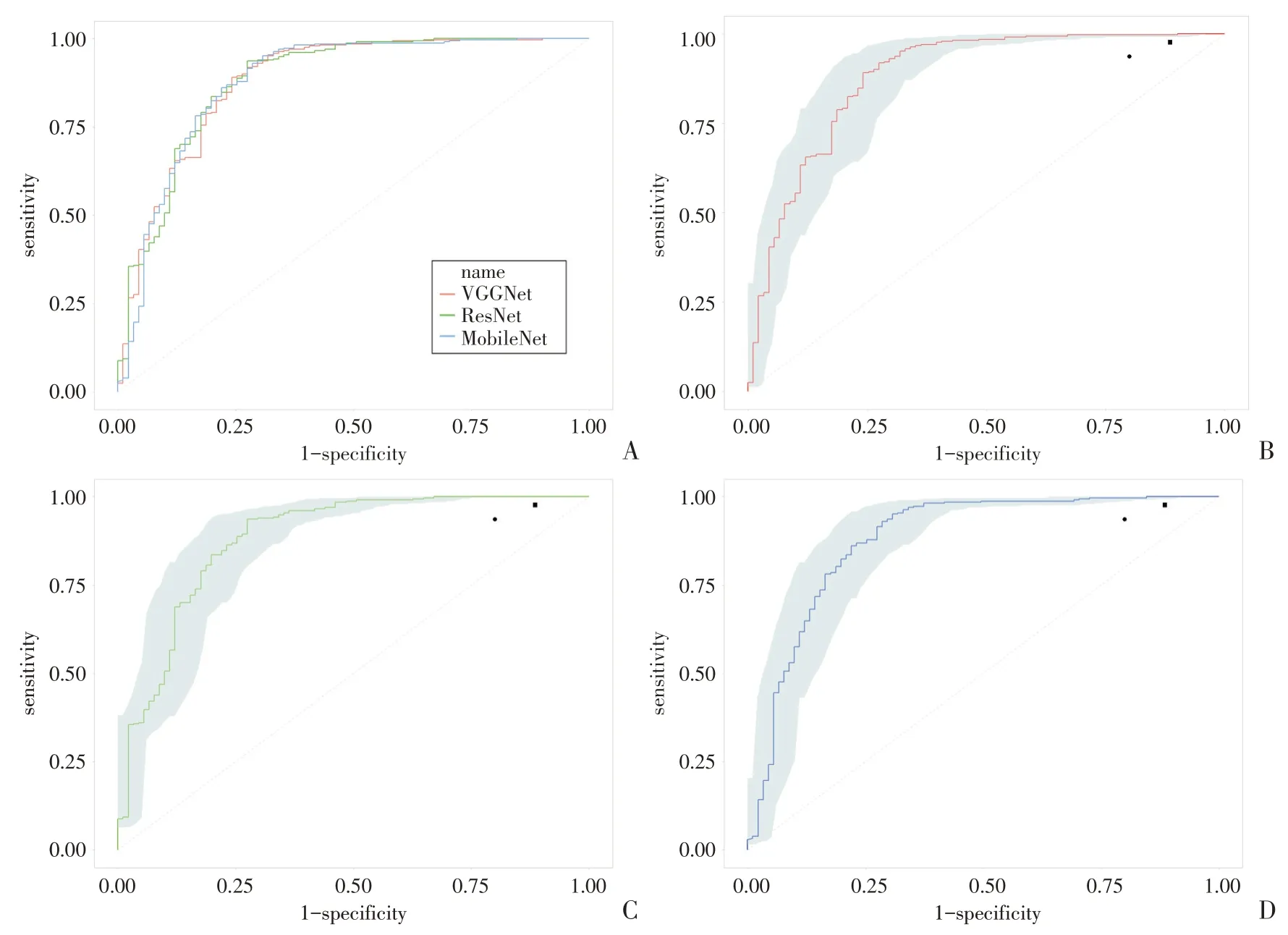
图2 VGGNet、ResNet 和MobileNet 诊断模型的ROC 图及其与两名心电生理专科医师的对比图[VGGNet 的ROC 为红色,ResNet 的ROC 为绿色,MobileNet 的ROC 为蓝色,黑色圆点代表医师1 的敏感度和特异度,黑色方点代表医师2 的敏感度和特异度;(A)展示了3 种CNN 模型的ROC 图;在(B)、(C)和(D)中,蓝色阴影区域代表ROC 的95%置信区间;圆点和方点均位于各ROC 95%置信区间的下方,说明医师1 与医师2 的诊断效能低于3 种CNN 模型]
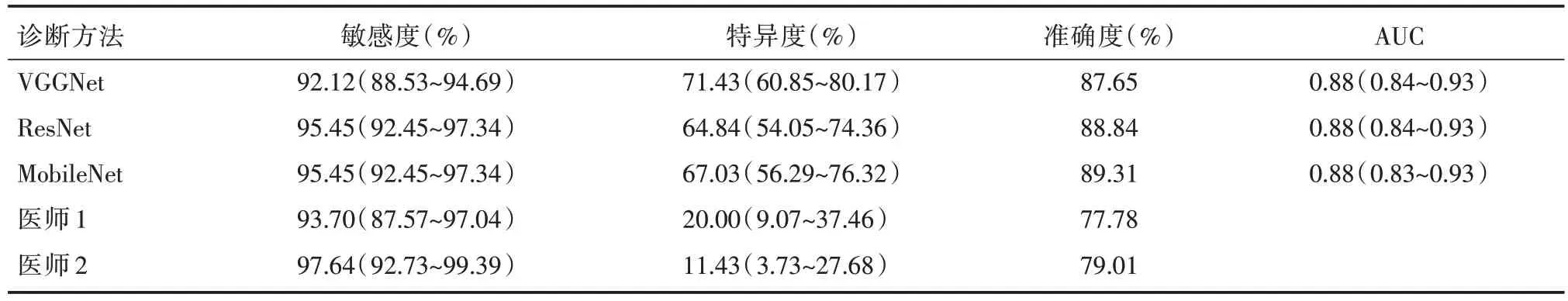
表1 3 种CNN 模型和两名心电生理医师对RVOT 起源PVC 诊断的敏感度、特异度、准确度和AUC
结合LVOT 患者的心电生理检查结果,以右冠窦起源部位和非右冠窦起源部位划分,3 种CNN模型和两名医师的诊断结果如表2 和表3 所示。在VGGNet、ResNet 和MobileNet 以及两名心电生理专科医师诊断错误的LVOT 中,右冠窦起源部位分别占46.15%、53.13%、56.67%、60.71%和61.29%,均比纳入患者31.87%的占比高,除右冠窦外,其余起源部位的差异有统计学意义(P<0.05)。在右冠窦起源部位的诊断中,VGGNet、ResNet 和MobileNet的准确度分别为58.62%、41.38%和41.38%,均比两名心电生理专科医师高(10.53%和0%),差异具有统计学意义(P<0.05)。
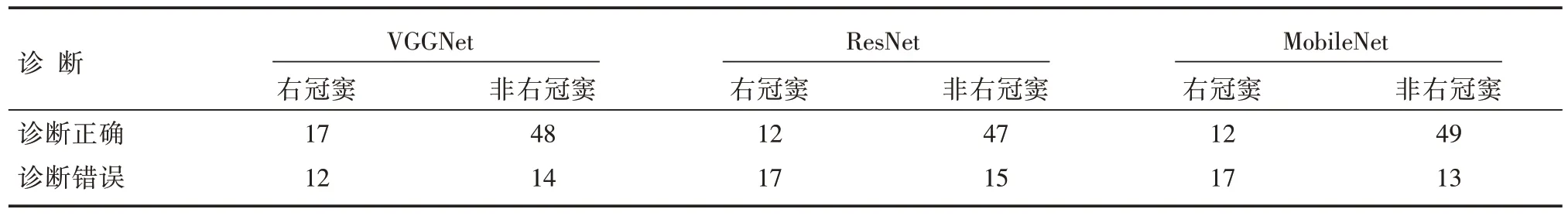
表2 3 种CNN 模型对LVOT 的定位诊断结果[n]
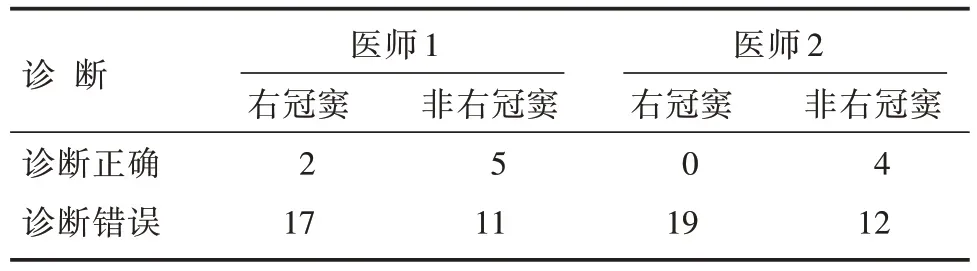
表3 两名心电生理专科医师对LVOT 的定位诊断结果[n]
3 讨论
随着计算机科学的蓬勃发展,AI 被应用到越来越多的医学领域,无论是在影像组学[8]还是病理图像[9]的识别和鉴别诊断中,AI 都展示出了其强大的图像处理和分类能力。近年来,也有研究将AI 应用于心电图的分析,研究显示AI 能够成功地对高血钾[10]和心肌肥厚[11]患者的心电图进行识别诊断。还有研究应用AI 来分析阵发性心房颤动患者窦性心律时的心电图[7],显示AI 能够成功地识别出心房颤动患者,提升了心电图对阵发性心房颤动的诊断价值。但目前国内、外将AI 应用于PVC 起源部位定位诊断的研究仍非常少。2013 年Soheilykhah 等[12]率先使用了小波变化技术处理心电信号,并使用支持向量机的方法对PVC起源部位进行分类(LVOT、RVOT 间隔部、右心室基底部、RVOT 游离壁和主动脉窦),达到了88.4%的准确度。2020 年He 等[13]进一步对比了支持向量机、随机森林、梯度提升决策树、高斯朴素贝叶斯等4 个网络模型,发现对PVC 起源部位(RVOT、LVOT 等共11 个部位)的定位诊断准确度可达到70.7%~74.1%。但这些传统神经网络不是深度学习神经网络,必须在训练前人工定义PVC 的定位诊断特征(如QRS 波群高度、宽度等),耗时费力,且诊断效果不理想。2018 年Yang 等[14]尝试使用CNN结合模拟导联心电信号对PVC进行定位诊断,在9 例患者各自的模拟心脏中的平均定位误差为11 mm。但该研究每例患者需进行208 个电极的心电检查,步骤繁琐,且存在样本数较少,需要行核磁共振或计算机断层扫描等问题,难以在临床工作中推广。
正确定位OTPVC 起源于RVOT 或LVOT,可以指导射频消融手术中动脉或静脉的入路选择,能节省手术时间、减少穿刺口、减少无效消融导致的心肌损伤并降低血管并发症等手术并发症的发生率[4]。这尤其在儿童射频消融手术中具有重要的临床指导意义。在儿童中,股静脉和股动脉内径均较成人小,目前指南推荐的手术指征是要求患儿体质量≥15 kg,如果体质量过小,尤其在经动脉入路时,更容易出现血管并发症。在患儿体质量处于临界值时,室性期前收缩的起源定位就显得尤为重要。
目前临床医师常用V1导联束支阻滞形态和V2导联移行两个心电图特征来进行OTPVC 的左右侧定位诊断[3],例如左束支阻滞形态提示PVC起源于RVOT,右束支阻滞形态提示PVC 起源于LVOT 等。本研究两名心电生理专科医师也以此特征作为主要诊断标准。但这些特征的诊断准确度会受到导联位置、心脏结构及心脏转位等因素影响[5]。2014 年Yoshida 等[6]提出使用SV2/RV3指数(即V2导联S 波振幅/V3导联R 波振幅)来鉴别OTPVC,SV2/RV3指数≤1.5 提示PVC 起源于LVOT,具有89%的敏感度和94%的特异度。2018年Cheng等[15]结合右胸导联提出使用V3R/V7指数(即V3导联的R 波振幅/V7导联的R 波振幅),以V3R/V7指数≥0.85 为界值,其对LVOT 的诊断敏感度为87%,特异度为96%。以上这些方法都能够进一步提高OTPVC 的诊断准确度,但这些方法计算复杂、难以掌握,不便于临床应用。本研究结果显示,两名医师对OTPVC 的诊断准确度为77.78%和79.01%,与以往各研究结果相近。但两名医师对LVOT 的诊断能力明显较低,特异度仅为20%和11.43%。临床医师对右冠窦起源部位的PVC 进行定位诊断往往较困难,在本研究中,两名心电生理专科医师共将24 例主动脉右冠窦起源的PVC 错误诊断为RV⁃OT 起源。在解剖上,RVOT 位于主动脉根部的左前方并与主动脉根部相毗邻,主动脉右冠窦在LVOT 中较其他部位更靠近RVOT[16]。这些解剖特点会造成右冠窦起源部位在心电图上的V1、V2导联R 波持续时间更长,R/S 比值更高[6],导致V2导联移行更靠后,并且常表现为左束支阻滞形态。因其与RVOT 起源PVC 的心电图特征表现相似,临床医师难以分辨二者的微小差别,所以位于LVOT 的主动脉右冠窦起源的PVC 容易被临床医师错误地诊断为起源于RVOT。本研究结果显示,CNN 模型在对OTPVC 的PVC 的诊断中,尤其是在LVOT 起源的PVC 中,表现明显较临床医师好,可以更准确地指导临床选择首选入路,能够指导临床医师准确地识别LVOT 起源PVC 的患儿,减少血管并发症的发生率。另一方面,本研究纳入患者的起源部位定位均以射频消融有效为标准,在此基础上建立的CNN 模型,其诊断结果可以视为“进行射频消融有效”的部位,而无需考虑出口的方向,这与临床需要是相符的。
1998 年Lecun 等[17]开创性地建立了现代CNN学科。CNN 使用局部感受野和共享权重、偏置的方法大大减少了计算参数,并使用了池化层结构来简化从卷积层输出的信息,形成了一个能够利用图像空间结构的架构,尤其适用于图像分类问 题。本研 究 采用的VGGNet[18]、ResNet[19]和MobileNet[20]均是目前主流的CNN 架构,其在视觉识别和图像分类领域的强大能力得到了广泛的认可。VGGNet 是由牛津大学计算机视觉组(visual geometry group,VGG)研发,该架构结构简洁,泛化性能好,是图像识别项目的主流CNN 架构之一。其使用了较深的网络结构和较小的卷积核,既可以保证感受野,又能够减少卷积层的参数,对图像特征的学习能力更强。另外,VGGNet 使用了较小的池化核,让池化层能够捕捉更细节的图像信息。ResNet 的特点是在每个训练模块的输入和输出之间建立了一个旁道而形成残差模块,解决了过深的学习网络导致准确率下降的问题,在医学图像识别中的应用也日渐增多。而MobileNet则是一款轻量化神经网络,它使用了深度可分离卷积层来减少传统卷积层的参数和计算量,并使用了具有线性瓶颈的倒置残差结构保留了更多的信息,加快了网络的运算速度,能够较容易移植于移动端。本研究结果显示,VGGNet、ResNet 和MobileNet 3 种诊断模型对OTPVC 的定位诊断效能均比两名心电生理专科医师的诊断效能高,尤其是对起源于LVOT 的PVC 的定位诊断优势更加明显。不同于临床医师主要依据V1导联束支阻滞形态和V2导联移行等心电图特征来对OTPVC 进行定位诊断,CNN 能够对输入心电信号的每一个电压值都进行学习,每一个电压值都会产生一个权重和偏置,相当于CNN 学习了上千个心电图特征,并且能够通过梯度下降算法和反向传播训练来不停地调整每一个特征的重要性,从而获得能够对OTPVC 进行定位诊断的算法模型。与临床医师相比,CNN 对心电信号的识别明显更加精细,因此,能够鉴别诸如起源于LVOT 主动脉右冠窦的PVC 和起源于RVOT 的PVC 的心电信号微小差异,能更精准地对OTPVC 进行定位诊断。且CNN模型为全自动化诊断,极大地缩短了进行定位诊断需要的时间,也消除了不同诊疗水平医师之间的诊断能力差异。将来可以进一步将CNN 模型与心电图机进行适配,把诊断模型算法移植到心电图机中,患者完成心电图检查即可输出诊断结果,具有较高的临床推广应用价值。
本研究具有一定的局限性:本研究构建的CNN 诊断模型在LVOT 起源PVC 的诊断方面优于心电生理专科医师,在RVOT 起源PVC 的诊断方面与专科医师的诊断效能相同,在今后的研究中,仍需继续扩大样本量,进一步提高AI 定位诊断模型的诊断效能。另一方面,本研究纳入的患者主要为成人患者,所得诊断模型在儿童相关心律失常中的应用意义仍需进一步完善。
综上所述,本研究成功构建了3 种基于CNN的OTPVC 心电信号的AI 定位诊断模型,构建的AI诊断模型均具有良好的诊断效能,有望在体表心电信号定位诊断中发挥重要作用。
利益冲突:所有作者均声明不存在利益冲突。
