小婴儿室间隔缺损修补术后左心室肌力指数和外周血管阻力指数的随访评估△
2022-04-26陈晓博何少茹郑曼利刘玉梅孙云霞陈寄梅
陈晓博,何少茹,郑曼利,孙 新,刘玉梅,孙云霞,陈寄梅,庄 建
[1.广东省人民医院(广东省医学科学院)新生儿科,广州 510080;2.广东省心血管病研究所心外小儿科广东省人民医院(广东省医学科学院),广州 510080]
室间隔缺损(ventricular septal defect,VSD)约占小儿先天性心脏病(先心病)总数的25%~40%[1]。中-大型缺损目前仍首选外科手术治疗[2-4]。近年来先心病外科手术发展迅速,多数VSD修补术后的小婴儿,可在术后2 周内达到临床治愈出院[5-6],但出院时心血管各项血流动力学指标尚未恢复正常。目前关于小儿室间隔修补术后患儿左心功能的评价,多数局限于左心室、左心房的大小及左心室射血分数、短轴缩短率等功能指标[7-8],缺乏对左心室心肌收缩力和后负荷的直接评价。因此,本研究选取室间隔修补术后临床症状已稳定、临出院时的小婴儿为研究对象,采用超声心排血量监测仪(ultrasonic cardiac output monitor,USCOM)监测其术后7~10 d、术后3个月、术后6个月的血流动力学指标,重点评估小婴儿VSD修补术后左心室肌力指数(Smith-Madigan inotropy index,SMII)和外周血管阻力指数(systemic vascular resistance index,SVRI)的变化特征,为术后随访和药物治疗提供指导,并探索USCOM 作为患儿术后随访检查的一种新方法的可行性。
1 资料和方法
1.1 一般资料
本研究为前瞻观察性研究,选取2011 年10 月至2013 年7 月在广东省人民医院儿童重症监护室(PICU)和新生儿重症监护室(NICU)住院且已成功接受外科修补术的VSD 小婴儿36 例为研究对象。所有患儿的入选及相关检查,获广东省人民医院机构审查委员会的批准,且经患儿家长的同意。入选标准:(1)术后7~10 d;(2)已撤离呼吸机;(3)术后复查超声心动图示VSD 残余分流<2 mm;(4)已停止静脉用血管活性药物,病情稳定待出院。排除标准:(1)术后超声心动图发现存在主动脉瓣或肺动脉瓣膜畸形(明显狭窄或反流),合并心内分流或大血管异位等其他先天结构异常;(2)全身情况差,如合并重症感染、败血症;(3)合并严重的心律失常(如完全性房室传导阻滞等)。所有患儿术后均予常规口服地高辛强心0.01 mg/(kg·d)、安体舒通利尿(3 mg/(kg·d)、卡托普利扩张血管(0.5~2.0 mg/(kg·d)治疗1 个月。
1.2 检查方法
采用USCOM 分别对VSD 修补术后的小婴儿在术后7~10 d(待出院时)、术后3 个月、6 个月3 个时间点进行血流动力学随访检查。血压的测定使用GE公司生产的DINAMAP®Procare 100血压计配合小婴儿手臂袖带完成。记录每例患儿在术后3个时间点测得的左心室SMII、SVRI、心率(HR)、每搏输出量指数(stroke volume index,SVI)、心脏指数(cardiac index,CI)等各项血流动力学指标。每公斤左心排血量(left ventricular output,LVO)由公式:LVO=心排血量(cardiac output,CO)/体质量(wt)计算出。
1.3 随访方法
采用返院复诊的方式进行随访,所有患儿于术后3 个月、6 个月在门诊使用USCOM 随访检查。随访截至2014 年1 月31 日。
1.4 统计学分析
采用SPSS 17.0软件和GraphPad Prism 9进行数据分析和作图。符合正态性分布的数据以()表示,偏态分布的计量资料以中位数[M(P25~P75)]表示。计数资料以[n(%)]表示。前后各时间点的各项血流动力学指标比较采用方差分析,进一步组间多重比较采用Bonferroni法。与术后3个月时相比,随访至6 个月时数值缺失率小于10%,采用均数填补后分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 患儿的临床资料
36 例VSD 修补术后小婴儿,男24 例,女12 例;月龄3(1~5)个月,体质量(4.32 ± 0.87)kg。术前超声心动图检查提示膜周部VSD 32 例,肌部VSD 2 例,干下型VSD 2 例。外科术中所见:VSD 大小为8.75(8.00~10.00)mm。35例(97%)伴有中-重度肺动脉高压。其中合并卵圆孔未闭(PFO)20例,合并房间隔缺损(ASD)9 例、合并动脉导管未闭(PDA)2 例,术中均予补片修补或结扎、缝闭。术后1 周左右复查超声心动图提示VSD 外科修补术后残余漏10 例,大小均<2 mm,术后6 个月复查超声心动图提示残余漏3 例,大小均<2 mm。所有患儿术后均未发生严重的心律失常。患儿部分临床资料详见表1。
表1 VSD 患儿的临床资料[n=36,n(%),M(Q1~Q3),]
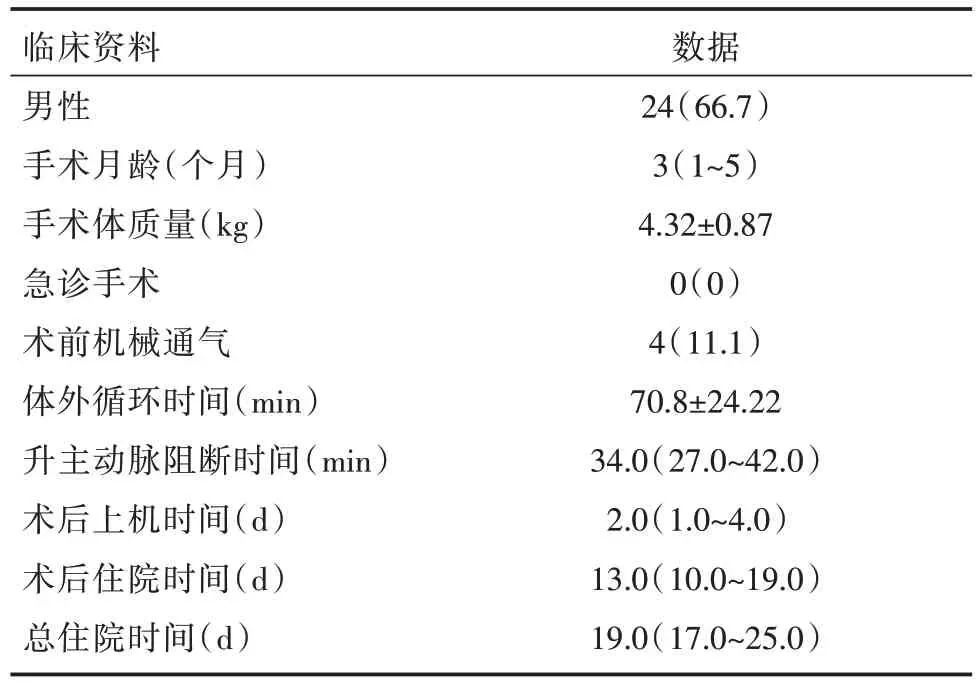
表1 VSD 患儿的临床资料[n=36,n(%),M(Q1~Q3),]
2.2 随访情况
术后3 个月随访率为89%(32/36);术后6 个月随访率为81%(29/36)。随访至术后6 个月时共死亡2 例,其中1 例在术后2 个月左右死于肺部感染引起的败血症、心力衰竭;另1 例在术后5 个月左右死于神经系统疾病。所有患儿行USCOM 随访检查时均无气促、心率增快、肝大、水肿等心力衰竭表现,并同时进行超声心动图检查,左心室射血分数、短轴缩短率均在正常范围内。
2.3 小婴儿室间隔缺损修补术后早-中期的心功能指标变化情况
小婴儿VSD 修补术后3 个时间点测得的血流动力学指标变化详见表2,图1A~图1E。左心室SMII 在术后3 个月较术后7~10 d 明显下降,差异有统计学意义(P<0.05);术后6 个月与术后3 个月比较,差异无统计学意义(P>0.05)。SVRI 在术后3 个月较术后7~10 d 有下降趋势,但差异无统计学意义(P=0.072);术后6 个月较术后3 个月升高,差异有统计学意义(P<0.01)。LVO 在术后3 个月较术后7~10 d 明显下降,差异有统计学意义(P<0.05);术后6 个月继续下降,差异有统计学意义(P<0.001)。CI 术后3 个月与术后7~10 d 比较,差异无统计学意义(P>0.05);到术后6 个月时出现明显下降,差异有统计学意义(P<0.01)。心率在术后6 个月内持续下降(P<0.01)。
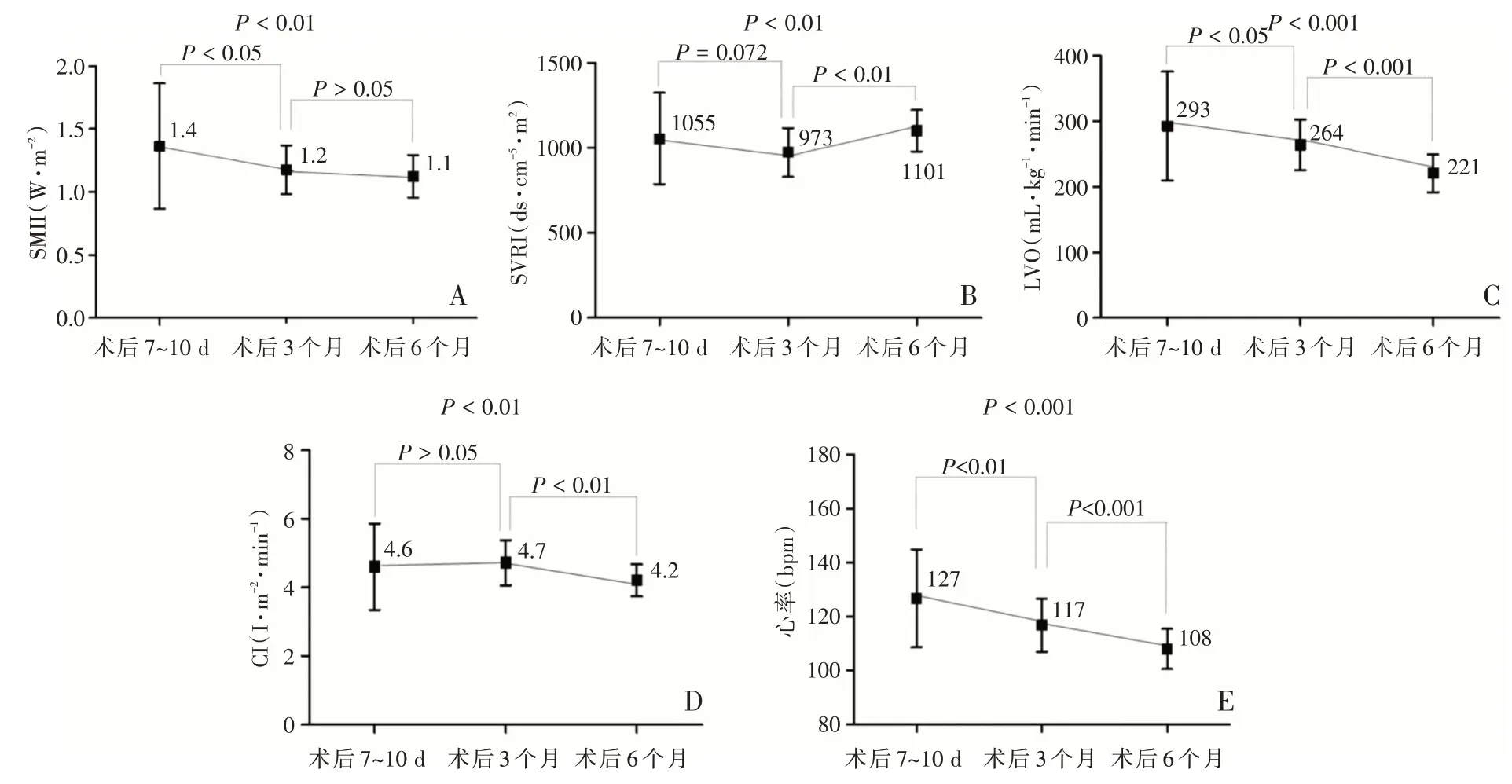
图1 VSD 修补术后3 个时间点SMII、SVRI、LVO、CI 和心率比较的盒形图(A 为VSD 修补术后3 个时间点SMII 的比较;B 为VSD 修补术后3 个时间点SVRI 的比较;C 为VSD 修补术后3 个时间点LVO 的比较;D 为VSD 修补术后3 个时间点CI 的比较;E 为VSD 修补术后3 个时间点心率的比较)
表2 小婴儿VSD 修补术后7~10 d、3 个月、6 个月时心功能指标的比较[n=32,M(Q1~Q3),]
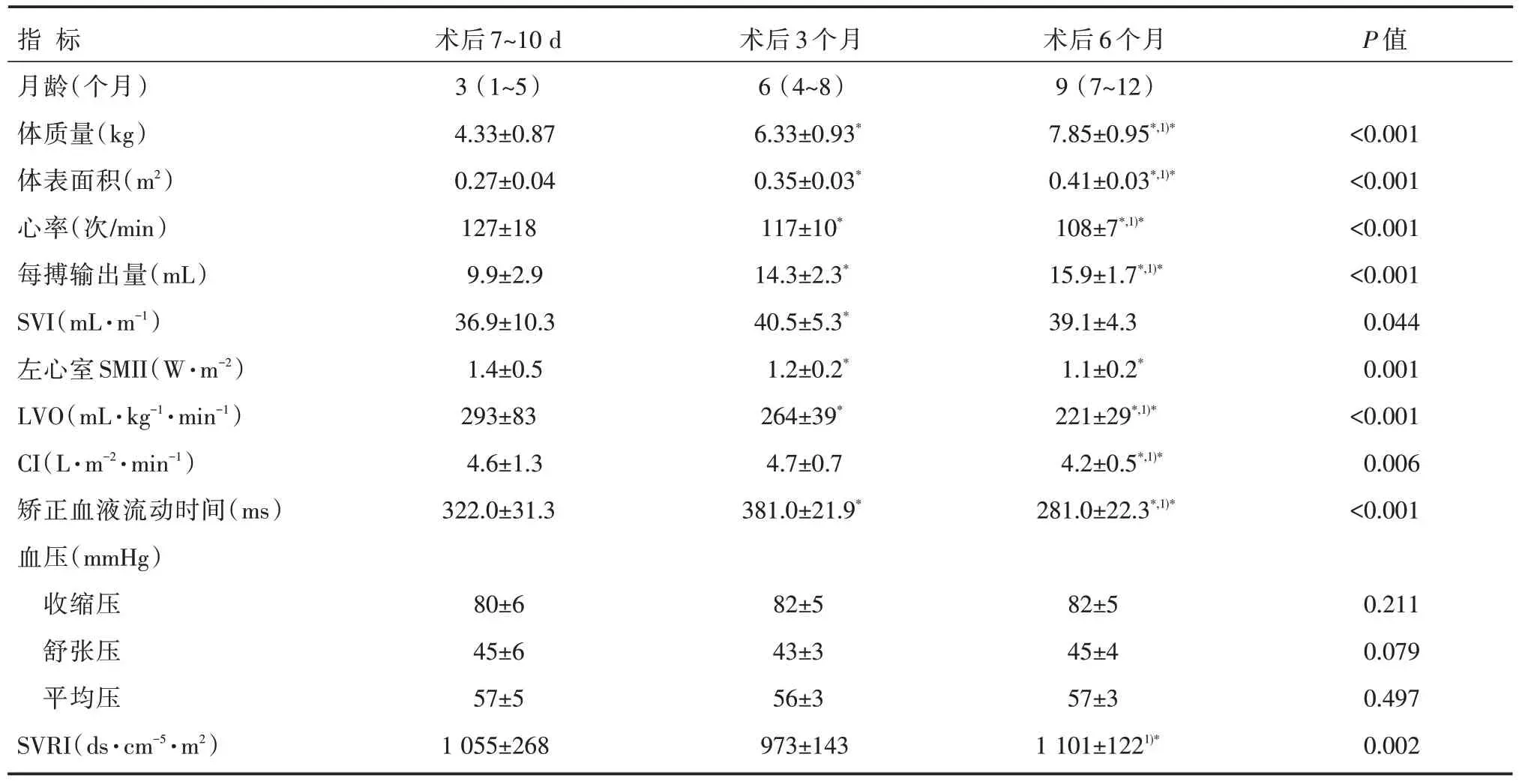
表2 小婴儿VSD 修补术后7~10 d、3 个月、6 个月时心功能指标的比较[n=32,M(Q1~Q3),]
注:与术后7~10 d 比较,*P<0.05;与术后3 个月比较,1)*P<0.05;1 mmHg=0.133 kPa
3 讨论
VSD 患儿因持续存在心室水平左向右的分流,导致肺循环的血流量增加,回流至左心房与左心室的血流量相应增加,左心房、左心室扩大,血流动力学的早期改变是以左心容量超负荷为主。VSD 分流量的大小和方向取决于VSD 的大小和体、肺血管床阻力的相对大小。中-大型缺损(直径≥5 mm)左向右分流量大,肺与体循环的血流量之比常大于2.5∶1,尤其是大型缺损(直径>10 mm)肺血流量超过肺血管床的容量限度,出现容量性肺动脉高压,继而肺小动脉痉挛,肺小动脉中层和内膜逐渐增厚,管腔变小,渐变为不可逆的阻力性肺动脉高压,同时左心容量超负荷更加严重,导致左心房、左心室明显扩大、心肌肥厚[1]。本组患儿VSD大小为8.75 mm(8.00~10.00 mm),属于中-大型VSD,术前97%伴有中-重度肺动脉高压,左心房扩大、左心室重构明显。随着小儿先心病外科手术的发展和围术期重症监护水平的提高,即使是中-大型VSD,多数患儿可在术后1~2 周达临床出院标准。但出院时患儿左心各项血流动力学指标并未恢复至正常水平,需要出院后继续药物治疗和定期随访,我们前期的研究也证实了这一点[9],同时也验证了USCOM 这种无创简便的血流动力学监测设备,在用于测定小婴儿VSD 修补术后左心排血量时准确性好[10]。因此,本研究继续使用USCOM 随访观察小婴儿VSD 修补术后出院至术后6 个月内左心功能的变化,重点评价左心室心肌收缩力和后负荷的变化特点。
心率反映心脏的基础功能状态。本研究患儿的心率在术后7~10 d 时为(127±18)次/min,术后3 个月时心率明显下降至(117±10)次/min,随访至术后6 个月时心率进一步下降至(108±7)次/min。心率逐渐减慢表现为时间依赖性,有两方面因素影响。一方面由于患儿术后心功能逐渐好转,机体交感神经活性较前下降[11],导致心率逐渐变慢;另一方面随着患儿月龄的增长,自身迷走神经发育逐渐成熟,心率与年龄呈现负相关关系。患儿术后的心率改变表现为正常小儿的变化趋势,提示基础代谢状态的好转。
左心室SMII 是一项直接反映左心室心肌收缩力的指标,不依赖于前负荷、后负荷[12]。根据我们前期的研究结果[9],VSD 修补术后患儿出院前的SMII 较健康对照组明显升高[(1.4±0.4)W·m-2vs.(1.1±0.2)W·m-2],心肌表现为高动力状态,现随访至术后3 个月时发现SMII 下降至(1.2±0.2)W·m-2,前后比较差异有统计学意义(P<0.05),反映VSD修补术后随着左向右分流的消失,左心室容量超负荷得到纠正,扩张的心室逐渐恢复、左心室心肌纤维逐步回缩,使得因代偿增加的左心室心肌收缩力逐渐恢复。继续随访至术后6 个月,SMII 未见继续下降,可能与术后3 个月SMII 已接近正常有关,延长随访时间,已接近正常水平的心室肌难以进一步明显缩小。文献报道有关VSD 外科手术修补术后或内科介入封堵术后心脏形态结构的改变也与此基本相符。任敏等[13]采用超声瞬时波强(WI)技术对42 例VSD 患者封堵前后左心功能的变化进行随访,发现术后3 d 左心室代偿收缩功能增强没有明显恢复,术后3 个月时左心室内径基本恢复至正常范围,左心室收缩功能也得到恢复,与健康对照组没有明显差异。郑昭芬等[14]使用超声心动图观察了30 例VSD 患者封堵术前、术后一段时间的左心室形态结构变化,发现封堵术后第3 天左心室舒张末期内径(LVEDD)、左心室舒张末期容积(LVEDV)较术前缩小,术后3 个月、术后6 个月随访时,左心室舒张末期内径与左心室舒张末期容积进一步缩小。
LVO 和CI 是临床上用于评价心功能的常用指标,但二者均取决于心率、心肌收缩力及前后负荷等多种因素的影响,不能直接反映心肌收缩力的大小。根据前期研究结果,VSD 修补术后患儿出院前的LVO 较健康对照组明显偏高,而CI 与健康对照组比较,差异无统计学意义(P>0.05)。本研究结果显示,LVO 在术后7~10 d 时为(293±83)mL·kg-1·min-1,随访至术后3 个月时为(264±39)mL·kg-1·min-1,较前明显下降,差异有统计学意义(P<0.05),考虑主要与术后心肌收缩力回降、心率下降有关;至术后6 个月时进一步下降至(221±29)mL·kg-1·min-1,考虑与术后心率进一步下降、SVRI 回升有关;LVO 变化趋势与SMII保持基本一致。而CI 在术后7~10 d 时为(4.6±1.3)L·m-2·min-1,随访至术后3 个月时较前无明显变化(P>0.05),继续随访至术后6 个月出现明显降低(P<0.01),考虑为心率下降、前负荷(FTc 可反映前负荷的大小[12])下降、后负荷升高综合作用的结果,在反映心肌收缩力方面的敏感性较LVO更低。
SVRI是反映血管功能的重要指标[15-16],代表左心室的后负荷。虽然超声心动图仍是目前小儿先心病诊断及随访的主要方法[17-18],可以发现血管有无狭窄、畸形,通过测量血管内径、血流速度及压差估计狭窄的程度,但无法直接测出外周血管阻力的具体数值,因此,目前文献报道缺乏对VSD 术后外周血管阻力变化的研究。本研究发现SVRI 在VSD 修补术后7~10 d 时为(1 055±268)ds·cm-5·m2,随访至术后3 个月时为(973±143)ds·cm-5·m2,较前差异无统计学意义(P=0.072),可能与样本量小有关,但有下降趋势,分析其原因可能有两方面:(1)VSD 患儿术后心功能好转,原本增强的交感神经及内分泌活动减弱,引起外周血管的紧张性下降[11];(2)术后利尿扩管药物减弱交感活性、舒张血管作用。继续随访至术后6 个月时,SVRI 为(1 101±122)ds·cm-5·m2,较术后3 个月时升高,差异有统计学意义(P<0.05),此时考虑患儿的外周血管功能已符合正常小儿血管的功能特点,随着年龄的增长,血管管壁的硬度增加、血管阻力增加,多项研究已证实这一生理性血管机制的存在[19-20]。结合前期的研究结果,VSD 修补术后患儿出院前的舒张压较健康对照组有升高,差异有统计学意义(P<0.05),考虑外周血管紧张性偏高,而SVRI 与健康对照组比较差异无统计学(P>0.05)。本研究中术后3 个月时舒张压、外周血管阻力指数均与术后7~10 d 时比较,差异无统计学(P>0.05),因此,考虑VSD 患儿的血管功能在术后3 个月内可能已恢复至正常水平,当然针对每个患儿仍需个体化监测。
综上所述,本研究总结了VSD 修补术后小婴儿的左心功能在出院至术后6 个月内的变化特点。在术后3 个月内,SMII、SVRI 均从早期的偏高水平,呈现不同程度的下降过程;继续随访至术后6 个月,SMII 维持不变,SVRI 出现生理性升高;LVO、CI 和心率在术后6 个月内从术后早期的偏高水平逐渐下降。使用USCOM 对VSD 修补术后患儿的左心功能进行个体化评估,指导出院后患儿合理用药,对提高临床治疗效果意义重大。本研究有以下两个方面局限:(1)未收集术后1 个月的无创血流动力学参数,对明确术后口服药物对血流动力学的影响存在困难;(2)缺乏同月龄健康小婴儿的血流动力学指标作对照。后续本课题组将纳入上述临床和无创血流动力学数据进一步研究。
