PD-1抑制剂对小鼠肺组织炎症微环境及损伤的影响*
2022-04-26曹丽吴碧波周开艳耿一超刘凌枫王刚旷华香卢冰苏胜发
曹丽,吴碧波,周开艳,耿一超,刘凌枫,王刚,旷华香,卢冰,苏胜发
550004 贵阳,贵州医科大学附属医院 肿瘤科;550004 贵阳,贵州医科大学附属肿瘤医院 肿瘤科
药物治疗在恶性肿瘤的治疗中占有重要地位,化疗、靶向治疗和内分泌治疗已在恶性肿瘤的治疗中应用多年。近年来,以程序性死亡受体1(programmed death 1, PD-1)抑制剂为代表的免疫检测点抑制剂,也已成为恶性肿瘤的主要治疗方法之一,提高了肿瘤治疗疗效。
PD-1抑制剂通过阻断T细胞上PD-1受体与其配体PD-L1的结合,活化T细胞,增强T细胞对肿瘤的免疫应答,而发挥抗肿瘤作用。同时,PD-1 抑制剂也会导致免疫系统过度激活,引起机体各系统组织产生免疫相关不良反应(immune-related adverse event,irAE),包括皮肤反应、免疫性肺炎、免疫性心肌炎、免疫性肝炎、免疫性肠炎、甚至神经系统炎症等[1]。随着PD-1抑制剂临床应用的推广,irAE日益受到重视。
Nishino等[2]对20项PD-1抑制剂临床试验,包括黑色素瘤、非小细胞肺癌(non-small cell lung cancer,NSCLC)、肾癌等4 496例病例进行Meta分析发现,免疫性肺炎的发生率约2.7%,3级及以上肺炎发生率为0.8%。免疫性肺炎的发生率虽然较低,但严重的irAE以免疫性肺炎更为常见,导致治疗中断甚至危及生命[3]。有文献报道,在真实世界中免疫性肺炎的发生率可高达20%,3级及以上肺炎发生率为3.4%[4-5]。探索免疫性肺炎的发病机制,对免疫性肺炎的防治具有重要的临床意义。鉴于临床上获取组织标本研究免疫性肺炎困难,本研究拟采用小鼠模型观察PD-1抑制剂对肺组织炎症微环境及损伤的影响,初步探索其潜在机制。
1 材料与方法
1.1 主要仪器设备及试剂
Navios流式细胞仪(中国广州流式生物科技有限公司)、多功能酶标仪(美国伯腾仪器有限公司),PD-1抑制剂(InVivoMAb anti-mouse PD-1,Bio X cell Co. Ltd. USA BE0146)、同种型对照IgG抗体(InVivoMAb anti-mouse IgG2a isotype control,Bio X cell Co.Ltd.USA BE0085)、兔抗鼠CD3、CD4、CD8抗体(武汉赛维尔生物科技有限公司)、辣根过氧化物酶标记山羊抗兔IgG(武汉赛维尔生物科技有限公司),多因子(包含 IL-4、IL-6、IL-17A、TNF-α、TGF-β1、IFN-γ因子)检测试剂盒(美国BioLegend公司)、羟脯氨酸试剂盒(南京建成生物工程研究所有限公司),HE染色及Masson染色试剂盒购自武汉赛维尔生物科技有限公司。
1.2 动物分组及处理
15只健康状况良好的C57BL/6小鼠,月龄6~8周,体重20~25 g,各种反射正常,养殖于贵州医科大学SPF级动物基地[合格证号:SCXK(黔)2018-0001],颗粒饲料喂养,自由进食及饮水,清洁舒适环境(温度:23~25℃,湿度:45%~55%)。随机分为3组,每组5只;A 组为正常对照组,B 组为IgG组,C 组为PD-1抑制剂组。用药剂量参考文献给予[6-7],PD-1抑制剂给药方法:第1、2、3周每周给予PD-1抑制剂200 μg+1 mL生理盐水腹腔注射,随后每周给予PD-1抑制剂100 μg+1 mL生理盐水腹腔注射,连续3周;IgG给药方法:给药时间点、剂量与给药途径同PD-1抑制剂;A组在相同的时间点,通过相同途径给予等量的生理盐水。
1.3 标本采集及处理
给药后第7周用6%水合氯醛麻醉处死各组小鼠,取出肺组织,将左肺组织分为两部分。一部分用10%福尔马林溶液固定,常规石蜡包埋,按3 μm厚度切片,用于HE、Masson及免疫组化染色;另一部分用于羟脯氨酸含量测定和流式细胞术检测,剩下的肺组织保存至-80°超低温冰箱保存。
1.4 HE染色
常规石蜡切片脱蜡至水,苏木素染液染3~5 min,水洗、分化液分化、水洗、返蓝液返蓝、冲洗后85%、95%的梯度酒精脱水各5 min,伊红染液染色5 min,无水乙醇脱水透明后中性树胶封片。光学显微镜下观察肺组织形态及病理变化,每张标本随机选取5个不重复视野。
1.5 Masson染色
按照产品说明书进行染色。光学显微镜下观察,经Masson染色后小鼠肺泡上皮细胞被染为红色,胶原纤维被染为蓝色。采用ImageJ图像分析软件进行胶原半定量分析,计算肺组织胶原容积分数(collagen volume fraction,CVF),CVF=视野中胶原面积/视野总面积,每张标本随机选取5个不重复视野。
1.6 免疫组化染色
石蜡切片脱蜡至水,置于微波炉内进行抗原修复,用3%过氧化氢室温孵育25 min阻断内源性过氧化物酶,PBS冲洗后滴加3%牛血清白蛋白室温封闭30 min。然后滴加对应的一抗,4℃孵育过夜。过夜后PBS洗净,滴加对应的二抗,室温孵育50 min。PBS洗净后滴加DAB显色液染色3 min,染色结束后进行苏木素复染3 min左右,最后将切片脱水透明、中性树胶封片。经染色后细胞核为蓝色,阴性对照以PBS代替一抗,DAB显出的阳性表达为棕黄色。镜下采图,每张切片随机选取5个视野,采用ImageJ图像分析软件对肺组织切片进行分析,求得每个视野下CD3、CD4、CD8着色的平均光密度值(average optical density,AOD),AOD=累积光密度值/组织面积。
1.7 羟脯氨酸含量测定
称取小鼠肺组织湿重30 mg放入试管中,剪碎加入水解液1 mL、95℃加盖水浴水解20 min,按照试剂盒步骤依次进行操作。羟脯氨酸含量(μg/mg湿重)=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×标准品浓度(5 μg/mL)×水解液总体积(mL)/组织湿重(mg)。
1.8 流式细胞术检测肺组织细胞因子水平
称取小鼠肺组织湿重20 mg,加入PBS 200 μL、苯甲基磺酰氟100 μL,冰上剪碎裂解,匀浆后离心取上清。按照LEGENDplexTMMouse B cell Panel Standard Cocktail,Lyophilized细胞因子检测试剂盒说明书进行操作。取肺组织上清25 μL放入EP管,加入预混Beads及Assay Buffer各25 μL,常温避光孵育2 h,离心弃上清,加入200 μL Wash buffer,离心弃上清,加入检测抗体25 μL,常温避光孵育1 h,加入SA-PE 25 μL,避光孵育30 min,离心弃上清,加入200 μL Wash buffer,离心弃上清,最后每管加入300 μL 1×Wash buffer,上机检测TGF-β1、IFN-γ、TNF-α、IL-4、IL-6、IL-17A等细胞因子。数据用LEGEND plex v8.0软件进行分析。
1.9 统计学处理
采用SPSS 23.0软件进行统计分析,数据符合正态分布的结果以均数±标准差表示,组间比较采用单因素方差分析,进一步两两比较采用最小显著差法,方差不齐时采用Dunnett’s T3方法。P<0.05(双侧)为差异有统计学意义。
2 结 果
2.1 肺组织的病理学观察
2.1.1 HE染色 A组和B组小鼠肺组织结构清晰,肺泡壁纤细,肺泡间隔纤细,肺间质无水肿,C组肺泡间隔增厚,肺间质水肿,可见较多的炎症细胞浸润(图1)。

图1 各组肺组织损伤情况(HE染色,×400)
2.1.2 Masson染色评估肺组织纤维化情况及胶原半定量分析 Masson染色胶原纤维被染为蓝色。A组和B组肺组织结构完整,肺间质未见明显的胶原纤维沉积;C组肺组织正常结构紊乱,肺泡间隔增厚,可见蓝染的胶原纤维沉积(图2)。肺组织胶原半定量分析结果显示: A、B、C各组的CVF分别为4.30%±1.06%、5.10%±1.37%、10.70%±2.83%,组间比较发现A、B两组CVF无明显差异,而C组CVF较A组和B组明显增加,差异具有统计学意义(P<0.01,图3A)。
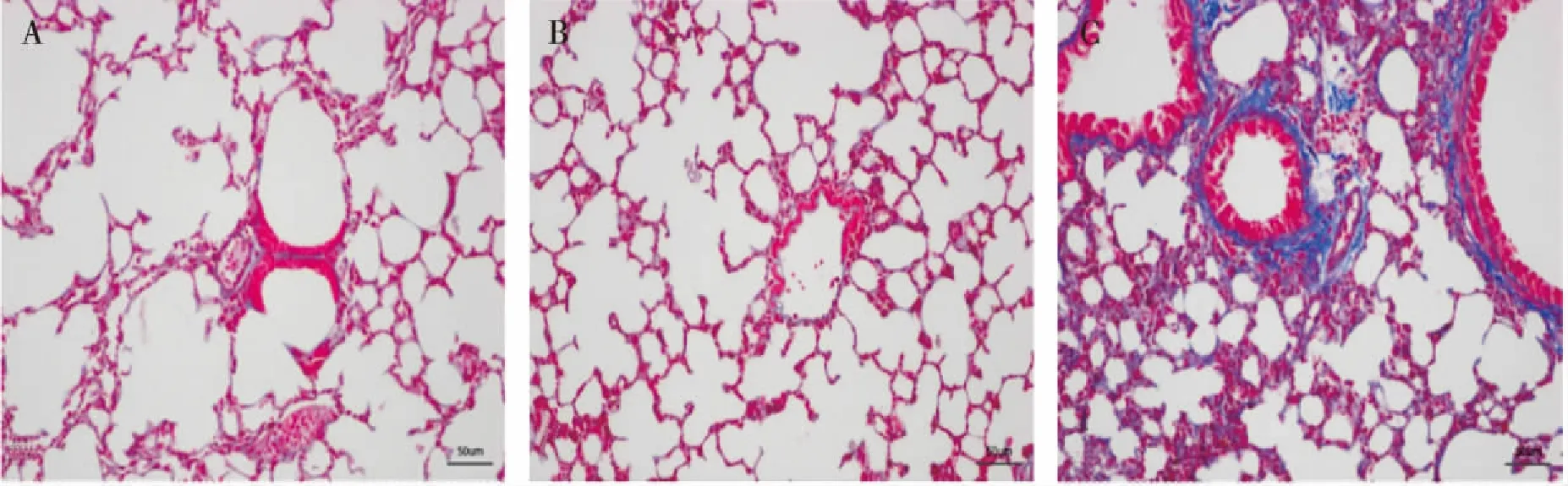
图2 各组肺组织纤维化情况(Masson染色,×200)
2.2 肺组织羟脯氨酸含量测定
A、B、C各组羟脯氨酸含量分别为(0.116±0.090) μg/mg、(0.120±0.013) μg/mg、(0.160±0.013) μg/mg,A组和B组的羟脯氨酸含量相似,C组羟脯氨酸含量较A、B两组增加,差异有统计学意义(P<0.01,图3B)。

图3 胶原半定量分析和羟脯氨酸含量测定
2.3 CD3、CD4及CD8免疫组化染色结果
免疫组织化学染色结果显示,CD3+、CD4+、CD8+细胞染成棕黄色或棕褐色,C组的CD3+细胞浸润增加,且以CD8+细胞为主,而A、B组中浸润的CD3+细胞无明显差别,CD4+细胞浸润在A、B、C三组中相似(图4)。 与A组相比,B组CD3标记AOD值的差异无统计学意义(t=0.194,P=0.848),而C组CD3标记的AOD值较A组(t=5.267,P<0.01)和B组增加(t=5.066,P<0.01),差异有统计学意义。A组与B组CD8标记的AOD值相似(t=0.182,P=0.856),差异无统计学意义,而C组CD8标记的AOD值较A组(t=7.818,P<0.01)和B组(t=7.636,P<0.01)增加,差异有统计学意义。 A组、B组和C组CD4标记的AOD值相似(t=0.245,P=0.784),差异无统计学意义(表1)。

图4 免疫组化显示肺组织淋巴细胞浸润情况
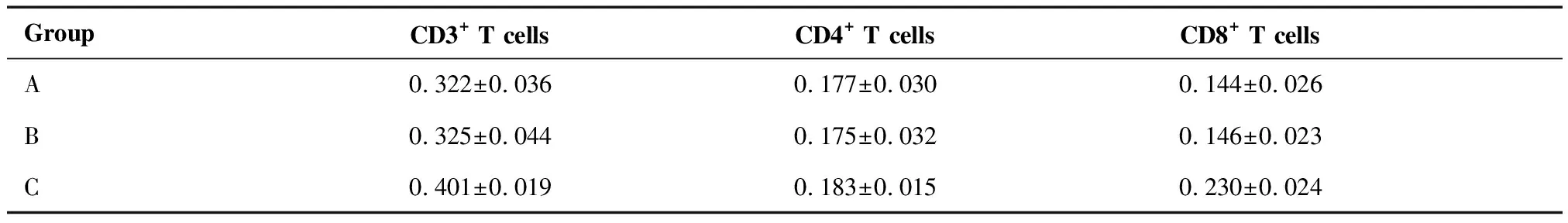
表1 各组肺组织中CD3、CD4及CD8标记的AOD计数结果
2.4 肺组织中细胞因子表达情况
2.4.1 IL-6表达情况 A、B、C组IL-6浓度分别为(13.55±3.45) pg/mL、(12.25±3.25) pg/mL、(35.65±6.13) pg/mL。A组与B组的浓度相似(t=0.460,P=0.654),C组高于A组(t=7.809,P<0.01)和B组(t=8.269,P<0.01),差异有统计学意义(图5A)。
2.4.2 TGF-β1表达情况 A、B、C组TGF-β1浓度分别为(322.50±23.44) pg/mL、(419.33±66.91) pg/mL、(1 019.77±104.17) pg/mL,各组TGF-β1变化趋势与IL-6相似。A组与B组TGF-β1表达的差异无统计学意义(t=2.017,P=0.067),C组TGF-β1仍明显高于A组(t=15.068,P<0.01)和B组(t=13.050,P<0.01),差异有统计学意义(图5B)。
2.4.3 IL-4、IL-17A、TNF-α、IFN-γ表达情况 各组IL-4、IL-17A、TNF-α、IFN-γ表达水平均较低,低于设定的检测范围(IL-4<4.05 pg/mL,TNF-α<4.35 pg/mL,IL-17A<6.21 pg/mL,IFN-γ<5.74 pg/mL)。
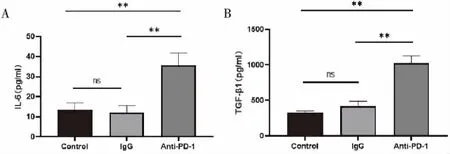
图5 肺组织中IL-6和TGF-β1的表达情况
2.5 小鼠一般状况及体重变化
各组小鼠精神状态、食欲良好,活动正常,至观察时间点各组小鼠均存活。至观察终点A、B、C各组小鼠体重分别为(26.39±3.84)g、(25.47±4.60)g、(27.80±2.64)g,体重变化的差异无统计学意义(t=1.732,P=0.187;图6)。
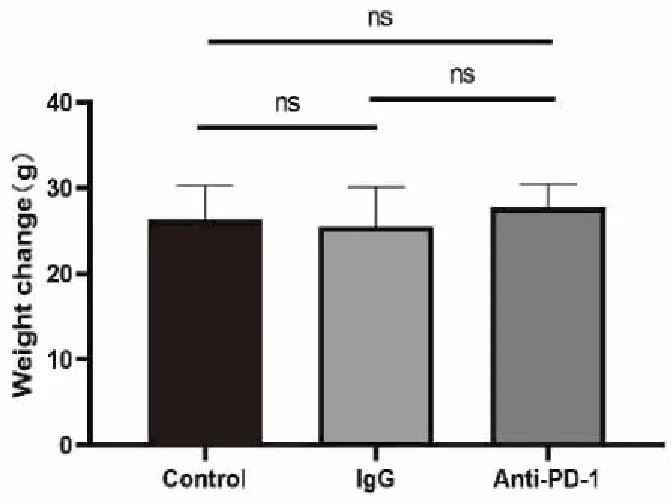
图6 各组小鼠体重变化
3 讨 论
药物治疗在恶性肿瘤的治疗中起着举足轻重的作用,部分抗肿瘤药物可以导致肺损伤。化疗药物中,博来霉素的肺毒性较为常见,可导致患者出现非特异性肺炎和肺纤维化,甚至迅速死于肺纤维化,而其机制尚不完全清楚[8]。多西他赛广泛用于治疗多种实体肿瘤,也可导致罕见且严重的间质性肺炎,可能与I型和IV型超敏反应相关[9]。分子靶向药物表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)间质性肺炎的发生率约5%[10]。PD-1抑制剂可活化T淋巴细胞,导致免疫性肺损伤,有文献报道其发生率约3%~4%[2,11]。
本研究观察了PD-1抑制剂对小鼠肺损伤的影响,并从免疫微环境的角度初探其潜在机制。组织病理观察发现PD-1抑制剂导致小鼠肺泡间隔水肿、增厚,炎症细胞浸润,肺间质胶原纤维沉积增多,羟脯氨酸含量增高,表明PD-1抑制剂可导致的小鼠肺损伤和纤维化。大多数临床研究数据也显示,PD-1抑制剂所致免疫性肺炎的发生率较低(3%~5%),3级及以上肺炎仅约1%[2,11-12]。在临床上PD-1抑制剂单药治疗NSCLC的临床疗效并不理想,整体有效率仅约20%~30%,联合靶向、化疗或放疗的综合模式能够进一步提高疗效[13-14]。PD-1抑制剂单独使用时肺炎发生率虽然较低,需要注意的是PD-1抑制剂联合其它治疗方式可能增加肺损伤的风险,应当引起重视。Oshima等[10]报道,EGFR-TKI联合PD-1抑制剂(nivolumab)时间质性肺炎的发生率高达25.7%,EGFR-TKI联合nivolumab时发生间质性肺炎的风险比单独使用nivolumab增加5.32倍。放射性肺损伤的本质是淋巴细胞性肺泡炎,PD-1抑制剂可活化T淋巴细胞,故PD-1抑制剂与放疗联合应用时也有加重放射性肺损伤的风险[15-16]。
PD-1抑制剂主要通过活化T淋巴细胞介导免疫性损伤,免疫炎症微环境在PD-1抑制剂所致肺损伤中起着重要作用。本研究发现,PD-1抑制剂组的肺组织中CD3+T淋巴细胞浸润显著增多。进一步分析发现,主要是肺组织中浸润的CD8+T淋巴细胞增加,CD4+T淋巴细胞浸润不明显。本研究结果提示,CD8+T淋巴细胞浸润,而不是CD4+T淋巴细胞在PD-1抑制剂所致肺损伤中起着重要作用。Laubli等[17]报道黑色素瘤患者使用PD-1抑制剂后诱发免疫性心肌炎,患者出现严重急性左心衰,进行心肌活检,也发现心肌组织中大量CD8+细胞浸润,经皮质类固醇激素治疗后迅速好转。这些研究结果表明,CD8+T淋巴细胞在PD-1抑制剂所致正常组织的免疫损伤中起着关键作用。同时,CD8+T淋巴细胞在抗肿瘤作用中也起着重要的作用,封闭CD8+T细胞虽可减轻PD-1抑制剂的免疫损伤,但势必对其抗肿瘤作用带来负面影响[18-19]。不同的T淋巴亚群,包括Th1、Th2、Th17、Treg细胞等,在不同原因导致的肺损伤中起着相应作用[20-24]。本研究仅初步探索了CD3+、CD4+和CD8+T淋巴细胞浸润的情况,进一步深入研究起关键作用的T淋巴细胞亚群或更有助于精准防控PD-1抑制剂所致肺损伤。
细胞因子是免疫炎症微环境的重要构成部分,在肺损伤中起重要作用。本研究检测了IL-4、IL-6、IL-17A、TNF-α、TGF-β1、IFN-γ因子表达水平,发现PD-1抑制剂使肺组织中IL-6和TGF-β1表达水平显著升高,表明IL-6和TGF-β1在PD-1抑制剂所致肺损伤及纤维化中扮演着重要角色。IL-6和TGF-β1都是重要的促炎和促纤维化因子,在感染和组织损伤的早期有利于组织修复,但过度或持续的产生会使生理性修复转向过度的病理修复,其特征是纤维化形成[25-26]。研究表明,IL-6与TGF-β1对调控CD4+T细胞分化向Th17细胞分化是必不可少的,同时IL-6也抑制TGF-β1诱导的Treg细胞分化[27-28]。Th17/Treg平衡的上调被认为是免疫耐受破坏的原因,与自身免疫性疾病和慢性炎症性疾病的发生有关[29]。Tabata等[30]发现阻断IL-6信号通路,可抑制肺成纤维细胞活化,改善小鼠放射性肺纤维化程度。IL-6受体阻断剂可用于缓解肿瘤患者免疫治疗导致的炎症综合征,并能缓解类固醇激素难治的PD-1抑制剂相关irAEs[31-32]。目前,阻断TGF-β1介导的信号通路来减轻肺纤维化是研究的热点。临床上使用吡非尼酮延缓特发性肺纤维化的进展,吡非尼酮可通过抑制TGF-β1的关键信号通路,调控人成纤维细胞的增殖和向肌成纤维细胞的分化,减轻肺纤维化[33-34]。Macitentan能减轻TGF-β1诱导的肺纤维化和肺动脉高压的发展过程[35]。现实条件下,阻断IL-6和TGF-β1的相关通路可能是减轻PD-1抑制剂所致肺损伤的简便、快捷的有效方法,值得进一步探索。Kowalski等[36]发现,与健康人群比较,免疫检测点抑制剂相关肺炎患者肺泡灌洗液中的IL-4、IL-17α、TNF-α及IFN-γ表达水平无明显变化。本研究发现,小鼠给予PD-1抑制剂处理后,肺组织中IL-4、IL-17α、TNF-α及IFN-γ表达无明显变化。结合临床与动物实验的结果,表明IL-4、IL-17α、TNF-α及IFN-γ在免疫检测点抑制剂所致肺损伤中的作用轻微。
综上所述,PD-1抑制剂可导致肺损伤,尤其是与其它抗肿瘤方式联用时,应当重视肺损伤的风险增加。CD8+而不是CD4+T淋巴细胞在PD-1抑制剂所致的肺损伤中起着重要作用,关键的T细胞亚群值得进一步探索。IL-6和TGF-β1扮演着重要角色,阻断IL-6和TGF-β1的相关通路可能有助于减轻PD-1抑制剂所致肺损伤。更为深入地研究PD-1抑制剂导致肺损伤的免疫微环境调控机制,对精准防治PD-1抑制剂所致肺损伤具有重要意义。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
