肿瘤乏氧显像剂18F-氟赤硝基咪唑的快速稳定制备及其质量分析*
2022-04-26王潇雄江骁申太鹏姚玉唐陆皓陈世容张歌李秀丽谌佳琪寇莹肖定琼赵檬周星杨童舒程祝忠
王潇雄,江骁,申太鹏,姚玉唐,陆皓,陈世容,张歌,李秀丽,谌佳琪,寇莹,肖定琼,赵檬,周星,杨童舒,程祝忠
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放射肿瘤学四川省重点实验室(王潇雄、江骁、申太鹏、姚玉唐、陆皓、陈世容、张歌、李秀丽、谌佳琪、寇莹、肖定琼、赵檬、杨童舒、程祝忠);637000 四川 南充,川北医学院 影像学院(周星)
乏氧是实体肿瘤组织中常见的现象。肿瘤具有无限增殖的特点,当其增殖速度超过其血管生长的速度,导致内部血流减少,供氧能力减弱,局部组织的氧分压降低,便形成了乏氧区域[1]。肿瘤细胞会通过改变自身内源性基因的表达来适应乏氧微环境,乏氧能够诱导乏氧诱导因子-1α、血管内皮生长因子、生长因子及相关细胞分裂周期蛋白的表达,从而降低射线和某些化疗药物对肿瘤细胞的杀伤力,导致实体肿瘤的放疗抵抗及化疗耐药[2-7]。较多临床研究表明,肿瘤的乏氧程度与其预后呈负相关[8-10],肿瘤组织内部存在的乏氧细胞成为肿瘤易复发、难治愈的重要原因[11-12]。探测肿瘤的乏氧部位及乏氧程度对于制订最有效的放疗、化疗方案显得尤为重要。
目前存在着多种直接或者间接测定组织氧水平的方法,例如氧电极测定、组织形态分析、乏氧标志物检测、彗星电泳等。但这些技术具有或大或小的创伤性,或者不能准确实时地反应肿瘤组织乏氧情况,在临床应用中存在一定的局限性[13-15]。近年来,随着正电子及单光子放射性药物的开发,人们在肿瘤等疾病诊断方面取得了一些新的进展。在乏氧显像方面,利用18F、99mTc、64Cu等核素标记的乏氧显像剂如18F-氟赤硝基咪唑(18F-fluoroerythronitroimidazole,18F-FETNIM)、18F-fluoromisonidazole(18F-FMISO)、99mTc-4,9-diaza-3,3,10,10-tetramethyldodecan-2,11-dione dioxime(99mTc-HL91)、64Cu-diacetyl-bis(N4-methylthiosemicarbazone)(64Cu-ATSM)进行正电子发射型计算机断层扫描显像(positron emission tomography,PET)或单光子发射型计算机断层扫描显像可对活体内的乏氧组织定性和定量检测[16-19],具有无创、可动态、可重复等优势,是目前乏氧检测研究的热点。18F-FETNIM是一种具有较大潜力的乏氧显像剂,其周围组织代谢率、乏氧组织代谢率、脱氟率、脂/水溶性均适合于PET乏氧显像[16,20]。18F标记正电子药物半衰期为109.8 min,需医疗机构现制现用,其合成产率及合成时间很大程度影响其临床研究及应用,但目前国内鲜有医疗机构报道其详细制备工艺及质控方法。因此,本研究将详细报道其优化后的制备、分离纯化及质控方法,该内容将有助于18F-FETNIM临床推广应用,同时也为其他18F标记正电子药物的制备提供一些启示和参考。
1 材料和方法
1.1 设备和材料
CFN-MPS-200合成系统及HM-10回旋加速器(日本住友株式会);YMC-PACK-ODS-AM C18柱(10 mm × 250 mm,日本YMC公司);Jasco PU-2086 Plus半制备型高效液相色谱系统(high performance liquid chromatography,HPLC,日本Jasco公司);WondaSil C18柱(4.6 mm × 250 mm)及LC-15C分析型HPLC(日本岛津公司);MINI-scan薄层色谱扫描仪(美国Bioscan公司);CRC-25R型活度计(美国Capintec公司)。
1-(2′-硝基-1′-咪唑基)-2,3-O-异亚丙基-4-甲苯磺酰基丁烷(德国ABX公司);穴醚222(K222)、碳酸钾、乙腈、乙醇、盐酸、氢氧化钠、抗坏血酸(美国Sigma公司);注射用水及生理盐水(四川美大康佳乐药业有限公司);QMA阴离子交换柱(美国Waters公司);薄层硅胶板(德国Macherey Nagel公司);Millex-GS无菌过滤器(0.22 μm,美国Millipore公司)。
1.2 方法
1.2.118F-FETNIM的合成路线 如图1所示,前体1-(2′-硝基-1′-咪唑基)-2,3-O-异亚丙基-4-甲苯磺酰基丁烷与18F离子发生亲核取代反应,生成的中间体经盐酸水解后得到粗产品。粗产品溶液再经氢氧化钠中和、半制备型HPLC分离纯化、旋蒸系统除溶剂后最终得到产品。
1.2.218F-FETNIM的合成过程 合成装置如图2所示,用10 MeV、60 μA的质子束流连续轰击填充有18O-H2O的液体靶 40 min,通过18O(p,n)18F核反应得到18F离子。用氮气正压将带有18F离子的靶水收集到靶水收集瓶中。接着用氮气正压使靶水收集瓶中的靶水通过QMA阴离子交换柱,使18F离子吸附于QMA阴离子交换柱上。用K2CO3/K222的混合溶液将QMA阴离子交换柱上的18F离子淋洗入反应瓶中。将反应瓶温度升高至110 ℃,待将淋洗液完全蒸干后冷却至室温,再加入0.3 mL无水乙腈,110 ℃加热至乙腈完全蒸干。加入1 mL含有2 mg 1-(2′-硝基-1′-咪唑基)-2,3-O-异亚丙基-4-甲苯磺酰基丁烷的无水乙腈溶液至反应瓶,在密闭的反应瓶中105 ℃氟化5 min,然后将液体蒸干。加入0.9 mL浓度为2 M的HCl,在密闭反应瓶中升温至105 ℃水解5 min。加入0.8 mL 浓度为2 M的NaOH进行中和后,再将反应瓶中粗产品转移至半制备HPLC系统的进样器中。

图1 18F-FETNIM的合成路线
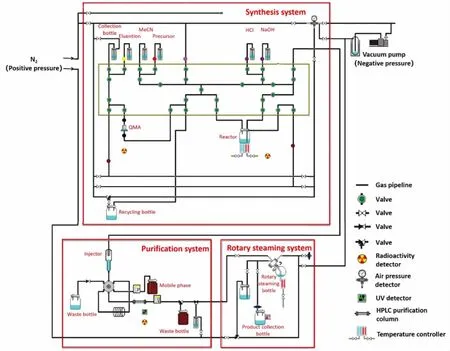
图2 制备18F-FETNIM的合成装置
1.2.318F-FETNIM的分离纯化 将进样器中粗产品注入带放射性检测器的半制备型HPLC系统中。分离纯化条件如下:流动相为V(水)∶V(乙腈)∶V(乙醇)=500∶90∶10,流速为4.0 mL/min,紫外波长为325 nm,色谱柱为YMC-PACK-ODS-AM C18柱(10 mm × 250 mm)。收集保留时间在5~7 min内的放射组分(图3)于旋蒸瓶中160 ℃蒸干(旋蒸瓶中提前加入0.1 mL 100 mg/mL的抗坏血酸),用8 mL生理盐水溶解产品并通过0.22 μm Millex GS无菌滤膜,得到最终的18F-FETNIM产品。

图3 粗产品的分离纯化图谱
1.2.4 产品的质量分析 观察产品溶液的颜色及澄明度,活度计测量产品溶液的活度并计算放射性浓度,用精密pH试纸测定产品溶液的pH值。将产品及标准品19F-FETNIM注入带放射性检测器的分析型HPLC(WondaSil C18柱,4.6 mm× 250 mm)中分析保留时间、放射化学纯度,条件如下:流动相为V(水)∶V(乙腈)=95∶5,流速1 mL/min,紫外波长254 nm,柱温40℃。另外利用带放射性检测器的薄层色谱(thin layer chromatography,TLC)分析产品的放射化学纯度及产品在4 h内的稳定性,展开剂为V(氯仿)∶V(甲醇)=70∶30,固定相为薄层硅胶板。
2 结 果
2.1 专利申请
采用此方法合成18F-FETNIM的合成装置及系统已获得实用新型专利授权,专利名称为:一种用于合成18F-氟赤硝基咪唑的系统、一种用于合成18F-氟赤硝基咪唑的卡套,专利号为:ZL201821957828.6.、ZL201821942477.1.。
2.2 18F-FETNIM的合成及质量分析
采用此方法的合成时间约为50 min,合成产率为24%~30%(衰减校正后,n=8),18F-FETNIM放射性浓度>1.11×109GBq/mL,产品为无色透明溶液,pH值在7.0~7.5之间,分析型HPLC显示产品的放射化学纯度高于97%(图4A),产品与19F-FETNIM标准品保留时间一致(图4A、B),产品中除含有少量的抗坏血酸及其可能的氧化产物外,无其他化学杂质(图4C、D)。TLC显示产品在上述条件下的比移值(Rf值)约为0.8,放射化学纯度大于99%且在4 h内稳定(图5)。以上各项质控内容已覆盖正电子放射性药品质量控制中的快速质量控制原则[21]。

图4 产品的HPLC分析图谱

图5 产品的TLC图谱
3 讨 论
硝基咪唑类乏氧显像剂在乏氧显像剂大家族中具有重要地位,其可以通过弥散作用进入到细胞内并在胞内黄嘌呤氧化酶作用下发生硝基的单电子还原,进而产生自由基阴离子。在正常情况下,自由基阴离子能够迅速被再氧化成原化合物扩散到细胞外;而在乏氧状况下,自由基阴离子将被进一步还原并与细胞内其他组分结合,从而滞留于细胞内[22-24]。临床上使用及研究较多的硝基咪唑类乏氧显像剂主要包括18F-FMISO及18F-FETNIM。相较于18F-FETNIM来说,18F-FMISO具有过高的脂溶性,其在正常组织中具有更多的摄取且洗脱较慢,注射后需要较长时间才能达到理想的本底。Yang等[16]的研究表明,18F-FETNIM比18F-FMISO具有更高的亲水性,在乳腺癌小鼠移植瘤模型中,18F-FETNIM注射4 h后的肿瘤/血液比(T/B)明显高于18F-FMISO。赵伟等[25]发现在SPCA-1人肺腺癌裸鼠移植瘤模型中,18F-FETNIM在肾中代谢最高,而在脂肪和骨骼中代谢较低,肿瘤/非肿瘤(T/NT)比值较高且随时间增加,肿瘤/血液摄取比(T/B)为1.69±0.37,肿瘤/肌肉摄取比(T/M)为1.57±0.47。Lehtiö等[26]利用18F-FETNIM检测头颈肿瘤患者的乏氧情况,3小时的肿瘤/肌肉比(T/M)在1~4,优于18F-FMISO。国内外有较多研究讨论了18F-FETNIM进行乏氧显像的价值,发现18F-FETNIM的周围组织代谢率、乏氧组织代谢率、脱氟率、脂/水溶性均适合于PET乏氧显像[27-29],表明18F-FETNIM是一种具有较大潜力的乏氧显像剂。
自Yang及Grierson分别报道了18F-FMISO及18F-FETNIM的合成路线[16,30],国内外有关乏氧显像剂的研究主要集中于硝基咪唑类乏氧衍生物前体的开发,而对相关制备工艺的研究较少。本研究在Yang等[16]所报道合成路线的基础上,利用优化后制备工艺及CFN-MPS-200合成系统,实现了18F-FETNIM的快速稳定合成。众所周知,在18F亲核取代反应过程中,即使微量水的引入也会导致氟化失败,且该因素是导致此类正电子药物合成失败的重要原因。在对前体进行18F氟化前,可以选择向反应瓶中直接加入前体,或加入一次或者多次无水乙腈除水。本课题组尝试过向反应瓶中直接加入前体,合成失败率超过30%,大概率是因为反应瓶及合成管线残留有微量水的原因,而加入一次无水乙腈除水后则未出现合成失败的情况。因此,本研究选择在氟化前向反应瓶中加入一次无水乙腈除水,保证了合成的稳定性。同时本研究也对氟化时间及温度进行了对比分析,发现在105 ℃氟化5 min能够达到24%~30%的合成产率,在此条件上,降低氟化温度或时间则明显降低合成产率,而增加氟化温度或时间则合成产率无明显改变。因此,本研究在18F氟化这一步选择105 ℃氟化5 min,保证其在较短的时间内能够得到较高的合成产率。Yang等[16]所报道的合成产率在20%~30%,但其合成时间大约为70 min;Grönroos等[20]所报道的合成时间约为50 min,但其合成产率为13%~20%。本研究基于优化后的制备工艺及CFN-MPS-200合成系统,合成时间约为50 min,产率在24%~30%之间,其合成时间更短,合成产率更高。18F标记正电子药物半衰期为109.8 min,需医疗机构现制现用,缩短合成时间及提高合成产率能够促进其临床研究及应用。
在分离纯化这一步我们采用半制备型HPLC对粗产品进行分离纯化。如图4A所示,分离纯化得到的产品具有较高的放射化学纯度且在4 h内稳定。同时从图4C及图4D中的结果可以看到,除了产品中含有少量的抗坏血酸及其可能的氧化产物外,产品无其他化学杂质。分离得到的产品被加入旋转蒸发器中除去流动相中溶剂再用生理盐水溶解,其临床应用安全性得到了一定的保障。另外如图4B所示,合成得到的产品与19F-FETNIM标准品的保留时间一致,从色谱的角度确认本方法合成得到的产品是18F-FETNIM。
综上,本研究详细报道了18F-FETNIM的制备、分离纯化及质控方法,其方法稳定,所需合成时间短,产率高,且产品无溶剂,所得到的结果将促进18F-FETNIM的临床推广应用。同时一些其他18F标记正电子药物如18F-FMISO、18F-氟乙基酪氨酸(O-(2-[18F]fluoroethyl)-L-tyrosine,18F-FET)、18F-氟代胸腺核苷(3’-deoxy-3’-18F-fluorothymidine,18F-FLT)的制备过程也大多包括氟化、水解、分离纯化步骤[31-33],其制备工艺与本文所报道18F-FETNIM的制备工艺类似。因此,本研究所报道的方法对其他18F标记正电子药物的制备具有一定的指导作用。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
