艾立布林治疗多线化疗失败晚期软组织肉瘤患者的疗效和安全性
2022-04-26赵盼桑蝶王依盟李诗语
赵盼,桑蝶,王依盟,李诗语
北京市朝阳区三环肿瘤医院综合科,北京 100122
软组织肉瘤属于罕见肿瘤,可进一步细分为70个亚型,每个亚型均有不同的形态特征,通常表现为特定的临床特征并给予特定的治疗方法[1],艾立布林是海洋天然产物软海绵素B类似物,可抑制微管蛋白解聚,已被美国食品药品管理局(FDA)批准作为转移性乳腺癌和进展期脂肪肉瘤的微管抑制剂[2-4]。有研究显示,艾立布林可延长不能手术或晚期脂肪肉瘤患者的生存期[5],因此,2021年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐其作为晚期转移性脂肪肉瘤首选治疗药物,1A类推荐,但临床最佳治疗模式仍在探索阶段。本研究探讨艾立布林治疗多线化疗失败的晚期软组织肉瘤的疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2020年7—12月北京市朝阳区三环肿瘤医院收治的一线以上化疗失败晚期软组织肉瘤患者。纳入标准:①均经组织病理学检查证实为软组织肉瘤;②既往一线以上全身治疗失败;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分≤2分;④经CT或MRI检查证实,存在可客观评价的病灶。排除标准:①合并严重心、肺、肝、肾等脏器功能不全;②对本研究所用药物过敏;③单原发软组织肉瘤。依据纳入和排除标准,本研究共纳入7例晚期软组织肉瘤患者,其中男3例,女4例;临床分期均为Ⅳ期;年龄44~68岁;ECOG PS评分:0~1分4例,2分3例;病理类型:脂肪肉瘤4例,平滑肌肉瘤2例,神经鞘瘤1例;治疗线数:二、三线5例,四、五线2例;转移脏器数目:<3个2例,≥3个5例;转移脏器或组织包括双肺、腹膜后、胸膜、盆腔等。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
7例一线以上化疗失败晚期软组织肉瘤患者,艾立布林治疗前均给予血常规、肝肾功能、甲状腺功能、心肌酶谱及心电图等基础检查,均给予艾立布林单药治疗,第1、8天,艾立布林2 mg静脉注射,21天为1个治疗周期,共治疗26个周期。
1.3 观察指标和评价标准
以颈胸腹部增强CT、MRI检查结果作为基线数据进行疗效评估,每2个治疗周期行胸腹盆部CT、MRI检查评估疗效,并详细记录治疗期间的不良反应发生情况。①依据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumor 1.1,RECIST 1.1)[5]评估两组患者的临床疗效:完全缓解(complete response,CR),以所有目标病灶完全消失;部分缓解(partial response,PR),所有可测量目标病灶的直径总和比基线缩小≥30%;疾病进展(progressive disease,PD),以所有可测量的靶病灶直径之和的最小值为参照,直径总和相对增加≥20%;疾病稳定(stable disease,SD),所有可测量的靶病灶直径之和缩小不足PR,增加幅度不足PD,介于二者之间。客观有效率=(CR+PR)例数/总例数×100%;临床获益率=(CR+PR+SD)例数/总例数×100%。②依据常见不良事件评价标准4.0(common terminology criteria adverse event 4.0,CTCAE 4.0)[6]评估患者的不良反应发生情况。③采用电话随访至2021年10月3日,记录所有患者的预后生存情况,包括无进展生存期(progressionfree survival,PFS)和总生存期(overall survival,OS),PFS指接受艾立布林治疗开始至首次出现PD或死亡的时间,OS指接受艾立布林治疗开始至死亡或最后随访的时间。
1.4 统计学方法
采用SPSS 25.0软件对所有数据进行统计分析,计数资料以例数和率(%)表示;采用Kaplan-Meier法绘制生存曲线。
2 结果
2.1 预后生存情况
7例一线以上化疗失败晚期软组织肉瘤患者总共完成26个周期的治疗,每例患者治疗2~8个周期,中位治疗2个周期。给予艾立布林治疗期间疗效评价为PR 1例,SD 2例,PD 4例,客观有效率为14.29%(1/7),临床获益率为42.86%(3/7)。截至2021年10月3日,生存2例,因病情进展死亡5例,所有患者均获得随访,随访时间8~14个月,中位PFS为2个月,中位OS为12个月。(表1)
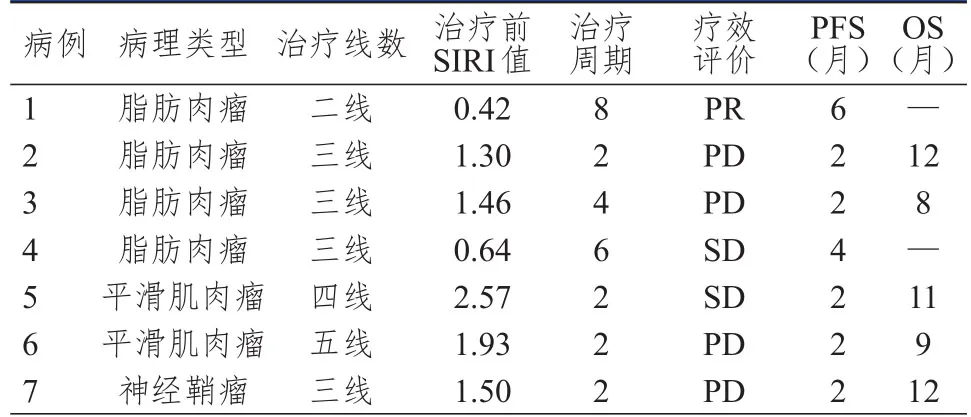
表1 7例一线以上化疗失败晚期软组织肉瘤患者艾立布林治疗及预后情况
2.2 不良反应发生情况
7例一线以上化疗失败晚期软组织肉瘤患者接受艾立布林治疗出现的主要不良反应为乏力4例、白细胞减少4例、周围神经损伤3例、胃肠道反应2例、贫血2例、肝功能损伤1例,且均为可耐受的1~2级不良反应,经对症处理后未影响继续治疗。(表2)
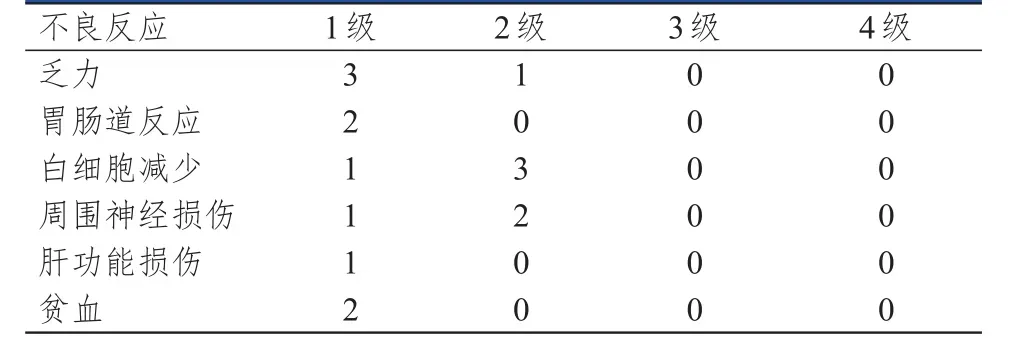
表2 7例一线以上化疗失败晚期软组织肉瘤患者接受艾立布林治疗不良反应发生情况
3 讨论
软组织肉瘤亚型较多,分别具有不同的生物学行为及临床特征,不能手术根治或晚期患者往往经多线治疗后出现病情进展,生存期较短。一项日本真实世界研究纳入256例接受艾立布林治疗的晚期或转移性软组织肉瘤患者,7.5%的患者疗效评价为PR,34.5%疗效评价为SD,客观有效率为7.5%,临床获益率为42.0%,除脂肪肉瘤和平滑肌肉瘤外的其他亚型患者的客观有效率、临床获益率分别为10.3%、32.0%,其中包括罕见软组织肉瘤亚型患者的PR[7]。表明艾立布林对脂肪肉瘤和平滑肌肉瘤的治疗具有优势,特别是在多形性脂肪肉瘤亚型上观察到了OS的延长,或可尝试应用于其他亚型软组织肉瘤患者的后线治疗[8-9]。本研究共纳入4例脂肪肉瘤患者,其中1例疗效评价为PR,7例患者总体临床获益3例,与上述日本学者的研究结论基本吻合。
在探索全身炎症反应与疗效的研究中发现,中性粒细胞产生的细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6和血管内皮生长因子(vascular endothelial growth factor,VEGF),均可促进肿瘤进展并抑制T细胞的免疫反应[10]。单核细胞可与肿瘤细胞相互作用,并作为肿瘤相关巨噬细胞招募到肿瘤组织中,以减弱抗肿瘤免疫反应,刺激肿瘤细胞迁移和侵袭[11]。相反,淋巴细胞可以通过抑制肿瘤细胞增殖、侵袭和迁移及在免疫监视中的关键作用影响其生长转移[12]。有研究在探索艾立布林治疗疗效的预测因素分析中发现,高SIRI值会降低抗肿瘤免疫活性,可能预示着较差的OS及后续疗效[13],与本研究治疗前低SIRI值患者的OS更长相符。研究发现,艾立布林可诱导肿瘤新生血管生成,在促进肿瘤微血管数量增加的同时增加血流灌注、血管成熟和恢复氧供[14-16],诱导肿瘤血管重塑正常化是其独特抗肿瘤作用[17]。但上述诱导血管正常化的内在机制尚不完全清楚,需要更深入的研究进一步证实。
艾立布林治疗软组织肉瘤的安全性亦是临床关注的重点,日本真实世界研究分析发现,约82.7%的患者出现了不同程度的药物相关不良反应,常见的不良反应为中性粒细胞减少(58.4%)、丙氨酸转氨酶升高(12.6%)、天门冬氨酸转氨酶升高(12.2%)等,其中18.5%为严重不良反应,包括中性粒细胞减少(7.8%)、白细胞减少(7.5%)、中性粒细胞减少性发热(2.0%)和贫血(1.2%),其中10.6%的患者因药物不良反应而停药,所有患者均未出现致死的不良反应[18]。本研究7例艾立布林治疗患者出现的不良反应均为可耐受的1~2级不良反应,以肝功能异常、骨髓抑制及外周神经毒性常见,与上述研究结果相符。艾立布林的安全性较高,不良反应不影响后续治疗,安全性已在大量研究中得到证实[19]。
综上所述,软组织肉瘤的异质性为治疗增加了难度,虽然本研究纳入的病例数较少且均为单药治疗,有一定的局限性,但仍证实了艾立布林治疗软组织肉瘤的有效性与安全性。目前,抗肿瘤治疗已进入了靶向治疗和免疫治疗时代,应探索化疗与靶向治疗或免疫治疗等的联合应用,以提高治疗疗效。
