大豆籽粒生育酚遗传位点发掘及候选基因筛选
2022-04-26秦宁李俊茹田蕊邵振启李喜焕张彩英
秦宁, 李俊茹, 田蕊, 邵振启, 李喜焕*, 张彩英
(1.河北农业大学农学院,华北作物改良与调控国家重点实验室,河北 保定 071001;2.河北农业大学生命科学学院,河北 保定 071001)
生育酚(维生素E)是可溶于有机溶剂、粘稠油状、淡黄色的物质,一般在大豆油和谷物种子的胚芽油中含量丰富[1-2]。已有研究证实,生育酚在植物体内可参与多种生理生化代谢、信号转导、基因表达调控和抵御多种逆境胁迫,因而在植物正常生长发育中具有重要功能[3-4]。同时,生育酚还具有较强的抗氧化功能,可有效防止或改善人类多种癌症、心血管疾病、眼部疾病和神经系统疾病等,故而在医学、保健等领域具有重要研究价值[5-9]。
人体自身并不能合成生育酚,需从植物油中摄取[10]。据统计,天然生育酚的年生产量远不能满足市场需求,需求量以10%年增长量递增[3]。油料作物种子的生育酚含量较其他农作物高,并以油菜和大豆种子的生育酚含量更为丰富[11]。刘焕成等[12]测定不同大豆品种资源籽粒中的生育酚含量,发现总生育酚含量在 254 μg·g—1左右,且不同品种间的含量存在较大差异。由此可见,发掘利用大豆籽粒生育酚对满足当前国际市场天然生育酚需求至关重要[13]。然而,生育酚属于多基因控制的数量性状,目前仅有少数学者针对大豆籽粒生育酚含量开展遗传位点与候选基因发掘研究,所获遗传位点与基因不能满足分子遗传改良和遗传机制解析。
梁慧珍等[14]通过测定大豆重组自交系(recombinant inbred line,RIL)群体γ-生育酚含量获得9个控制其含量QTLs,位于4、5、7、8、9和18号染色体,表型贡献率7.29%~29.55%。张红梅等[3]检测大豆重组自交系群体δ-、γ-和α-生育酚含量,获得8个关联QTLs,位于1、6、9、10、18和19号染色体,表型贡献率为2.40%~6.18%。李海燕等[13]对大豆RIL群体进行生育酚含量QTL分析,结果在1、2、3、6、7、8、18和19号染色体检测到连锁QTLs。刘焕成[15]利用大豆RIL群体为材料,获得66个生育酚及其组分含量相关QTLs,表型贡献率为2.4%~32.6%,其中包括21个α-生育酚QTLs(10、15、18和19号染色体)、17个γ-生育酚QTLs(9、10、12、15、18和19号染色体)、13个δ-生育酚QTLs(10、12、15和19号染色体)和15个总生育酚QTLs(9、10、12、15、18和19号染色体)。最近,Zhan等[16]通过检测大豆自然群体生育酚含量,获得18个关联标记,位于10条染色体(1、2、6、8、10、12、13、17、18和19号染色体)。Sui等[17]检测大豆自然群体和重组自交系群体生育酚含量,分别获得19个关联标记与18个连锁QTLs,其中包括1个位于2号染色体的关联与连锁分析共同检测到的遗传位点。
针对上述大豆生育酚遗传位点与候选基因严重缺乏的问题,本研究利用大豆重组自交系群体,通过鉴定其籽粒总生育酚、α-生育酚及其占比、γ-生育酚及其占比以及δ-生育酚及其占比,明确群体生育酚遗传变异及其相关性,挖掘其遗传位点并筛选候选基因,为大豆生育酚含量分子遗传改良和分子遗传机制解析提供选择标记与基因资源。
1 材料与方法
1.1 供试大豆材料
供试RIL群体(ZQ-RIL,F6:7)含283个家系,由河北农业大学大豆遗传育种团队提供,于2016年6月种植于河北农业大学作物育种中心,完全随机区组试验设计,行长1.5 m,双行区,行距0.5 m,3次重复,田间管理参考一般大豆田管理方法[18]。
1.2 试验方法
1.2.1 大豆籽粒生育酚提取方法 随机选取供试RIL群体各家系的健康饱满、均匀一致、无损伤籽粒20~30粒,磨样机(合肥荣事达小家电有限公司,GR150A)粉碎过60目筛;准确称取磨粉0.05 g,加入1.5 mL 80%色谱乙醇(天津福晨化学试剂有限公司),振荡混匀15 s;超声波萃取15 min,静置15 min,振荡混匀20 s;超声波再次萃取15 min,13 000 r·min—1离心 15 min;吸取上清用0.22 μm滤膜过滤[19]。
1.2.2 供试RIL群体籽粒生育酚测定方法 采用安捷伦1260型高效液相色谱仪[安捷伦科技(中国)有限公司]检测提取液的 α-、γ-和 δ-生育酚含量[19]。色谱条件:荧光检测器波长330 nm,流动相为色谱乙腈:色谱甲醇(90:10,天津福晨化学试剂有限公司),流速1 mL·min—1,柱温40 ℃,进样量20 μL,检测时间14 min。
获得的α-、γ-和δ-生育酚含量总和为总生育酚含量,同时计算各组分含量占总含量的比值[19]。
1.2.3 生育酚QTL定位与候选基因筛选 利用供试RIL群体籽粒α-、γ-和δ-生育酚、总生育酚含量以及α-、γ-和δ-生育酚占比共7个性状,结合群体SNP遗传连锁图谱,采用IciMapping V4.2软件进行QTL定位[20]。
利用鉴定到的籽粒生育酚QTLs,在其区间范围内寻找候选基因(参考基因组为Williams82 a2v1),结合 RIL群体亲本(郑92116、齐黄30)籽粒不同发育时期转录组数据,分析候选基因表达量,并依据基因表达量及其基因注释,筛选与大豆生育酚含量相关基因。
1.2.4 数据分析方法 利用SPSS V21.0统计软件对供试RIL群体7个性状进行描述统计、方差分析和相关系数计算,利用GraphPad Prism 8软件绘制7个性状次数分布图,利用HemI软件制作候选基因表达量热图。
2 结果与分析
2.1 大豆RIL群体籽粒生育酚遗传变异分析
通过分析供试大豆RIL群体各家系籽粒生育酚及其组分(表1)发现,α-、γ-和δ-生育酚及总生育酚含量在不同家系间的差异极显著;进一步分析各含量遗传变异(表1)发现,α-、γ-和δ-生育酚及总生育酚平均含量为7.10、127.86、65.65和200.61 μg·g—1,变异系数分别为 36.62%、9.53%、14.03%和9.24%,以α-生育酚含量的变异系数最大,说明供试群体生育酚及各组分含量存在丰富的遗传变异。
同时还发现,α-、γ-和δ-生育酚在总生育酚中的占比分别为3.54%、63.80%和32.66%,变异系数分别为35.59%、5.05%和8.70%,亦以α-生育酚占比的变异系数最高。另外,通过分析供试RIL家系籽粒生育酚及其各组分次数分布以及偏度系数和峰度系数(表1,图1)发现,偏度系数和峰度系数均接近0,说明供试RIL群体籽粒生育酚及各组分符合正态分布,属于多基因控制数量性状。

图1 大豆RIL群体籽粒生育酚及其组分次数分布Fig.1 Distribution of seed tocopherol and its components in RIL population

表1 供试大豆RIL群体籽粒生育酚及其组分遗传变异Table 1 Genetic variations of seed tocopherol and its components in RIL population
2.2 大豆RIL群体生育酚及各组分相关性分析
通过分析供试大豆RIL群体籽粒生育酚及其组分间的相关系数(表2)发现,总生育酚与3种组分含量间的相关系数均达到极显著水平,并以总含量和γ-生育酚的相关系数最高(r=0.859),其次为总含量和δ-生育酚相关系数(r=0.803)。同时发现(表2),δ-生育酚与α-生育酚及γ-生育酚含量间的相关性也极显著(r=0.256,r=0.410),而α-生育酚与γ-生育酚间的相关系数未达显著水平(P>0.05)。
另外还发现(表2),δ-生育酚占比与γ-生育酚占比、γ-生育酚占比与α-生育酚占比呈现极显著负相关(r=-0.921,r=-0.479)。同时,总生育酚与δ-生育酚占比、γ-生育酚占比的相关性也极显著。上述各组分及总量间的相关性暗示供试大豆群体可能存在控制籽粒生育酚及其组分含量一因多效遗传位点,为今后实现生育酚及其组分含量同步遗传改良提供一定参考。

表2 供试大豆RIL群体籽粒生育酚及各组分相关系数Table 2 Correlation coefficients of tocopherol and its components in RIL population
2.3 大豆籽粒生育酚及其组分遗传位点分析
2.3.1 大豆籽粒生育酚及其组分QTLs发掘 通过分析供试大豆RIL群体籽粒生育酚及其组分含量QTLs(表3)发现,共检测到7个一因多效QTLs,分别位于5、7、8、12、13、18和19号染色体,表型贡献率分布在3.08%~21.92%之间。进一步分析(表3,图2)发现,位于8号染色体的qTOC-A2(ss715602131~ss715602331)可同时控制 α-生育酚、δ-生育酚、总生育酚含量、α-生育酚占比和γ-生育酚占比共5个相关性状,表型贡献率范围3.85%~6.77%。位于5号染色体的QTL qTOC-A1可同时控制α-生育酚含量及其占比、γ-生育酚含量及其占比以及总生育酚含量共5个性状,表型贡献率范围6.34%~21.92%,其中控制γ-生育酚、总生育酚和α-生育酚占比的贡献率在10%以上(12.32%~21.92%)。并且还发现,12和13号染色体分别存在1个控制生育酚及其组分一因多效QTL,其中12号染色体qTOC-H(ss715611499~ss7 15613700)可同时控制α-生育酚及其占比以及γ-生育酚占比,13号染色体qTOC-F可同时控制γ-生育酚与总生育酚含量。18号染色体QTL可同时控制δ-生育酚及其占比以及总生育酚含量,19号染色体QTL可同时控制α-生育酚及其占比,而7号染色体QTL可同时控制γ-生育酚与总生育酚含量。

图2 大豆8号染色体籽粒生育酚一因多效QTL及其候选基因Fig.2 Pleiotropic QTL and candidate gene for soybean seed tocopherol and its components on chromosome 8

图3 大豆5号染色体籽粒生育酚一因多效QTL及其候选基因Fig.3 Pleiotropic QTL and candidate gene for soybean seed tocopherol and its components on chromosome 5
2.3.2 大豆籽粒生育酚含量及其占比QTLs的比较 通过比较α-生育酚、γ-生育酚、δ-生育酚含量及其相应占比检测到的QTLs(表3)发现,各成分含量与相应占比间的定位结果并不完全一致,如5号染色体qTOC-A1、18号染色体qTOC-G和19号染色体qTOC-L生育酚组分及其占比定位结果一致,而7号染色体qTOC-M控制γ-生育酚与总生育酚,13号染色体qTOC-F控制γ-生育酚与总生育酚,但并未控制γ-生育酚占比,暗示控制大豆籽粒生育酚组分含量与组分占比的分子遗传机制并不完全一致。

表3 供试大豆RIL群体籽粒生育酚及其各组分一因多效QTLsTable 3 Pleiotropic QTLs of seed tocopherol and its components in soybean RIL population
2.4 大豆籽粒生育酚及其组分候选基因筛选
为进一步筛选与大豆籽粒生育酚及其组分相关基因,本研究利用前期已有供试RIL群体亲本“郑92116”与“齐黄30”籽粒不同发育时期转录组数据,分析上述QTLs区间候选基因,结果(图2~4)表明,在上述QTLs区间存在多个差异表达基因,这一方面验证了上述连锁QTLs可靠性,另一方面为发掘控制大豆籽粒生育酚功能基因奠定了基础。
在差异表达基因中(图4),12号染色体候选基因Glyma.12G014200与Glyma.12G014300分别编码生育酚o-甲基转移酶与γ-生育酚甲基转移酶,这2种酶均是大豆生育酚合成过程关键酶,且2个基因在“郑92116”与“齐黄30”籽粒不同发育时期表达量存在差异;进一步分析发现,Glyma.12G014200在“郑92116”籽粒 T2~T4发育时期表达量呈现明显上升趋势,而在“齐黄30”籽粒发育不同时期没有明显变化,Glyma.12G014300则在“郑92116”籽粒T5发育时期表达量呈现明显上升,而在“齐黄30”籽粒发育不同时期无明显变化。可见,Glyma.12G014200与Glyma.12G014300可能在大豆生育酚合成代谢过程中具有重要作用。
18号染色体候选基因Glyma.18G141100编码尿黑酸茄尼酯转移酶(homogentisate solanesyltransferase,HST),该酶是一种尿黑酸异戊烯基转移酶(homogentisic aicd phytyl transferase,HPT),亦是大豆生育酚合成过程关键酶,分析该基因在不同大豆品种中差异表达,其在郑92116的T3发育时期存在上升表达,而在齐黄30中没有明显变化(图4),可见,该基因对于大豆生育酚合成亦具有重要作用。
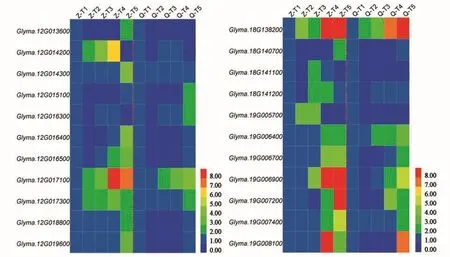
图4 大豆12号、18号和19号染色体生育酚候选基因Fig.4 Candidate gene for soybean tocopherol on chromosomes 12,18 and 19
除上述候选基因外,本研究还发现(图2、3),在大豆5、8号等染色体存在多个差异表达基因,这些基因中有的参与大豆籽粒脂肪合成或分解代谢过程,有的属于转录因子。由于大豆生育酚属于脂溶性维生素,因而其含量与籽粒脂肪含量密切相关,又因转录因子类基因具有调控下游一系列相关基因的强大功能,故本研究认为,这些候选基因对于提高大豆籽粒生育酚含量也具有重要意义。
3 讨论
已有报道证实,大豆籽粒生育酚含量属多基因控制数量性状,发掘控制其遗传位点及相关基因是实现其遗传改良的重要途径[13,15]。然而,到目前为止,关于大豆籽粒生育酚含量遗传位点与候选基因发掘研究较少[16-17,21-25],挖掘的相关遗传位点及候选基因远不能满足分子遗传改良需求。鉴于此,本研究利用大豆重组自交系群体,通过鉴定其籽粒生育酚含量,结合群体SNP遗传图谱,开展生育酚组分及其总量遗传位点发掘研究,同时结合团队已有的RIL群体亲本转录组数据,筛选相关基因,共检测到7个QTLs可同时控制多个生育酚组分及其总量,并筛选到多个可参与大豆生育酚合成代谢途径相关基因,为实现大豆籽粒生育酚含量分子遗传改良提供了选择标记及基因资源。
通过比较本研究结果与前人报道遗传位点发现,18号染色体QTL qTOC-G的连锁标记ss715629930(物理位置 21 908 634)与 Sui等[17]发现的δ-生育酚连锁标记 Satt303(物理位置21 906 039)仅相距2 595 bp,并且Sui等[17]还发现,Satt303标记与大豆生育酚环化酶(tocopherol cyclize,TC)连锁,而该酶是在大豆生育酚合成过程中,将中间前体物质 MPBQ(2-甲基-6-植基-1,4-苯醌)和DMPBQ(2,3-二甲基-5-植基-1,4-苯醌)经环化反应,催化形成δ-生育酚或γ-生育酚的关键酶。由此可见,18号染色体qTOC-G对于提高大豆籽粒δ-生育酚及其占比以及总生育酚含量有重要意义。同时,13号染色体qTOC-F与Sui等[17]报道的大豆总生育酚QTL部分重叠,其中连锁标记Satt657(物理位置39 735 278)恰好位于本研究定位的qTOC-F区间内,与qTOC-F两端标记物理位置分别相距约145和176 kb。另外,本研究5号染色体QTL qTOC-A1与Shaw等[24]报道的δ-生育酚和总生育酚QTL标记Satt174物理位置相距约947 kb。
除上述与前人研究物理位置相近QTLs外,本研究还定位到4个新QTLs,分别位于7、8、12和19号染色体。其中,8号染色体qTOC-A2物理位置在43.89~45.92 Mb,而前人报道的8号染色体控制大豆生育酚QTLs物理位置分别在0.18[22]、5.18[24]和36.36 Mb[16],与本研究qTOC-A2物理距离较远。并且,本研究12号染色体qTOC-H物理位置在0.98~1.38 Mb,而前人报道的12号染色体QTLs物理 位 置 分 别 在 13.42~15.14[23]、17.12[16]、32.04~33.41[23]、36.57 Mb等[24],距本研究qTOC-H较远;而且,本研究还在qTOC-H区间筛选到编码大豆生育酚o-甲基转移酶与γ-生育酚甲基转移酶的候选基因Glyma.12G014200与Glyma.12G014300,这 2个基因在供试RIL亲本间存在表达差异(图4)。由此可见,12号染色体qTOC-H及其2个候选基因在大豆生育酚合成过程中发挥着重要功能。
另外,通过分析前人已获得的19号染色体大豆生育酚QTLs发现,其物理位置分别在2.27~5.41[23]、8.75 ~20.71[23]、34.35 ~34.76[3]、37.04[16]、45.12 ~47.07 Mb[23],连锁性状包括α-生育酚、γ-生育酚、δ-生育酚及总生育酚,而本研究在19号染色体0.51~0.81 Mb区间定位到1个新的可控制α-生育酚及其占比QTL(qTOC-L),并且在该QTL区间筛选到多个在RIL群体亲本间存在表达量差异的候选基因。综上,本研究获得的大豆籽粒生育酚遗传位点及其候选基因,丰富了现有大豆生育酚控制位点与基因,为进一步开展生育酚遗传改良与机制解析奠定了重要基础。
