β-环糊精对曲拉通X-114紫外光谱抗干扰性能的影响
2022-04-26许慧华石东坡吴浩尹先清郑延成陈武李赓
许慧华,石东坡,吴浩,尹先清,郑延成,陈武,李赓
(长江大学石油石化污染控制与处理国家重点实验室,湖北 荆州 434023)
随着油田开采进入中后期,三次采油复合驱技术在低渗透油田及中老油田的可持续发展中发挥越来越重要的作用,已成为油田保产能、增效率的关键技术之一。辛基苯基聚氧乙烯醚(曲拉通X-114)因具有大幅度降低油水界面张力等作用,是三元复合驱油常用的非离子型表面活性剂之一。准确检测油田采出水中曲拉通X-114等表面活性剂浓度,是了解驱油剂体系中曲拉通X-114等组分在地层孔隙间的吸附滞留规律的基本途径,对于评价以及改进三元复合剂驱地面处理工艺也具有重要意义。
检测曲拉通X-114 等非离子表面活性剂的方法,目前主要有色谱法、光谱法、表面张力法和电导率法等,这些检测方法通常以曲拉通X-114 的临界胶束浓度()为分界点,分别建立浓度低于和高于两个不同阶段的定量标准曲线进行定量,此类检测方法能准确检测无干扰溶液中的曲拉通X-114。但是油田采出水中的曲拉通X-114会与其他表面活性剂形成较强的相互协同作用,甚至形成混合胶束,这必然会对复配溶液中曲拉通X-114的检测产生明显干扰,也无法再依据曲拉通X-114 的按浓度范围建立定量标准曲线,导致光谱法、色谱法等均难以准确测定复合驱体系中的曲拉通X-114。因此,本文以脂肪醇聚氧乙烯醚(AEO-9)作为复配组分为例,采用紫外光谱法检测“曲拉通X-114/AEO-9”二元复配体系中曲拉通X-114的含量,在复配水溶液中添加适量-环糊精(-CD),利用-CD 能与曲拉通X-114形成稳定包结物的特性,阻断曲拉通X-114 分子与AEO-9分子之间的相互协同作用,同时破坏曲拉通X-114分子形成混合胶束,降低复配溶液中AEO-9 对曲拉通X-114 紫外光谱的干扰。与其他方法相比,本方法抗干扰能力强、操作简单,能够准确检测复配溶液中曲拉通X-114的浓度,回收率为99.0%~100.1%。
1 材料与方法
1.1 试剂与仪器
辛基苯基聚氧乙烯醚,纯度大于98%,上海麦克林生化科技有限公司;脂肪醇聚氧乙烯醚,纯度大于98%,江苏省海安石油化工厂;-环糊精,纯度大于98%,天津市光复精细化工研究所;NICOLET 6700 型红外光谱仪,Thermo Scientific;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;TA Q600 热重分析仪,美国TA 公司。Bruker avance Ⅲ600M 核磁共振波谱仪,瑞士Bruker公司。
1.2 实验方法
采用紫外光谱法研究系列水溶液中AEO-9 对曲拉通X-114的紫外吸光度及表观的影响。通过加入适量的-CD以消除AEO-9对曲拉通X-114的干扰,首先研究-CD 对曲拉通X-114 紫外光谱的抗干扰性能,进而研究-CD 破坏曲拉通X-114分子形成混合胶束的性能。然后采用等摩尔连续变化法(Job's法)测定曲拉通X-114/-CD包结物的包结比,同时配制一系列已知浓度的曲拉通X-114/AEO-9 复配水溶液,验证方法的准确性。再结合红外光谱表征(FTIR)、核磁共振氢谱表征(H NMR,DO 作为溶剂)及与热重差热分析表征(TG-DSC),分析曲拉通X-114 与-CD 包结物(原料的摩尔比为1∶1)的包结过程。
2 结果与讨论
2.1 AEO-9对曲拉通X-114紫外光谱的影响
测定0.100mmol/LAEO-9水溶液、0.300mmol/L曲拉通X-114 水溶液以及0.100mmol/L AEO-9/0.300mmol/L曲拉通X-114复配水溶液的紫外光谱,如图1所示。

图1 AEO-9、曲拉通X-114/AEO-9复配水溶液及曲拉通X-114的紫外光谱图
图1 表明,在200~350nm 范围内,曲拉通X-114 的最大吸收波长为223nm,AEO-9 的紫外吸光度可忽略。在复配水溶液中,AEO-9 会对曲拉通X-114的吸光度产生一定影响,当水溶液中AEO-9的浓度为0.100mmol/L 时,0.300mmol/L 曲拉通X-114 在223nm 处的吸光度由2.654 减少到2.565,降幅达3.4%。AEO-9 对曲拉通X-114 紫外光谱的影响,必然会对紫外光谱法检测曲拉通X-114产生干扰。
2.2 AEO-9对曲拉通X-114临界胶束浓度的影响
测定一系列浓度曲拉通X-114/AEO-9 复配水溶液在223nm处的吸光度,如图2所示。
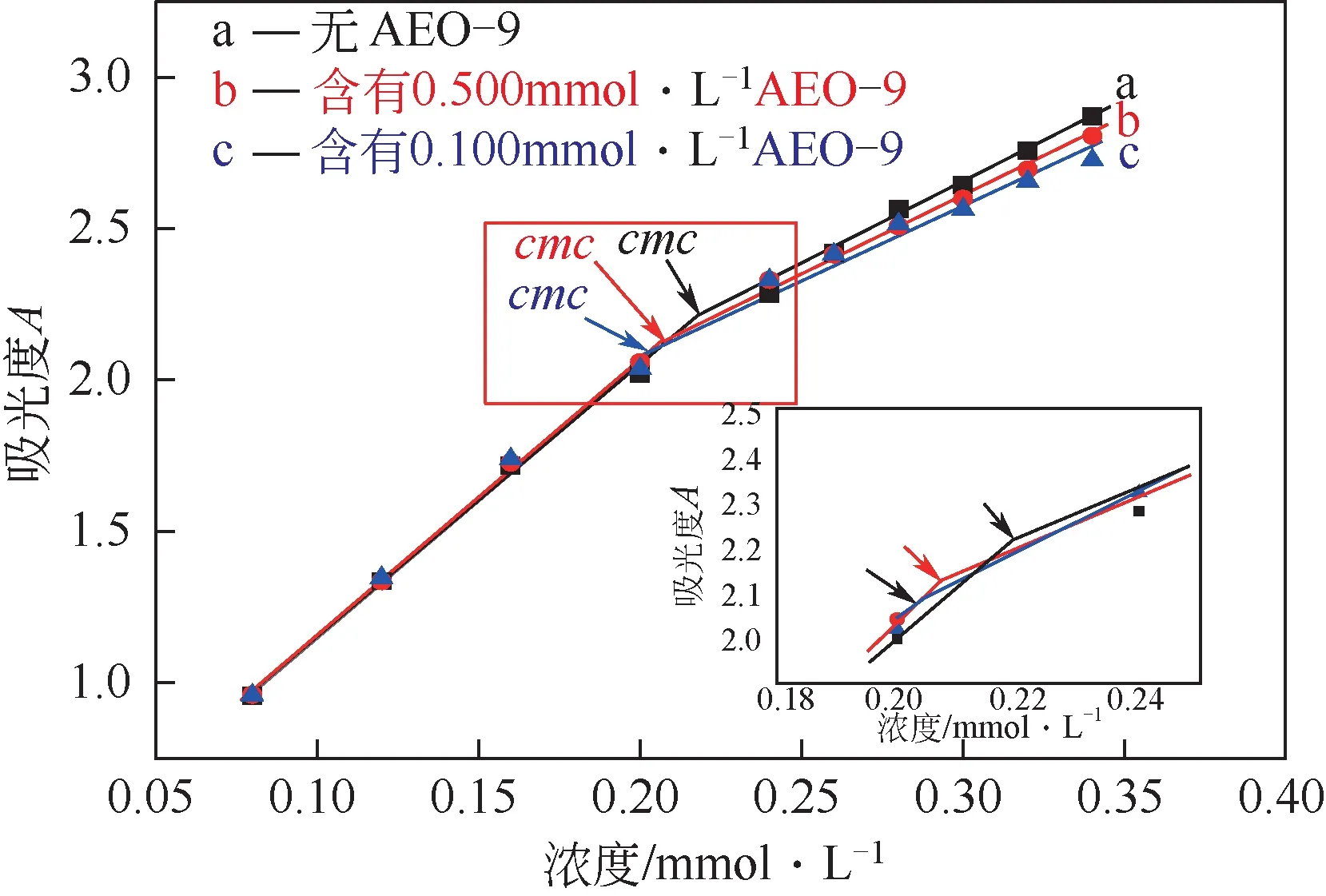
图2 不同浓度AEO-9水溶液中曲拉通X-114的紫外吸光度随浓度变化曲线
由图2 可知,曲拉通X-114 在纯水中的为0.219mmol/L, 加 入 浓 度 为 0.050mmol/L 和0.100mmol/L 的AEO-9 后,曲拉通X-114 表观分别降至0.207mmol/L和0.202mmol/L。可见在水溶液中AEO-9确能降低曲拉通X-114的表观,且曲拉通X-114的表观的变化程度与AEO-9的含量相关;复配水溶液中曲拉通X-114表观的不确定性,导致无法再依据曲拉通X-114的表观按浓度范围建立定量标准曲线,从而给复配溶液中曲拉通X-114的检测带来困难。由于曲拉通X-114与AEO-9 均为非离子型表面活性剂,二者之间的相互协同作用极有可能促使AEO-9 与曲拉通X-114共同参与了胶束化过程,从而降低了曲拉通X-114形成胶束所需的浓度。
2.3 β-CD 降低AEO-9 对曲拉通X-114 紫外光谱的干扰
保持水溶液中-CD浓度为0.100mmol/L,分别测 定0.100mmol/L AEO-9、 0.100mmol/L AEO-9/0.300mmol/L 曲拉通X-114 复配溶液以0.300mmol/L曲拉通X-114的紫外光谱,如图3所示。

图3 AEO-9、曲拉通X-114/AEO-9复配水溶液及曲拉通X-114在β-CD水溶液中的紫外光谱
由图3 可知,在0.100mmol/L-CD 水溶液中,0.300mmol/L 曲拉通X-114 及其与0.100mmol/L AEO-9 复配水溶液中在最大吸收波长223nm 处的吸光度仅从2.501 降到2.463,降幅为1.5%,低于不添加-CD 时的降幅3.4%(详见图1 分析),表明了-CD确能有效降低AEO-9对曲拉通X-114的紫外光谱干扰影响。这可能是因为-CD与曲拉通X-114优先形成稳定的包结物,阻断曲拉通X-114分子与AEO-9 分子之间的相互协同作用从而产生干扰。
2.4 β-CD 消除AEO-9 对曲拉通X-114 胶束化作用的干扰
在浓度为0mmol/L、0.050mmol/L和0.100mmol/L的AEO-9 水溶液中,按物质的量比1∶1 加入曲拉通X-114 和-CD,曲拉通X-114/AEO-9 复配水溶液在223nm处的紫外光谱,如图4所示。

图4 β-CD降低AEO-9对曲拉通X-114紫外光谱的干扰
由 图4 可 知, 当AEO-9 的 浓 度 为0、0.050mmol/L和0.100mmol/L时,以曲拉通X-114的物质的量计,按物质的量比1∶1加入-CD后,在0.050~0.300mmol/L 范围内,曲拉通X-114 的紫外光谱强度随浓度的变化曲线均没有出现拐点(曲线a、b和c)。对比图2,相同浓度下曲拉通X-114在水溶液中的表观分别为0.219mmol/L、0.207mmol/L 和0.202mmol/L,可见加入-CD 后,由于空腔的保护, 曲拉通X-114 在0.05~0.300mmol/L范围内难以形成胶束,表明了-CD具有消除曲拉通X-114/AEO-9 复配溶液胶束干扰的能力。这可能是由于-CD 进入曲拉通X-114 空腔内形成包结物后,阻止曲拉通X-114/AEO-9 复配溶液胶束的形成,并将曲拉通X-114分子与AEO-9 分子“隔离”,切断了曲拉通X-114 与AEO-9 之间的协同作用,使复配体系还原为“性质均一”的溶液状态。
2.5 曲拉通X-114/β-CD包结物的包结比分析
为了明确曲拉通X-114/-CD 形成包结物的浓度,采用等摩尔连续变化法(Job's 法)研究曲拉通X-114/-CD 包结物物质的量之比。保持水溶液中曲拉通X-114 与-CD 的总浓度为0.400mmol/L,改变水溶液中曲拉通X-114的摩尔分率,以相同浓度曲拉通X-114溶液(不加-CD)作为检测背景,扣除检测背景后,水溶液中曲拉通X-114的紫外光谱强度变化,如图5所示。

图5 曲拉通X-114/β-CD包结物的Job's曲线
在图5 所示的Job's 曲线中,当曲拉通X-114的摩尔分率为0.5时,Job's曲线出现拐点,表明了在水溶液中曲拉通X-114 与-CD 按物质的量之比1∶1进行包结。
2.6 β-CD 降低AEO-9 对曲拉通X-114 干扰验证实验分析
在一系列不同浓度曲拉通X-114水溶液中按物质的量比1∶1 加入-CD,测定曲拉通X-114 在223nm 处的吸光度,测定曲拉通X-114 在-CD 水溶液的定量标准曲线(曲线方程为=8.5208+0.2359),如图6所示。

图6 曲拉通X-114在β-CD水溶液中的定量标准曲线
分别采用图6 中的定量标准曲线及曲拉通X-114 在纯水中的定量标准曲线(图2 中曲线a),测定一系列已知浓度复配水溶液中的曲拉通X-114的含量,验证-CD 的抗干扰效果,测定结果见表1。表1 中a 定量曲线为:按图1 曲线a 计算;b定量曲线为=8.5208+0.2359,温度25℃;c定量曲线同b,温度50℃;d定量曲线同b,NaCl浓度为500mg/L。

表1 曲拉通X-114/AEO-9复合溶液中曲拉通X-114定量验证试验
由表1可知,基于纯水中建立的曲拉通X-114的定量标准曲线,检测复配溶液中曲拉通X-114的回收率为95.8%~103.3%;而基于-CD 水溶液中建立的曲拉通X-114的定量标准曲线,检测复配溶液中曲拉通X-114的回收率为99.0%~100.1%,与不添加-CD相比,检测准确度显著提高。表明了按曲拉通X-114的物质的量比1∶1加入-CD,确实能明显降低AEO-9 对曲拉通X-114 紫外光谱的干扰作用。表1 还表明,温度和NaCl 含量对-CD降低AEO-9 对曲拉通X-114 紫外光谱干扰的影响较低。
2.7 β-CD/曲拉通X-114键合作用分析
对-CD 及-CD/曲拉通X-114 包结物进行FTIR、H NMR 及TG-DSC 表征分析,结果分别如图7~图11所示。

图7 β-CD、曲拉通X-114/β-CD包结物以及曲拉通X-114的红外光谱图

图8 β-CD和曲拉通X-114/β-CD的DSC曲线

图9 β-CD和曲拉通X-114/β-CD的TGA曲线
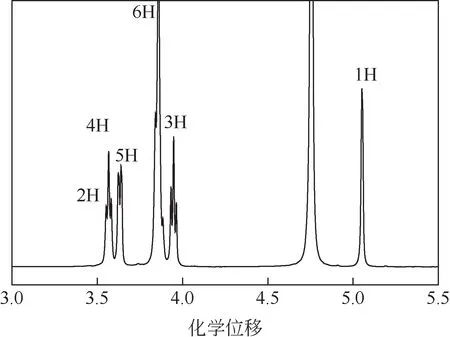
图10 β-CD的1H NMR谱
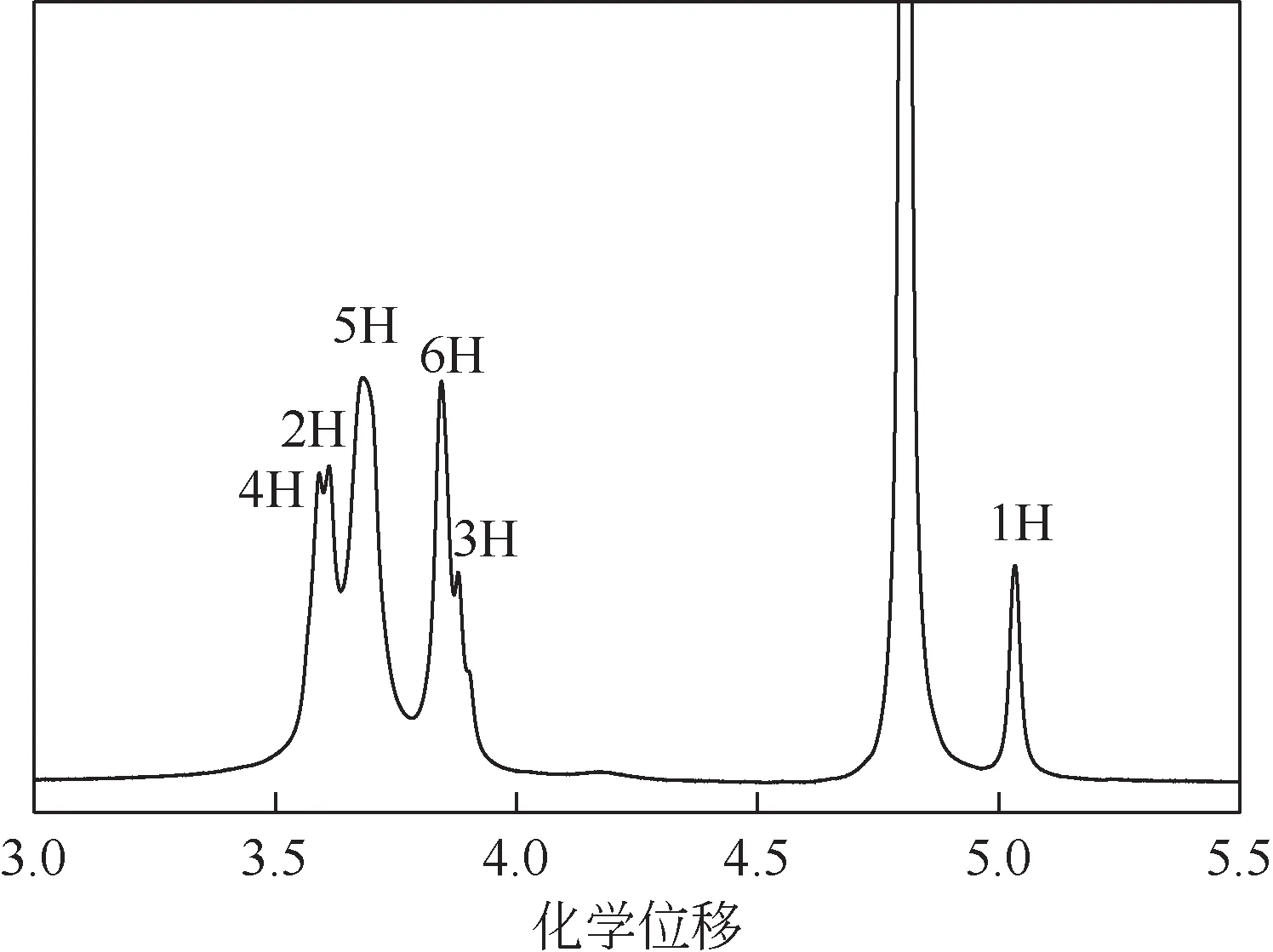
图11 曲拉通X-114/β-CD包结物的1H NMR谱
由图7 中曲线a 和曲线b 可知,在形成包结物后,-CD 的骨架结构没有发生明显变化。对比曲线b 和曲线c 可知,包结物的红外光谱图中出现了曲拉通X-114的特征吸收峰(1514cm归属于曲拉通X-114分子中C==C基团骨架振动峰,1242cm归属于曲拉通X-114 分子中C—O—C 基团伸缩振动峰),表明了曲拉通X-114 存在于曲拉通X-114/-CD 包结物结构中。由曲线a 和曲线b 可知,-CD 与曲拉通X-114 形成包结物后,在1031cm处归属于-CD分子中糖苷键的伸缩振动峰强度发生了变化,由于该基团处在-CD 分子内腔的中间,表明了包结物结构中曲拉通X-114分子已经深入了-CD 分子内腔。在图7 中1153cm处归属于-CD 锥形分子小口径端伯羟基的弯曲振动峰和1409cm处归属于-CD 锥形分子大口径端仲羟基的弯曲振动峰吸收强度也都发生了明显改变,表明了曲拉通X-114 分子与-CD 分子两端口径上的羟基都可能产生了氢键等相互作用,据此推测出曲拉通X-114 分子可以从-CD 分子两端进入其空腔,进而形成包结物。
从图8 可以看出,-CD(曲线a)在108℃出现明显吸热峰,相对应的TGA曲线中(图9中曲线a)-CD 在108℃也出现了一定的质量损失,由此可推测出108℃为-CD失去结晶水的温度;图8中-CD 在312℃出现了明显吸热峰,图9 中-CD 在312℃对应地出现了显著的质量损失,可见312℃为-CD发生分解的温度。
图8 还表明,曲拉通X-114/-CD 包结物在340℃出现了明显吸热峰,图9 中曲拉通X-114/-CD 包结物在340℃对应地出现了明显的质量损失,可见340℃为曲拉通X-114/-CD 包结物分解的温度。
对比图8、图9可知,曲拉通X-114/-CD包结物在340℃发生分解,包结物在108℃和312℃均没有出现明显的吸热峰,相对应的TGA曲线在108℃和312℃也没有出现明显的质量损失,表明了在包结物形态中,曲拉通X-114 和-CD 与自由态时的物性已发生了显著变化,可见形成包结物后曲拉通X-114和-CD之间形成了较强的相互作用。
-CD 分子由7 个D-吡喃葡萄糖单元环接而成,每个D-吡喃葡萄糖单元包含6种与—C—基团相连接的质子,以连接D-吡喃葡萄糖单元的—C—基团作为1H,依次标记为1H~6H,其中3H和5H位于-CD分子空腔的内侧。
从表2 可以看出,形成包结物后-CD 分子中1H~6H的化学位移均发生了一定程度变化,表明包结物结构中6 种与—C—基团相连接的质子与-CD 纯物质中这些位置质子的所处环境发生了明显变化。表2还表明,-CD分子中3H、5H与包结物中3H、5H 的化学位移值变化最大,由于3H 和5H是位于-CD分子空腔内侧的质子,它们同时发生较大的化学位移,表明了曲拉通X-114分子进入了-CD 分子的内部空腔,形成了较稳定的包结物。

表2 不同状态下β-CD的1H~6H的化学位移
综上所述,可知在曲拉通X-114/AEO-9 复配水溶液中,AEO-9 能改变曲拉通X-114 的表观,按物质的量1∶1加入的-CD后,-CD优先与曲拉通X-114 形成包结物,致使混合胶束解离,-CD 包结曲拉通X-114 及破坏其胶束结构可能的过程如图12所示。

图12 曲拉通X-114/AEO-9水溶液中曲拉通X-114与β-CD相互作用可能机理
3 结论
(1)在曲拉通X-114 与AEO-9 复配溶液中,AEO-9 不仅对紫外光谱法检测曲拉通X-114 产生了明显干扰,还导致曲拉通X-114 的表观下降,致使紫外光谱法检测曲拉通X-114的准确度明显降低。
(2)加入摩尔比为1∶1的-CD后(以曲拉通X-114 的物质的量计),紫外光谱法能准确检测复配体系中曲拉通X-114 的含量,通过建立-CD 与曲拉通X-114的定量标准曲线能较准确检测曲拉通X-114/AEO-9 复配溶液中的曲拉通X-114 的浓度,回收率为99.0%~100.1%。
(3)水溶液中-CD 和曲拉通X-114 形成包结物,这种包结作用有效阻止了曲拉通X-114/AEO-9复配溶液胶束的形成,并将曲拉通X-114 分子与AEO-9 分子“隔离”,切断了曲拉通X-114 与AEO-9 之间的协同作用,从而降低了AEO-9 对曲拉通X-114的干扰作用。
