丛枝菌根真菌对高寒草地6种禾本科牧草生长的影响
2022-04-25张海娟芦光新范月君周华坤周学丽窦声云姚世庭颜珲璘赵阳安祁岩慧苟恒瑞
张海娟, 芦光新*, 范月君, 周华坤, 周学丽, 窦声云, 姚世庭, 颜珲璘,马 坤, 赵阳安, 祁岩慧, 苟恒瑞
(1.青海大学农牧学院, 青海 西宁 810016; 2.中国科学院西北高原生物研究所, 青海省寒区恢复生态学重点实验室, 青海 西宁 810008; 3.青海省草原改良试验站, 青海 共和 813000; 4.青海农牧科技职业学院, 青海 湟源 812100)
丛枝菌根(Arbuscular mycorrhizal,AM)真菌是一类重要的共生微生物,它能与80%以上的陆生植物互惠共生形成菌根[1]。研究表明,菌根能促进植物生长[2-3],增加植物的生物量[4-6],促进植物根系的发育[7]。在调节植物种间关系[8-9]、维持植物群落物种多样性[10-12]和改善植物根围土壤养分环境[13]等方面也发挥着重要作用。
高寒草地是青藏高原最主要的生态系统,具备调节气候和涵养水源等生态系统服务功能[14]。然而,由于受全球变化及人类活动的影响,高寒草地遭受严重退化[15]。禾本科牧草是目前应用于高寒草地的主要播种植物,但种源偏少,且在高寒冷凉的环境条件下植物群落极不稳定,易造成二次退化,严重限制了退化高寒草地植被恢复进程[16]。因此,研究利用AM真菌开展退化高寒草地禾本科牧草的恢复具有重要意义。
目前,AM真菌促生的研究多集中在农业作物等领域[17-18],对高寒草地多年生禾本科牧草促生的研究较少,且不同AM真菌对高寒草地不同禾本科牧草的接种效应是否一致亦不明确。为此,本研究通过对青海省退化高寒草地恢复中常用的6种多年生禾本科牧草扁穗冰草(Agropyroncristatum)、‘青牧1号’老芒麦(Elymussibiricus‘Qingmu No.1’)、寒生羊茅(Festucakryloviana)、冷地早熟禾(Poacrymophila)、‘川草2号’老芒麦(Elymussibiricus‘Chuancao No 2’)和‘阿坝’垂穗披碱草(Elymusnutans‘Aba’)分别接种2种AM真菌根内球囊霉(Glomusintraradices,GI)和摩西球囊霉(Glomusmosseae,GM),探讨AM真菌对高寒草地多年生禾本科牧草的促生效应,以期为退化高寒草地生态修复中植物微生物联合生态修复技术的应用提供技术指导和科学依据。
1 材料与方法
1.1 试验材料
试验材料为青海省退化高寒草地恢复中常用的的6种多年生禾本科牧草,来源及基本信息见表1。种子播种前,用10%H2O2消毒10 min,用无菌水冲洗5次,用滤纸吸干水分使用。供试AM真菌菌剂由长江大学吴楚教授馈赠的根内球囊霉(Glomusintraradices,GI)和摩西球囊霉(Glomusmosseae,GM),经白三叶草扩繁两个月后获得的包含根段、丛枝、菌丝和孢子等的混合接种物。培养基质为田间土和河沙(3∶1,V/V)的混合物,经121℃高压蒸汽灭菌2 h后使用。田间土养分含量为:总氮703 mg·kg-1,氨态氮1.72 mg·kg-1,硝态氮35.62 mg·kg-1,有机碳0.87%。培养盆钵为18 cm × 15 cm × 13 cm(上口径×下口径×高)的塑料花盆,使用前用75%的酒精反复擦拭消毒。

表1 禾本科牧草种子基本信息
1.2 试验设计
试验设置接种根内球囊霉(GI)、接种摩西球囊霉(GM)和不接种(Control check,CK)3个处理,每个处理3次重复,每种牧草有9盆,共有54盆,随机排列,隔天调换位置。称400 g灭菌基质装盆,浇适量无菌水,均匀铺撒20 g供试AM真菌菌剂[19-20],覆灭菌基质60 g,每盆浇100 mL无菌水,以30粒每盆的播量分别播种6种禾本科牧草种子,覆土40 g,浇少量无菌水,出苗7 d后定苗至20 株·盆-1。试验在青海大学农牧实验楼草地微生物实验室进行,自然采光,白天温度为(22 ± 2)℃,夜间温度为(18 ± 2)℃。培养周期为45 d(2021年4月30日至2021年6月13日),栽培期间每周浇1次Hoagland营养液[21-23],每次100 mL。
1.3 测定指标与方法
牧草生长指标:栽培期间,每3周用直尺测定一次植物株高,每盆随机测定10株,共测2次(第3和6周);试验结束后,每个处理随机挖取5株健康植株,表面清洗干净后用滤纸擦干,分别称取单株地上和地下生物量,3次重复;称量结束后的完整植物根系用根系扫描仪(Epson Perfection V800 Photo)扫描成像,并用WinRHIZO分析图像获得根系相关指标的数据。
菌根侵染率:采用台盼蓝染色法检测2种AM真菌对6种禾本科植物的菌根侵染率[23],并按Biermann等的方法计算菌根侵染率[24]。
1.4 数据分析
用Excel软件整理数据,用IBM SPSS 26.0软件做单因素方差分析(One-way ANOVA),Duncan法多重比较,用Spearman相关分析检验菌根侵染率与牧草各生长指标的相关性。
2 结果与分析
2.1 接种AM真菌对6种禾本科牧草菌根侵染率的影响
由图1可知,CK处理无菌根侵染的迹象(图1a),而接种GI和GM的处理均能检测到孢子和泡囊等菌根结构(图1b,1c),但2种AM真菌对6种禾本科牧草的菌根侵染率之间存在差异。经分析,GI对‘川草2号’老芒麦、‘阿坝’垂穗披碱草、‘青牧1号’老芒麦和扁穗冰草的侵染率明显高于GM(P<0.05),对冷地早熟禾的菌根侵染率GM大于GI(P<0.05),而2种AM真菌对寒生羊茅的菌根侵染率之间无显著差异(表2)。进一步分析发现,GI对‘川草2号’老芒麦、‘阿坝’垂穗披碱草、‘青牧1号’老芒麦和扁穗冰草的侵染率之间差异不显著,对寒生羊茅和冷地早熟禾的菌根侵染率之间差异不显著,‘川草2号’老芒麦、‘阿坝’垂穗披碱草、‘青牧1号’老芒麦和扁穗冰草的菌根侵染率与寒生羊茅和冷地早熟禾的菌根侵染率之间差异显著(P<0.05)。GM对‘川草2号’老芒麦、‘阿坝’垂穗披碱草、‘青牧1号’老芒麦、扁穗冰草和寒生羊茅的侵染率之间差异不显著,与冷地早熟禾的菌根侵染率之间差异显著(P<0.05)。

表2 2种AM真菌对6种禾本科牧草菌根侵染率的影响

图1 2种AM真菌与6种禾本科牧草识别共生形成菌根情况
2.2 接种AM真菌对6种禾本科牧草株高的影响
与CK相比,接种AM真菌对6种禾本科牧草株高的影响存在差异。栽培3周后,6种禾本科牧草的株高依次为‘阿坝’垂穗披碱草>‘川草2号’老芒麦>‘青牧1号’老芒麦>扁穗冰草>寒生羊茅>冷地早熟禾(P< 0.05),GI和GM对‘阿坝’垂穗披碱草株高的影响显著大于CK(P< 0.05),GM对‘川草2号’老芒麦株高的影响显著高于CK(P< 0.05),其余4种禾本科牧草的株高在不同接种处理间差异均不显著,而不同牧草的株高在同种接种处理间差异显著(P< 0.05,图2)。栽培6周后,6种禾本科牧草株高的变化趋势与栽培3周后株高的变化趋势有所差异,GI和GM对6种禾本科牧草株高的影响与CK相比均无显著差异,‘川草2号’老芒麦、‘阿坝’垂穗披碱草和扁穗冰草的株高在相同接种处理间差异不显著,与其余3种禾本科牧草的株高间差异显著(P< 0.05,图2)。
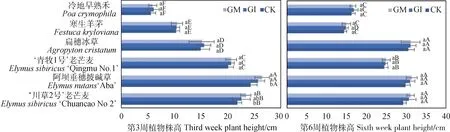
图2 接种AM真菌对6种禾本科牧草株高的影响
2.3 接种AM真菌对6种禾本科牧草生物量的影响
2.3.1地上生物量 与CK相比,接种AM真菌使6种禾本科牧草的地上生物量不同程度增加。方差分析结果表明,接种GI和GM对扁穗冰草和寒生羊茅地上生物量的影响与CK相比无显著差异,冷地早熟禾的地上生物量表现为CK和GI组显著低于GM组(P<0.05),GM对‘川草2号’老芒麦、‘阿坝’垂穗披碱草和‘青牧1号’老芒麦地上生物量的影响与CK相比无显著差异,而GI对这3种牧草的接种效应显著高于CK(P<0.05)。不同禾本科牧草的地上生物量在相同接种处理间有所差异,‘川草2号’老芒麦、‘阿坝’垂穗披碱草和‘青牧1号’老芒麦间差异不显著,寒生羊茅与冷地早熟禾间差异不显著,与扁穗冰草间差异均显著(P<0.05)(图3)。

图3 接种AM真菌对6种禾本科牧草地上生物量的影响
2.3.2地下生物量 与CK相比,接种GI和GM的处理地下生物量相对较高(图4)。同种禾本科牧草的地下生物量在不同接种处理间存在差异,GI对‘川草2号’老芒麦、‘青牧1号’老芒麦和冷地早熟禾地下生物量的影响显著高于GM和CK(P<0.05),GM对扁穗冰草和寒生羊茅地下生物量的影响显著高于GI和CK(P<0.05),对‘阿坝’垂穗披碱草则是GI和GM均显著高于CK(P<0.05),GI与GM间无显著差异。不同禾本科牧草的地下生物量在同种接种处理间存在差异,‘川草2号’老芒麦、‘阿坝’垂穗披碱草和‘青牧1号’老芒麦间差异不显著,寒生羊茅与冷地早熟禾之间差异不显著,与扁穗冰草间差异显著(P<0.05)。
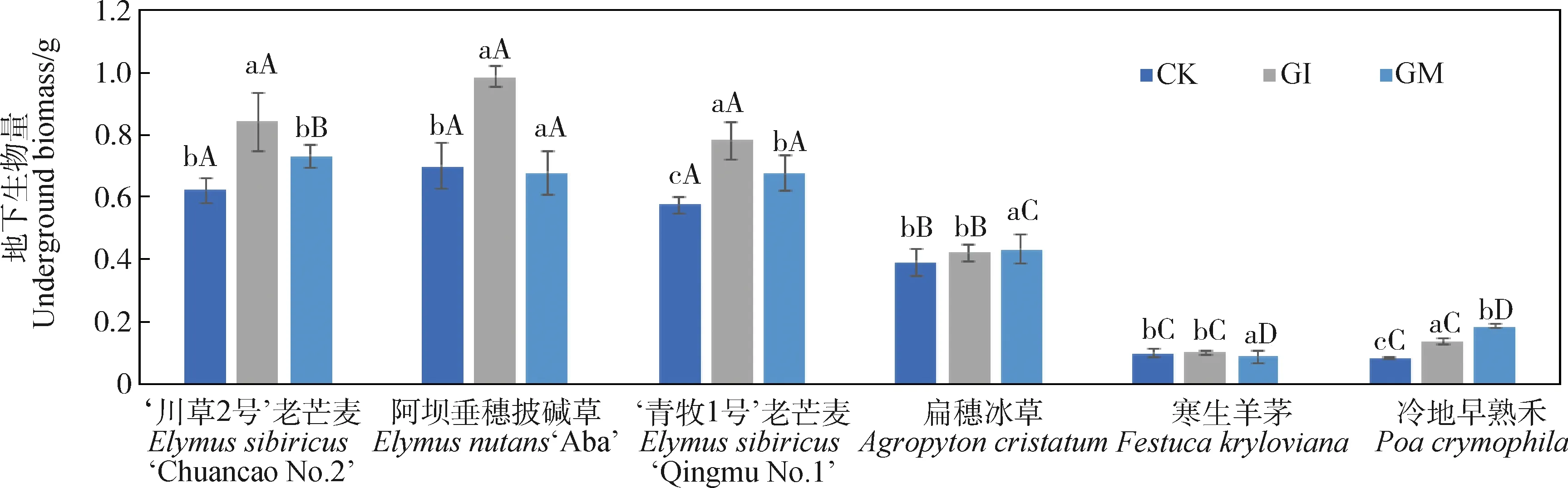
图4 接种AM真菌对6种禾本科牧草地下生物量的影响
2.4 接种AM真菌对6种禾本科牧草根系发育的影响
除了寒生羊茅和冷地早熟禾外,总根长均是GI和GM显著高于CK(P< 0.05),GI和GM对‘川草2号’老芒麦、‘阿坝’垂穗披碱草和扁穗冰草的总根长均无显著差异,对‘青牧1号’老芒麦为GI显著高于GM(P< 0.05)。与CK相比,接种GI和GM对6种禾本科牧草的总根表面积、总根体积、总根尖数和分枝数均有一定的促进作用,促进程度因牧草种类不同而异,GI和GM对根平均直径的影响与CK相比无显著差异,或低于CK(表3)。
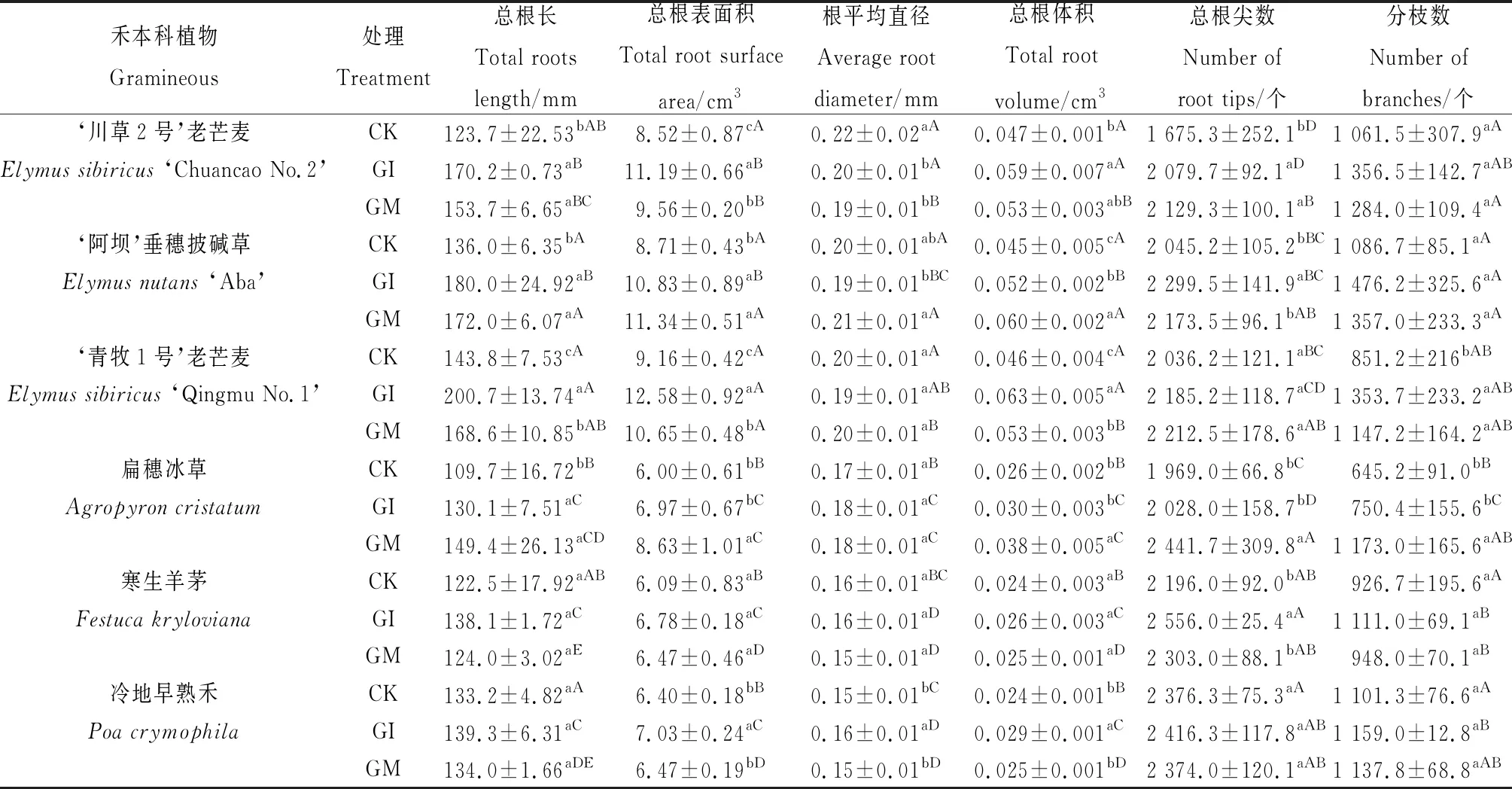
表3 2种AM真菌对6种禾本科牧草根系发育的影响
2.5 菌根侵染率与禾本科牧草株高、生物量和根系指标之间的相关性
不同禾本科牧草的菌根侵染率(表2)与其株高、生物量以及根系发育之间的关系不一致(表4)。菌根侵染率与根平均直径间存在一定的负相关,与总根长、总根表面积、总根体积、总根尖数、分枝数、地上和地下生物量以及第3和6周株高之间存在一定的正相关关系。‘川草2号’老芒麦的菌根侵染率与总根长、总根表面积和总根体积之间呈显著正相关关系(P< 0.05);‘阿坝’垂穗披碱草的菌根侵染率与总根长和分枝数之间呈显著正相关关系(P<0.05),与地上生物量之间呈极显著正相关关系(P<0.01);‘青牧1号’老芒麦的菌根侵染率与总根长、总根表面积、总根体积、分枝数和地下生物量之间呈极显著正相关关系(P<0.01),与地上生物量间呈显著正相关关系(P<0.05);冷地早熟禾的菌根侵染率与地上生物量之间呈极显著正相关关系(P<0.01)。
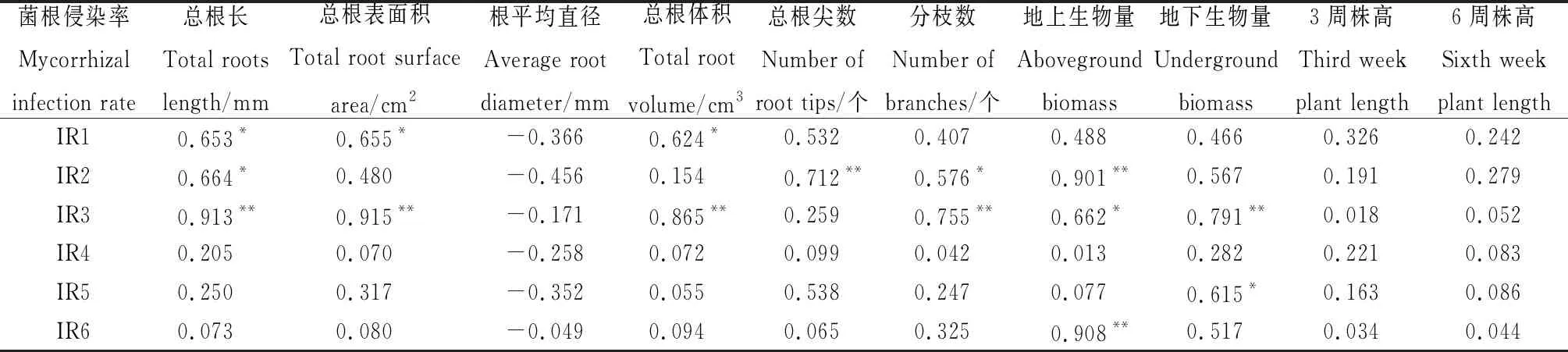
表4 菌根侵染率与禾本科牧草株高、生物量和根系指标之间的相关性
3 讨论
3.1 AM真菌对禾本科植物株高和生物量的影响
本研究通过对扁穗冰草等6种多年生禾本科牧草接种GI和GM后发现,牧草株高在栽培3周和6周时变化不一致。栽培3周时,接种GI和GM的‘阿坝’垂穗披碱草和‘川草2号’老芒麦的株高显著高于CK,而其余4种牧草的株高在不同接种处理间差异不显著。然而,当生长到6周时,接种GI和GM的6种禾本科牧草的株高均与CK相比无显著差异。潘越等[3]和谢开云等[5]也得出了与本研究相似的结论,即接种AM真菌对禾本科牧草株高无显著影响。但是,也有研究表明,接种AM真菌能显著增加植株高度,如田野等对黑麦草(Loliumperenne)接种GM后,黑麦草的株高比CK高[25];师艳丽等对宽叶雀稗(Paspalumwettsteinii)分别接种隐类球囊霉(Glomusoccultum)、GM和GI后,其株高也高于CK[26];同样,杨海霞等对草地早熟禾(Poaparatensis)和高羊茅(Festucaarundinacea)接种AM真菌后其株高显著增加[27]。这可能是因为不同禾本科牧草对不同AM真菌的菌根依赖性不同所致,也可能由于栽培条件等不同引起。
本研究结果表明,接种AM真菌能不同程度增加扁穗冰草等6种禾本科牧草的地上和地下生物量,GI对‘川草2号’老芒麦、‘阿坝’垂穗披碱草和‘青牧1号’老芒麦地上生物量的影响尤为显著。然而,潘越等和郭艳娥等对多年生黑麦草接种AM真菌后,黑麦草的地上和地下生物量显著低于CK[2-3];甄莉娜等对冷蒿(Artemmafrigida)接种AM真菌后,也得出与上述一致的结论[6]。可能是因供试宿主植物种类,菌种类型和栽培基质等不同所致,表明,不同AM真菌对不同禾本科植物的促生效应不同[28-29]。
3.2 AM真菌对禾本科植物根系发育的影响
通过研究发现,接种GI和GM对扁穗冰草等6种多年生禾本科牧草的根系发育具有一定的促进作用,除了寒生羊茅和冷地早熟禾外,接种AM真菌处理的总根长均显著高于CK,总根表面积、总根体积、总根尖数和分枝数也是接种AM真菌的处理较高,而根平均直径与CK相比无显著变化。其他研究者也得出了与本研究一致的结论。如徐雅梅等对2种垂穗披碱草(Elymusnutans)接种AM真菌后,其总根长、根系总表面积、根系平均直径和根尖数均显著高于CK[7];田野等对黑麦草接种GM后,黑麦草的根系长度表现为接种AM真菌的处理较高[25];师艳丽等对宽叶雀稗接种AM真菌后,宽叶雀稗的根长也明显高于CK[26]。以上研究表明,接种AM真菌对能促进禾本科植物的根系发育。但也有研究认为,接种AM真菌对植物根长无显著影响[4]。这可能因植物种类和AM真菌类型不同所致,也可能受培养周期、研究方法等因素的影响。
4 结论
接种丛枝菌根真菌对青海省退化高寒草地恢复中常用的6种多年生禾本科牧草的生长具有一定的促进作用。与对照相比,接种根内球囊霉和摩西球囊霉显著增加了扁穗冰草等6种多年生禾本科牧草的地上和地下生物量,促进了根系发育。因此,可以尝试将丛枝菌根真菌应用于退化高寒草地受损禾本科牧草的修复当中。
