13C尿素呼气试验检测值的判读价值
2022-04-25张明君赵静梁晗玮方妍彬蒋绚
张明君 赵静 梁晗玮 方妍彬 蒋绚
幽门螺杆菌(Hp)是定植于胃黏膜的革兰阴性杆菌,被定义为Ⅰ类致癌物质,与酸相关性疾病密切相关。2015年京都全球共识提出,Hp胃炎是一种传染性疾病,所有Hp感染者均应予根除,除非有抗衡因素[1]。我国共识现阶段仍保留Hp根除治疗指征,主动对获益较大的个体进行检测和治疗[2]。Hp感染是全球性公共健康问题。我国Hp感染率高,占普通人群的50%~60%。中国幽门螺杆菌根除与胃癌防控的专家共识提出在萎缩发生之前或无症状阶段根除Hp受益大,可预防胃癌发生,其风险下降程度依赖于根除时胃黏膜萎缩的严重程度和范围[3]。13C尿素呼气试验(13C-UBT)是检测Hp感染最常用的无创手段,根据测定服药前后呼气样本中13CO2/12CO2浓度比的变化量判断是否感染Hp,检测结果是有连续变量特点的DOB(delta over baseline)值[4]。这种无创检查是否可以部分替代内镜检查,DOB值的高低是否可以反映Hp胃内定植密度、胃黏膜炎症程度是临床值得关注的问题,目前研究结论不一[5-7]。本文旨在全面研究DOB值与消化道症状、胃内Hp定植密度、内镜下及组织学胃炎严重程度、萎缩肠化情况的相关性,进一步了解13C-UBT检测值的判读价值有很好的临床实用性及经济-卫生学意义。
对象与方法
1.对象:2020年4月~12月于我院行13C-UBT及胃镜检查并取活检的患者(13C-UBT与胃镜检查间隔1个月以内)257例,其中男135例,女122例,年龄23~84岁,平均年龄(49.96±13.22)岁。排除标准:2周内使用质子泵抑制剂或H2受体阻滞剂;1个月内接受抗感染药物治疗;既往有Hp根除史;胃部手术史及胃部恶性肿瘤;存在肝硬化、尿毒症、非甾体抗炎药(NSAIDs)用药史等可引起胃部病变的基础疾病。根据DOB值将257例患者分为5组:1组(0≤DOB<4)95例、2组(4≤DOB<8)31例、3组(8≤DOB<20)49例、4组(20≤DOB<40)48例、5组(DOB≥40)34例。1组为Hp阴性患者(0≤DOB<4,Hp阴性组),共95例,2~5组为Hp阳性患者(DOB≥4,Hp阳性组),共162例。5组患者平均年龄分别为(50.48±13.09)岁、(50.23±14.69)岁、(48.93±11.13)岁、(50.65±13.79)岁、(48.76±14.71)岁,男性所占比例分别为52.6%、54.8%、55.1%、45.8%与44.1%,5组患者年龄及性别构成比较差异均无统计学意义(P>0.05)。本研究经我院伦理委员会审批通过。
2.方法
(1)临床资料收集:包括患者的性别、年龄及主要消化道症状。
(2)胃镜下分型分级诊断情况:参照2004年中华医学会消化内镜学分会慢性胃炎的分型分级标准[8],若见到两种以上表现,以主要诊断为主。分型包括浅表性胃炎(红斑性胃炎)、出血性胃炎、糜烂性胃炎及萎缩性胃炎,前3种归纳为非萎缩性胃炎。
(3)13C-UBT:采用广州华友明康光电科技有限公司生产的型号为HY-IREXB的检测仪和北京华亘安邦科技有限公司生产的尿素呼气试验诊断试剂盒(幽立显,50 mg)。检测当日应禁食12 h以上,按说明书要求进行检测。
(4)组织病理学检查:①炎症情况(包括慢性炎症及急性炎症)及萎缩、肠化情况。于内镜下炎症最严重的部位病理活检,组织学变化包括Hp感染、慢性炎性反应、活动性、萎缩、肠化。分级采用直观模拟评分法:0提示无,+提示轻度,++提示中度,+++提示重度[9]。②Hp密度:采用特殊染色(美兰法)观察Hp的密度,根据我国慢性胃炎诊断标准和新悉尼系统判定:-提示无,+提示轻度,++提示中度,+++提示重度。
结 果
1.症状分布:33.1%(85例)患者无症状,66.9%(172例)患者有消化道症状,主要表现为上腹痛、消化不良、腹胀、反酸、烧心、消化道出血(呕血、黑便)。Hp阴性组上腹痛、消化不良及腹胀、反酸及烧心、出血、无症状患者分别为18例(18.9%)、46例(48.4%)、9例(9.5%)、1例(1.1%)、28例(29.5%),Hp阳性组分别为34例(21.0%)、59例(36.4%)、17例(10.5%)、3例(1.9%)、57例(35.2%),组间比较差异均无统计学意义(P>0.05)。1、2、3、4、5组患者间消化不良、腹胀症状比较差异有统计学意义(P=0.042),两两比较结果显示,1组和4组(χ2=5.991,P=0.014)、2组和4组间(χ2=6.160,P=0.013)比较差异均有统计学意义;其余症状5组间比较差异均无统计学意义(P>0.05)。见表1。
2.内镜下表现:Hp阴性组非萎缩性胃炎分级情况为1级35例(36.8%),2级25例(26.3%),3级2例(2.1%);Hp阳性组为1级32例(19.8%),2级71例(43.8%),3级12例(7.4%),两组间比较差异有统计学意义(χ2=7.965,P=0.005),Hp阳性组患者内镜下胃炎程度更严重。Hp阴性组萎缩性胃炎分级情况为1级24例(25.3%),2级10例(10.5%),3级0例;Hp阳性组为1级31例(19.1%),2级18例(11.1%),3级1例(0.6%),两组萎缩性胃炎分级比较差异无统计学意义(P>0.05)。5组患者间非萎缩性胃炎分级分布情况比较差异有统计学意义(P=0.003),而5组患者间萎缩性胃炎分级分布情况比较差异无统计学意义(P>0.05)。见表2。Mantel-Haenszelχ2检验结果显示非萎缩性胃炎分级与DOB分级之间存在关系且具有统计学意义(χ2=4.559,P=0.033);相关性检验结果显示,r=0.140,P=0.025,说明DOB值越高,非萎缩性胃炎程度越严重。
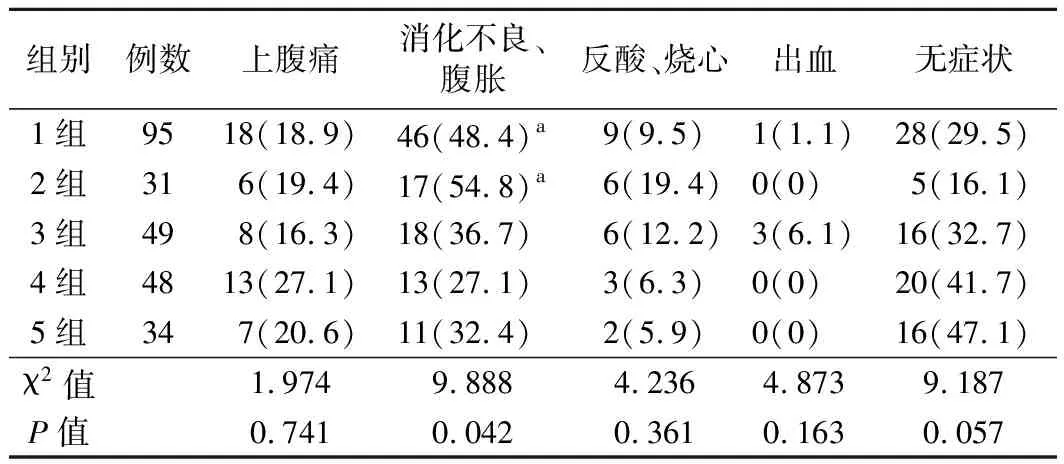
表1 5组患者症状分布比较[例,(%)]
3.胃黏膜组织学分析结果
(1)慢性炎症程度:Hp阴性组轻、中、重度炎症患者分别为81例(85.3%)、14例(14.7%)、0例,Hp阳性组分别为67例(41%)、91例(56.2)、4例(2.5%),多组间比较差异有统计学意义(χ2=47.339,P<0.001),Hp阳性组慢性炎症程度更重。5组慢性炎症程度的分布情况比较差异有统计学意义(χ2=67.376,P<0.001)。见表3。Mantel-Haenszelχ2检验结果显示,慢性炎症程度分级与DOB分级之间存在关系且具有统计学意义(χ2=49.402,P<0.001),相关性检验结果显示,r=0.451,P<0.001,说明DOB值越高,慢性炎症程度越严重。
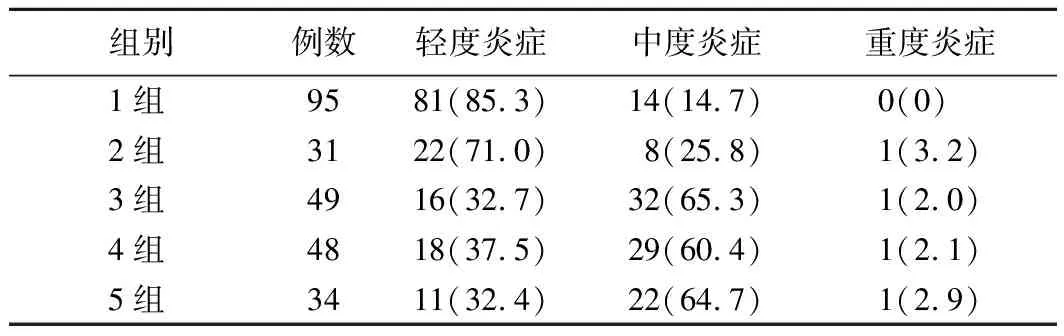
表3 5组患者胃黏膜组织慢性炎症程度分布比较[例,(%)]
(2)急性炎症程度:Hp阴性组轻、中、重度炎症患者分别为10例(10.5%)、10例(10.5%)、3例(3.2%),Hp阳性组分别为22例(13.6%)、84例(51.9%)、10例(6.2%),多组间比较差异有统计学意义(χ2=82.448,P<0.001),Hp阳性组急性炎症程度更重。5组患者胃黏膜组织急性炎症程度的分布情况比较差异有统计学意义(χ2=75.392,P<0.001)。见表4。Mantel-Haenszelχ2检验结果显示,急性炎症程度分级与DOB分级之间存在关系且具有统计学意义(χ2=53.680,P<0.001),相关性检验结果显示,r=0.470,P<0.001,说明DOB值越高,急性炎症程度越严重。
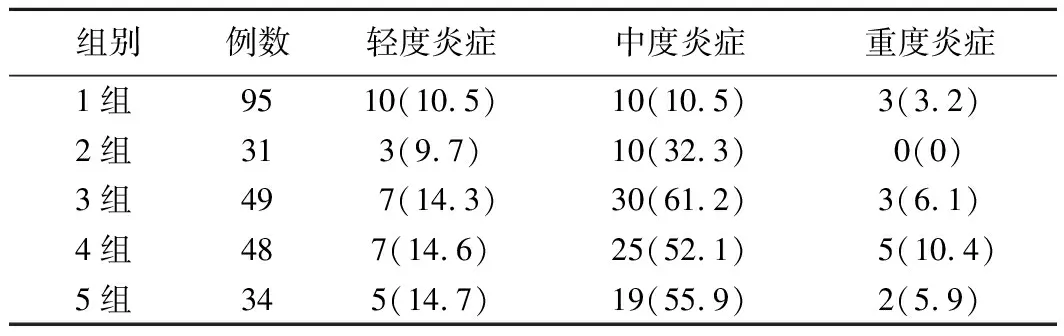
表4 5组患者胃黏膜组织急性炎症程度分布[例,(%)]
(3)萎缩、肠化情况:Hp阴性组萎缩、肠化的患者为43例(45.3%),Hp阳性组为57例(35.2%),两组间比较差异无统计学意义(χ2=2.559,P=0.110)。5组萎缩、肠化患者分别为43例(45.3%)、14例(45.2%)、15例(30.6%)、18例(37.5%)、10例(29.4%),5组间比较差异无统计学意义(χ2=4.873,P=0.301)。Hp阴性组及Hp阳性组间萎缩、肠化患者的平均年龄分别为(54.6±13.3)岁和(55.2±11.6)岁,差异无统计学意义(t=-0.245,P=0.807)。
(4)Hp密度:选取Hp阳性患者中胃窦、胃体均取活检者40例,选取两点中密度高者进行分析,各组Hp密度分布情况见表5。Mantel-Haenszelχ2检验结果显示,Hp密度与DOB分级之间存在关系且具有统计学意义(χ2=8.054,P=0.005),相关性检验结果显示,r=0.375,P=0.018,提示DOB值越高,Hp密度越高。
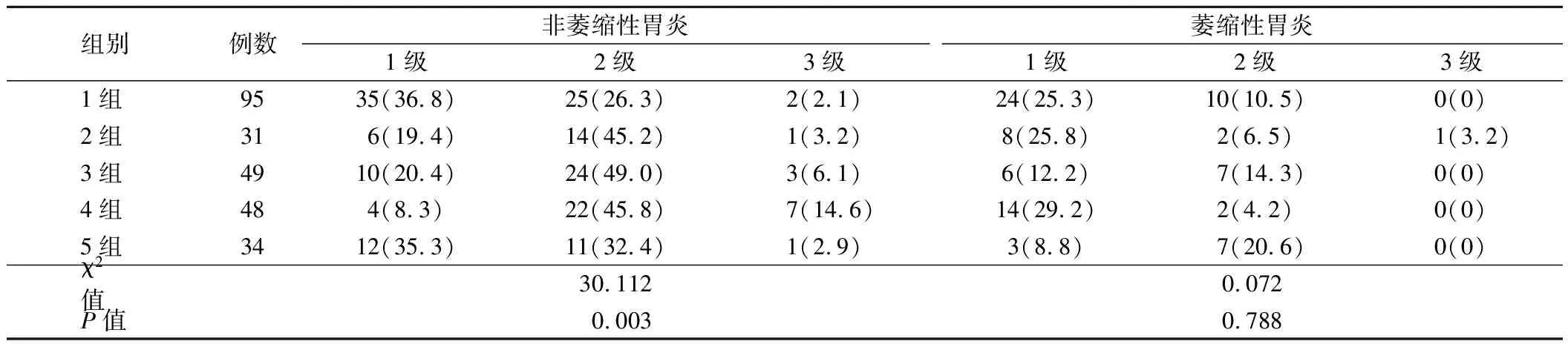
表2 5组患者内镜下胃炎程度分级比较[例,(%)]
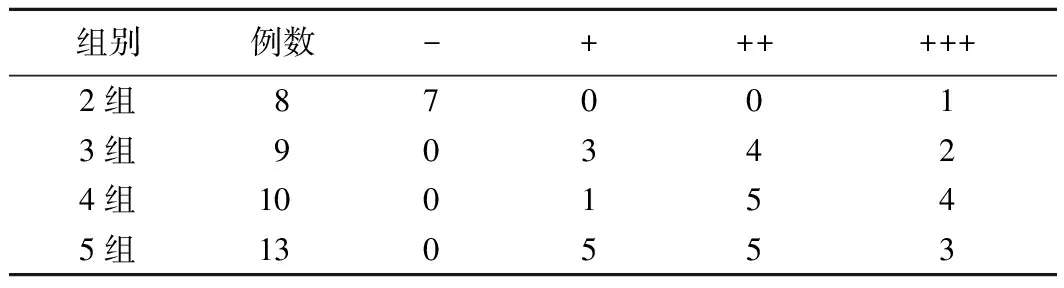
表5 Hp阳性患者不同组别胃组织Hp密度分布情况(例)
讨 论
Hp感染与消化性溃疡、胃黏膜相关淋巴组织淋巴瘤、胃癌等疾病息息相关,且可引起多种胃外疾病[10],因此检测、治疗Hp感染对治疗消化道疾病、预防胃癌及消化系统外疾病均有重要意义。
尿素呼气试验是目前应用最广泛的诊断Hp感染的无创检查手段,能反映全胃的实时状态,避免活检“灶性”分布的局限性。近年来13C-UBT在体检机构及医院中得到广泛应用,其正确及深入的判读具有重要临床意义[11]。
Hp感染后症状多不典型[12-13],可以没有消化道症状,也可表现为上腹痛、腹胀、反酸、烧心、消化不良、消化道出血等,症状分布与Hp阴性者无明显差异。本研究结果显示,DOB值高低无法预测临床症状的严重程度,即使是在DOB≥20的高滴度组仍有40%以上的无症状患者。因此对于Hp感染的判断仍需借助辅助检查手段,与共识意见符合[9]。
研究发现,几乎所有Hp现症感染者均存在慢性活动性胃炎[8],与Hp感染相关的普通白光内镜下表现主要为黏液附着、弥漫性发红、点状发红、皱襞增粗、黏膜水肿、集合小静脉消失、黏膜马赛克样改变或马赛克样改变伴中心或周围充血等[14]。本研究结果发现,Hp阳性组的内镜下非萎缩性胃炎表现(红斑、糜烂及出血)均重于Hp阴性组。目前尚缺乏DOB值与Hp感染镜下表现关联性的研究,本研究结果显示,随着DOB值升高,镜下红斑、糜烂及出血的表现加重;病理检查结果显示,Hp阳性组的组织学炎症程度相较Hp阴性组严重,胃黏膜急性以及慢性炎症程度分级均与DOB值呈正相关,提示DOB值可以在一定程度上预测镜下及组织学非萎缩性胃炎的严重程度。Toyoshima等[15]发现根除Hp后患者内镜下京都胃炎分类评分显著下降,主要是皱褶增大、结节和弥漫性红色评分的降低,与本文结论相符。
共识指出,慢性胃炎尤其是慢性萎缩性胃炎的发生与Hp感染密切相关,我国萎缩性胃炎患病率较高,内镜下诊断的敏感性低,需与病理检查结果结合做出最终诊断[9]。本研究中不同DOB值患者镜下萎缩表现及分布范围均无明显差异,组织学萎缩、肠化与DOB值的高低也无相关性,可能的解释是Hp所致的慢性炎症可使黏膜萎缩、腺体减少,萎缩肠化生的黏膜不利于Hp定植,Hp密度反而降低。Rasheed等[6]研究结果显示,Hp密度与萎缩呈正相关,但DOB值与萎缩无相关性。因此,DOB值难以预测萎缩的严重程度。根除Hp后胃黏膜炎症消退,萎缩/肠化生发展可以停止或减缓,部分萎缩可以逆转,但肠化生不能逆转[3]。Toyoshima等[15]发现根除Hp后患者萎缩和肠化评分没有变化。
DOB值是否能预测Hp负荷尚无定论。有研究提示DOB值与病理Hp负荷和炎症程度分级匹配[4-5]。Matthews等[7]的研究结果显示,中-重度胃炎患者的DOB值显著高于无-轻度胃炎患者,但DOB值与细菌负荷无明显相关性。本研究发现Hp密度与DOB分组之间存在正相关性,支持DOB值可以反映Hp负荷的观点。目前认为高细菌负荷与胃黏膜急性损伤的加重和胃黏膜的长期改变有关,行Hp根除治疗后,细菌密度降低对改善胃黏膜变化有积极的作用[16]。因此,建议对DOB值较高的患者进行随访及进一步内镜检查,DOB值较高患者根除Hp的意义更大。
国内常用的DOB临界值为2~6,共识指出UBT检测结果在临界值附近难以判断结果,应结合其他检测方法的结果判定或间隔2~3天重新检测[4]。本研究发现,在DOB值为4~8的患者中,有很大一部分胃黏膜组织病理检查提示Hp阴性,与共识观点一致。因此DOB值≥8对诊断Hp感染有更确切的意义,此时对Hp进行根除治疗更可靠。
本研究为回顾性研究,尽管我们在数据入组阶段进行严格控制,难免存在偏差,另外样本量有限,因此影响了一些数据分析。今后需进一步大样本、前瞻性、随机对照研究。下一步研究还包括DOB值是否可以预测Hp根除效果或在DOB什么范围根除效果最佳[17-18]、Hp菌株基因型的分析与DOB值的相关性等。
综上所述,Hp感染后症状不典型,需辅助检查协助判断。Hp感染会造成胃黏膜的损伤,引起组织炎症,反复炎症可使黏膜萎缩、腺体减少,DOB值对胃内Hp密度、胃炎严重程度有一定的独立预测价值,能间接反映胃黏膜内镜下及组织炎症程度,但不能反映萎缩/肠化的程度。
